黄芩素通过Smad信号通路抑制TGF-β1诱导的HSC-T6细胞活化
吉家兴,马 俊,李 博,王丽萍,许 鸣*
(广东省第二人民医院 1.药学部,2.消化内科,广东 广州 510317;3.佛山市第二人民医院消化科,广东 佛山 528031)
转化生长因子β(transforming growth factor-β,TGF-β)是一种促纤维化细胞因子,在大部分器官系统纤维化的发展中起着核心作用。肝星状细胞(Hepatic stellate cell,HSC)是各种原因导致肝纤维化发生纤维化的最终共同途径。研究表明,TGF-β可诱导HSC增殖和分化[1]。前期研究显示,黄芩素可抑制TGF-β1诱导的HSC-T6细胞活化,其机制与其抑制NADPH氧化酶(NADPH oxidase,NOX)介导的活性氧(reactive oxygen specices,ROS)的产生有关。Smad信号通路在TGF-β介导的纤维化过程中起核心调控作用[2]。本研究拟以HSC-T6细胞为研究对象,阐明黄芩素是否通过Smad信号通路抑制TGF-β1介导的HSC-T6活化。
1 材料与方法
1.1 材料
大鼠肝星状细胞株(HSC-T6)购自上海复祥生物科技有限公司,具有活化HSC的表型;黄芩素购自成都曼思特生物科技有限公司(质量分数>98%);RPMI1640培养基购自Gibco公司;胎牛血清购自吉泰生物公司;鼠抗α-SMA单克隆抗体购自武汉博士德生物工程有限公司;磷酸化Smad 2和Smad 3单克隆抗体购自美国Cell Signaling公司;总Smad 2和Smad 3单克隆抗体为美国Bioworld公司产品。
1.2 方法
1.2.1 细胞的培养 HSC-T6放在含有10%胎牛血清的DMEM高糖培养基的培养瓶内,在37 ℃,50%CO2及饱和湿度下培养,传代至6孔板或15 cm2培养瓶内。除对照组和TGF-β1(5 μg/L)刺激组外,其他加药组分别加入各终浓度的黄芩素预处理HSC-T6细胞30 min后,再加入含TGF-β1(5 μg/L)的DMEM培养液处理细胞48 h。
1.2.2 细胞的分组 细胞分6组,A组:空白对照组;B组:TGF-β1刺激组;C组:TGF-β1+125 nmol/L黄芩素组;D组:TGF-β1+250 nmol/L黄芩素组;E组:TGF-β1+500 nmol/L黄芩素组;F组:TGF-β1+1 000 nmol/L黄芩素组。黄芩素剂量参照文献[3]。
1.2.3 免疫细胞化学 取出细胞爬片,4%多聚甲醛固定30分钟,灭活内源性过氧化物酶,滴加适当稀释的一抗,4℃过夜后在37℃复温45分钟,滴加生物素化二抗,DAB显色,加试剂盒中A、B、C试剂各1滴,混匀加至爬片,苏木素轻度复染。脱水、透明、封片。每组图片取6个视野,采取日本OLYMPUS摄像系统和日本MetaMorph/BX41图像数据分析系统测定平均光密度值,光密度值越大,代表样本中目的蛋白含量越多。
1.2.4 Western blot法 细胞用RIPA裂解缓冲液加PMSF冰上裂解30 min,收集裂解物,于4 ℃、12 000 r/min离心30 min,BCA法测定蛋白浓度。蛋白上样量为50 μg,进行10%聚丙烯酰胺凝胶电泳2 h,再转移到PVDF膜上,封闭3 h,加入一抗,4 ℃过夜。次日辣根过氧化物酶标记的二抗孵育1 h,后洗膜4次,最后用发光剂进行检测,曝光、显影,以β-actin作为内参,分别以目的蛋白与β-actin光密度比值作为该目的蛋白的相对表达量。
1.3 统计方法
应用SPSS 17.0统计软件进行分析,计量数据使用均数±标准差表示,组间均数比较采用方差分析后,进行双侧t检验。取α=0.05为检验水准,以P<0.05为差异具有显著性。
2 结 果
2.1 黄芩素对TGF-β1诱导活化的HSC-T6细胞α-SMA表达的影响
免疫细胞化学结果如图1所示,各组相对密度分析如图2所示,与对照组比较,TGF-β1处理后,HSC-T6细胞α-SMA表达明显增加;与TGF-β1处理组比较,黄芩素预处理后,随着黄芩素浓度的增加ɑ-SMA表达显著下降(F=72.40,P<0.05),并呈现剂量依赖效应,其中500 nmol/L黄芩素预处理组作用最强,因此选择500 nmol/L黄芩素预处理做后续试验。
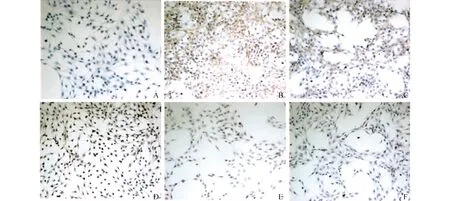
图1 免疫组织化学分析HSC-T6细胞α-SMA表达(HE 200×)
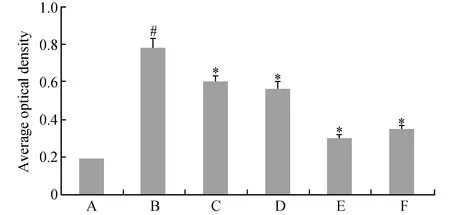
图2 HSC-T6细胞α-SMA表达的相对密度分析A组:对照组;B组:TGF-β1刺激组;C组:TGF-β1+125 nmol/L黄芩素组;D组:TGF-β1+250 nmol/L黄芩素组;E组:TGF-β1+500 nmol/L黄芩素组;F组:TGF-β1+1 000 nmol/L黄芩素组.与对照组比较,#P<0.01;与TGF-β1刺激组比较,*P<0.05
2.2 黄芩素对TGF-β1诱导活化的HSC-T6细胞Smad表达的影响
Western blot法实验结果表明,HSC-T6细胞经TGF-β1作用后,与对照组相比,Smad磷酸化水平p-Smad 2、p-Smad 3明显上调(t=5.841、7.453,P<0.01)。经500 nmol/L黄芩素预处理后,p-Smad 2、p-Smad 3表达与TGF-β1处理组比较p-Smad 2、p-Smad 3表达差异无统计学意义(t=1.886、1.638,P>0.05)。
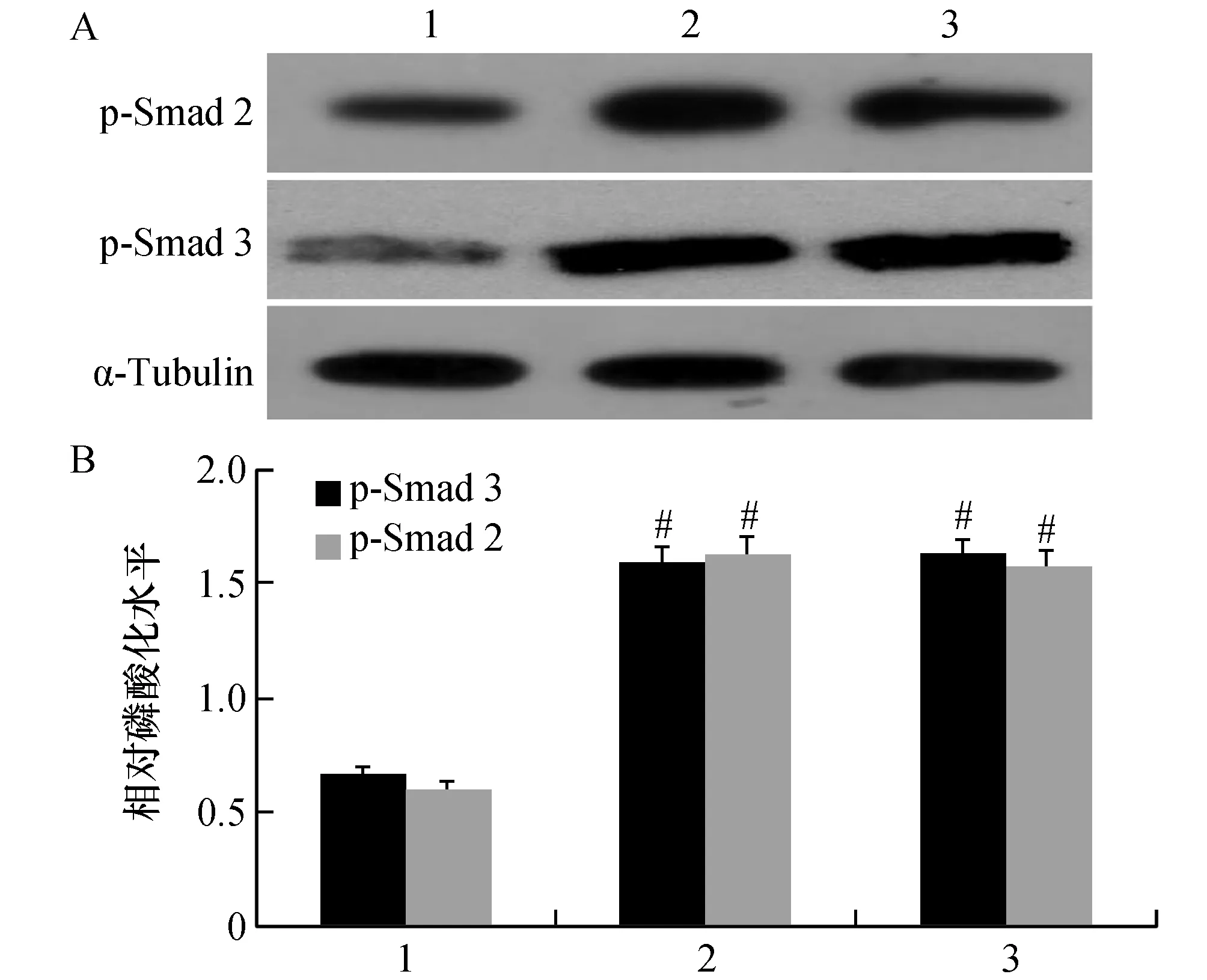
图3 黄芩素对TGF-β1诱导活化的HSC-T6细胞Smad表达的影响A:蛋白电泳图;B:蛋白表达的相对密度图1:对照组;2:TGF-β1刺激组;3:TGF-β1+500 nmol/L黄芩素组.与对照组比较,#P<0.01
3 讨 论
TGF-β能够促进肝纤维化,其机理与其能显著促进肝星状细胞的增殖与活化有关。前期研究表明,给予TGF-β1处理HSC-T6细胞后,HSC-T6细胞的增殖活性明显增强,本实验中亦观察到TGF-β1刺激HSC-T6细胞后,后者α-SMA表达升高,给予黄芩素预处理细胞可抑制TGF-β1诱导HSC-T6细胞的α-SMA表达升高,说明黄芩素抑制TGF-β1诱导HSC-T6细胞的活化。
NOX是一组含血红素的跨膜蛋白,是吞噬细胞和非吞噬细胞的重要ROS产生因子[4]。已鉴定出NOX家族中的7个成员:Nox 1,NOX 2,NOX 3,NOX 4,NOX 5,双氧化酶1(Duox1)和双氧化酶2(DUOX 2)。转化生长因子-β可诱导不同类型细胞中NOX 1、NOX 2和NOX 4等NOX酶的表达[5]。我们在前期实验中,观察到不同浓度(125、250、500、1 000 nmol/L)黄芩素预处理HSC-T6后细胞内NOX的活性显著低TGF-β1处理组,而500、1 000 nmol/L黄芩素组NOX的活性比较无明显差异;黄芩素预处理后HSC-T6后细胞内ROS表达较TGF-β1刺激组明显下降,说明黄芩素可通过抑制HSC-T6细胞内NOX活性,降低ROS的产生,从而抑制由TGF-β1诱导的HSC-T6细胞活化。
TGF-β1与细胞膜上的Ⅱ型受体(TGF-βR-II)结合,激活I型受体(TGF-βR-I),导致Smad 2和Smad 3磷酸化。磷酸化的Smad 2和Smad 3与共同介质Smad 4形成复合物转位到细胞核,通过与靶基因启动子中存在的Smad结合元件结合而调控基因转录[6]。研究发现,TGF-β1通过smad 2/3途径在多种病理条件下的肝纤维化的发展中起着核心作用[7]。因此,我们以TGF-β1/Smad信号通路为靶标,进一步研究黄芩素通过降低NOX活性下调的ROS,是否通过Smad途径达到抑制HSC-T6活化的目的。实验发现,HSC-T6经500 nmol/L黄芩素预处理后,p-Smad 2、p-Smad 3表达与TGF-β1处理组比较p-Smad 2、p-Smad 3表达差异无统计学意义。本研究表明TGF-β1可以通过smad 2/3途径诱导HSC-T6细胞活化。黄芩素虽然可以通过其抗氧化特性抑制TGF-β1诱导的HSC-T6细胞活化,但将其作用于HSC-T6后未能影响p-Smad 2、p-Smad 3的表达。研究表明,通过其他非经典途径,包括丝裂原活化蛋白激酶(MAPK)途径、磷脂酰肌醇-3-激酶(PI3k)途径和Rho-类似GTP酶途径等途径的信号传递对TGF-β的促纤维化活性也是至关重要的[8-9]。
综上所述,本研究结果表明,黄芩素可能不是通过Smad信号途径影响HSC-T6的活化。黄芩素是否通过非经典途径如MAPK等途径抑制TGF-β表达,达到其抗肝纤维化的作用是我们下一步研究的目标。

