注射多巴胺对中华绒螯蟹打斗行为的影响
代 亮,李晓东,李 艺,刘汉堤,曹 萌,郑 岩,孙 娜
( 1.大连海洋大学,辽宁 大连 116023; 2.盘锦光合蟹业有限公司研发中心,辽宁省中华绒螯蟹育种重点实验室,辽宁光合河蟹专业技术创新平台,企业工程技术研究中心,辽宁 盘锦 124200; 3.沈阳农业大学,辽宁 沈阳 110866 )
2018年全国水产品总产量64 576 558 t,产值1.2815万亿元,淡水产品总量约占总产量的48.9%,而淡水养殖产量占淡水产品总量的93.8%,为29 598 384 t,是我国淡水产品的主要来源。在淡水养殖中,中华绒螯蟹产量756 877 t,产值约800亿元,是淡水甲壳类养殖重要经济物种。与同为淡水甲壳类养殖重点的凡纳滨对虾(Litopenaeusvannamei)产量相近,但总产量不足淡水养殖鱼类中草鱼(Ctenopharyngodonidellus)的1/7(5 540 301 t),而几个养殖种类的产量主要靠池塘养殖获得[1]。但从目前中华绒螯蟹的单位面积产量水平来分析,其占有的池塘水面资源要多于凡纳滨对虾和草鱼[2-4]。中华绒螯蟹正面临产量增长瓶颈,在水资源和空间资源紧缺的情况下,中华绒螯蟹的种内打斗行为已经成为影响其成活率和单位面积产量的重要因子,解决其种内打斗行为所带来的巨大经济利益与生态效益可以预见。
影响中华绒螯蟹打斗行为的因素众多[5-7],魏鸿擎等[8]研究表明,水生动物的攻击行为受神经系统和神经递质控制。多巴胺是一种影响攻击行为的重要神经递质[9],在人类社会中,社会排斥与社会接纳是影响个体攻击的重要因素,感到被排斥的个体会因愤怒而表现出敌意和攻击行为[10],而多巴胺功能系统较弱的人暴力行为增加[11]。哺乳动物和昆虫的攻击行为受多种激素调节,多巴胺和五羟色胺等神经递质是其中重要部分[12]。相关研究显示,神经酪氨酸激酶缺陷型的斑马鱼(Daniorerio)体内单胺系统受到影响,具有更强烈的焦虑性,导致斑马鱼具有更强的攻击性[13]。注射多巴胺后克氏原螯虾(Procambarusclarkii)的游泳行为显著增强[14];Péqueux等[15]测定了中华绒螯蟹体内各种神经递质的含量,为注射和外源介入神经递质提供了依据。可引起甲壳动物生理调节的外源介入多巴胺剂量已有研究[16]。但是,多巴胺对1龄中华绒螯蟹打斗行为的影响尚未见报道。笔者研究了不同剂量多巴胺对1龄中华绒螯蟹打斗行为的统计学影响,量化分析了打斗行为的程度,统计分析了打斗时长、打斗次数及胜负关系,以探索中华绒螯蟹打斗行为机制以及采用外源神经递质来控制中华绒螯蟹的打斗行为,降低打斗损失,提高养殖成活率。
1 材料与方法
1.1 材料
试验用中华绒螯蟹为盘锦光合蟹业有限公司选育的中华绒螯蟹新品种“光合1号”。选取100只规格相近、健康有活力的同一家系中1龄雄蟹,于30 cm直径的白色塑料桶中暂养30 d。
暂养期间,每日18:00投喂试验蟹体质量10%的人工配合饲料。投喂2 h后换水,暂养水体持续充气。定期检测水体pH(7~8)、溶解氧(≥2 mg/L)、盐度(0~0.5)。暂养结束后,选取规格一致的中华绒螯蟹30只,体质量(9±0.5) g,体长(25±1.5) mm,体宽(27±1.5) mm,体高(12±0.6) mm,分成15组,每组2只。
1.2 方法
试验设3个剂量组、1个对照组。将多巴胺盐酸盐(北京北纳创联,纯度98%)分别溶解在无菌生理盐水中至浓度为5×10-4mol/L、5×10-3mol/L、5×10-2mol/L。将这3种浓度溶液按每只20 μL的剂量,迅速注射到中华绒螯蟹第三步足的动脉膜中,分别达到10-8、10-7、10-6mol的量。空白对照组注射20 μL生理盐水。每组设3个平行。
1.2.1 打斗行为的观察
将中华绒螯蟹用无毒、无味树胶水彩标记后,将其置于直径20 cm、高40 cm(底部均匀钻取12个孔洞,孔洞直径为5 mm)的PE管中。PE管置于120 L水槽中,加水至水面高度30 cm(图1)。底质选取经30目网袋过滤后的细沙,用高锰酸钾消毒后,反复冲洗,均匀铺于水槽中,厚度不超过中华绒螯蟹体厚。为避免水体环境变化引起中华绒螯蟹的应激行为,用2个不透明烧杯将2只中华绒螯蟹分别倒扣在试验容器中,并置于PE管两侧1 h。试验开始时,将烧杯取出,向中华绒螯蟹体内注射预设剂量多巴胺,注射后用烧杯倒扣,并同时取出,开始观察记录。利用闭路摄像头记录2只中华绒螯蟹打斗情况,记录4 h内的打斗时长、打斗次数、打斗分数及胜负关系等指标。
1.2.2 抽取血淋巴
打斗试验结束时,迅速用无菌1 mL注射器在蟹第三或第四步足基部对中华绒螯蟹及3只未进行打斗试验的暂养蟹进行血淋巴抽取。血淋巴样品与1%柠檬酸钠以1∶1比例混合,以1600 r/min离心10 min,所得血浆于-70 ℃保存。使用ELISA酶联免疫法测定多巴胺含量[17],所用试剂盒购自上海朗顿生物科技有限公司。
图1 打斗试验装置
1.2.3 打斗强度评分标准
打斗强度评分标准[18]见表1。
1.2.4 胜负关系判定
初次打斗结束后逃跑一方,且在之后打斗行为中均呈现逃跑状态,则判定为失败方;另一方为胜利方。
1.2.5 样本前处理
标本采集后置于-20 ℃保存。检测前放至室温,血清自然凝固10~20 min,离心20 min(2000~3000 r/min)。仔细收集上清液,保存过程中如出现沉淀,应再次离心。
1.2.6 样本检测流程
准备试剂,样品和标准品→加入准备好的样品和标准品,生物素抗原,37 ℃反应30 min→洗板5次,加入亲和素-HRP,37 ℃反应30 min→洗板5次,加入显色液A、B,37 ℃显色10 min→加入终止液→10 min之内读OD值→计算。
1.3 数据处理
T=∑ti
S=∑si
式中,T为打斗总时长,S为打斗强度,i为打斗次数,t为每次打斗时长,s为每次打斗得分。

表1 打斗强度评分标准

图2 触碰对手

图3 推拉对手
试验数据用平均值±标准差表示,采用SPSS 21.0、Excel 2010等软件整理、处理,用Excel常规统计后,用SPSS进行单因素方差分析、独立样本t检验及Duncan多重比较。显著性水平为0.05。对注射不同剂量多巴胺情况下中华绒螯蟹的打斗时长、打斗次数、打斗强度及胜负关系进行相关分析。
2 结果与分析
2.1 注射不同剂量多巴胺中华绒螯蟹的打斗时长
各剂量组中华绒螯蟹打斗时长见表2。对试验组中华绒螯蟹打斗时长进行分析后可知,不同剂量多巴胺对中华绒螯蟹打斗时长影响极显著(P<0.01)(图4)。对照组打斗时间最长,与注射组差异显著(P<0.05);注射组中,随注射量的增加,打斗时长呈现下降趋势,10-8mol组与其余各组差异显著(P<0.05);10-7mol组与10-6mol组差异不显著(P>0.05),与其余各组差异显著(P<0.05)。对照组在第3 h阶段时长最高,10-6mol组在第2 h阶段最高,其余各组均随时间延长呈现下降趋势(图5)。

表2 各组中华绒螯蟹的打斗时长
注:上标不同字母的平均值间差异显著(P<0.05),上标相同字母的平均值间差异不显著(P>0.05),下同.

图4 各组中华绒螯蟹打斗时长
2.2 注射不同剂量多巴胺的中华绒螯蟹的打斗强度
各剂量组中华绒螯蟹打斗强度见表3。对各剂量组中华绒螯蟹打斗强度进行分析后可知,不同剂量多巴胺对中华绒螯蟹打斗强度影响极显著(P<0.01)(图6)。对照组打斗强度低于10-8mol组,高于其他注射组,且与注射组各浓度间差异显著(P<0.05)。注射组中,随注射多巴胺量升高,打斗强度呈现下降趋势,10-8mol组打斗强度最高,各组间差异显著(P<0.05)。对照组与10-8mol组打斗强度呈现上升趋势,至第3 h阶段达到最高,随后下降;10-7mol组升至第2 h阶段达到最高,随后下降;10-6mol组升至第2 h阶段达到最高,随后降至第3 h阶段后再次上升(图7)。
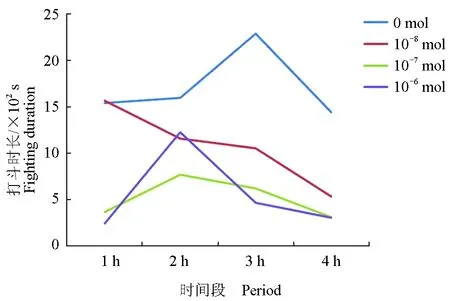
图5 各组4 h时中华绒螯蟹打斗时长分布
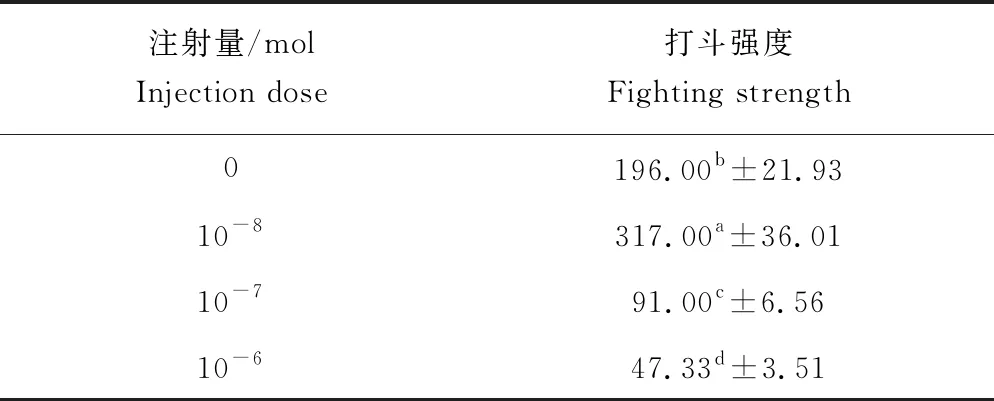
表3 各组中华绒螯蟹打斗强度
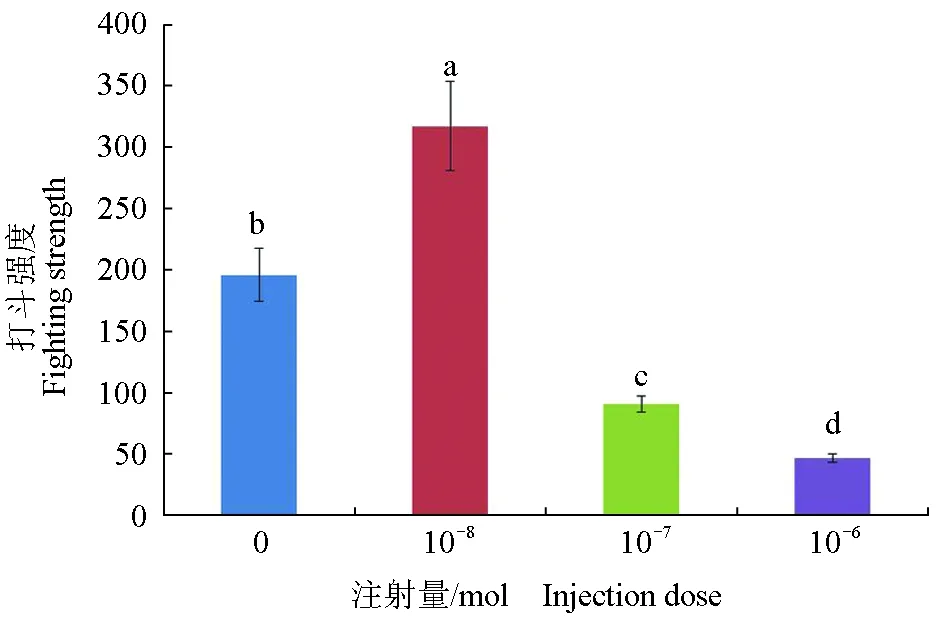
图6 各组中华绒螯蟹打斗强度

图7 各组中华绒螯蟹打斗强度4 h分布
2.3 注射不同剂量多巴胺的中华绒螯蟹的打斗次数
各剂量组中华绒螯蟹打斗次数见表4。对数据进行分析后,不同剂量多巴胺对中华绒螯蟹打斗次数影响极显著(P<0.01)(图8)。对照组与10-7mol组差异不显著(P>0.05),与其余各组差异显著(P<0.05)。注射组中,随注射量的增加,打斗次数呈现下降趋势。其中,10-8mol组与其余各组差异显著(P<0.05);10-7mol组与10-6mol组差异不显著(P>0.05)。由图8可知,对照组随时间延长,打斗次数呈现上升趋势;10-8mol组打斗次数在前3 h阶段打斗次数相近,在第4 h阶段呈现下降趋势;10-7mol组与10-6mol组在第1 h阶段打斗次数较低,随时间延长打斗次数先升后降(图9)。

表4 各组中华绒螯蟹打斗次数

图8 各组中华绒螯蟹打斗次数

图9 各组中华绒螯蟹4 h的打斗次数分布
2.4 注射不同剂量多巴胺中华绒螯蟹的体内多巴胺的含量
打斗结束后,各剂量组胜负双方体内多巴胺含量见表5。胜负关系导致中华绒螯蟹体内多巴胺含量不同(P<0.05)。胜利方体内多巴胺含量显著高于失败方(P<0.05),与正常水平多巴胺体内含量差异不显著(P>0.05),正常水平多巴胺含量显著高于失败方(P<0.05)。各剂量组间多巴胺含量差异不显著(P>0.05)(图10)。
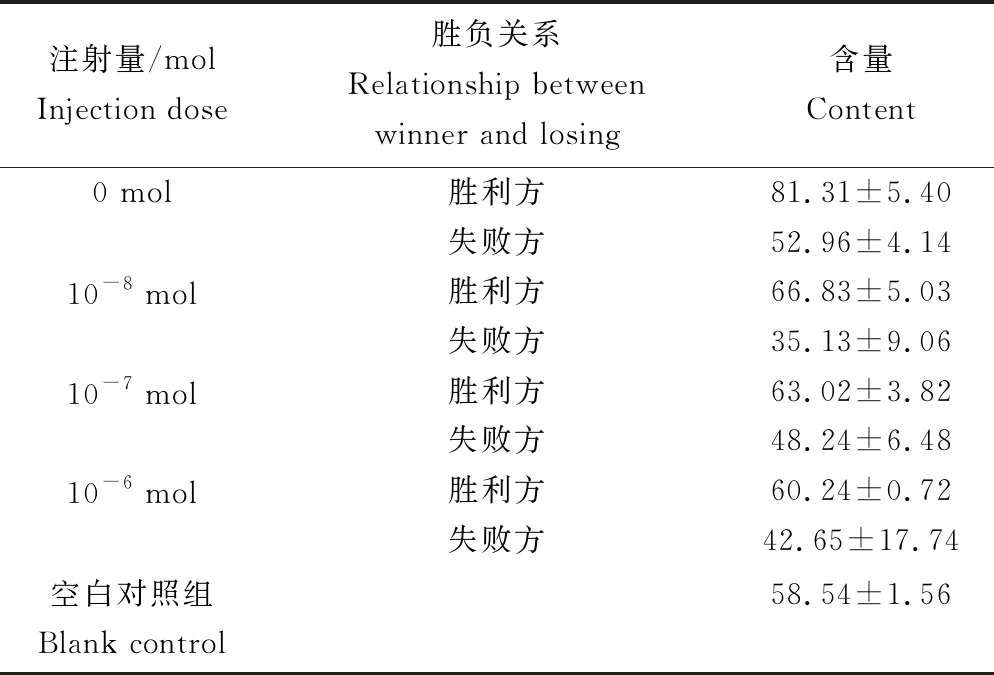
表5 打斗结束时各剂量组多巴胺含量 ng/mL

图10 打斗结束后各剂量组多巴胺含量
3 讨 论
3.1 注射多巴胺对中华绒螯蟹打斗行为的影响
神经递质对甲壳动物打斗行为的影响研究表明,儿茶酚-O-甲基转移酶(COMT)通过调节多巴胺的分解代谢调控三疣梭子蟹(Portunustrituberculatus)的攻击行为。多巴胺含量升高时,儿茶酚-O-甲基转移酶的编码基因PtCOMT表达量增加,三疣梭子蟹攻击行为增强[17]。中枢五羟色胺能系统抑制多巴胺的功能[19]。神经递质五羟色胺能够降低中华绒螯蟹互残的残肢率,提高成活率[20];能抑制锯缘青蟹(Scyllaserrata)打斗行为[21];可促进克氏原螯虾的攻击行为,当与氟西汀共同注射时,攻击行为减弱[22]。
本试验中,打斗时长与打斗强度结合分析表明,对照组中华绒螯蟹的打斗行为倾向于长时间、低强度的追逐攻击,注射量为10-8mol时攻击行为多呈现高强度、短时间的对螯、抱摔等攻击行为。10-8mol组中华绒螯蟹打斗次数高于对照组,说明在10-8mol剂量下,促进了中华绒螯蟹的打斗次数与打斗行为。赵玉超等[23]给3种养殖对虾注射多巴胺后,显著促进了对虾的攻击行为,与本试验结果一致。有研究结果显示,欧洲寄居蟹(Pagurusbernhardus)攻击行为与体内多巴胺水平呈正相关,随试验时间延长,多巴胺水平下降时,攻击行为减弱[24]。10-8mol组中华绒螯蟹的打斗行为主要集中在前3 h,第4 h明显下降。打斗结束时,各注射组胜利方体内多巴胺含量与正常水平的空白对照组相同,失败方低于正常水平,其原因是由于中华绒螯蟹体内多巴胺含量下降[25],导致攻击行为减弱。
当多巴胺注射量达到10-7mol时,中华绒螯蟹打斗时长和打斗强度均呈现下降趋势,说明该剂量下中华绒螯蟹多呈现短时间、低强度的追逐行为,10-7mol组的打斗次数与对照组差异不显著。结果表明,注射量增加至10-7mol,中华绒螯蟹打斗次数未发生变化,但打斗强度得到抑制。当注射剂量达到10-6mol时,打斗次数、打斗强度以及打斗时长均显著降低,中华绒螯蟹打斗频率与打斗强度均得到抑制,且活动能力减弱。Hoglund等[26]研究发现,口服多巴胺可使北极红点鲑(Salvelinusleucomaenis)的应激诱导受到抑制,从而降低其攻击行为。Martinez等[27]研究表明,注射多巴胺后,黑背蟹(Gecarcinuslateralis)的运动活性降低;当同时注射多巴胺拮抗剂氟哌啶醇时,这种作用被阻断。高剂量多巴胺会使爬行动物产生恶心、眩晕等非特异性抑制,降低其攻击行为[28];亦会抑制鳜鱼(Sinipercachuatsi)的摄食[29]。结合本试验结果分析,当注射量升高时,多巴胺对中华绒螯蟹产生非特异性抑制,对其运动能力产生影响,导致打斗行为下降。试验视频显示,10-7mol组与10-6mol组中的中华绒螯蟹,在试验开始时呈现肢体舒张、静止不动的状态,随试验时间延长此状态逐渐缓解。打斗结束后,由于多巴胺代谢[23],其抑制作用减弱,中华绒螯蟹运动能力得到增强。相关研究也表明,高剂量多巴胺会影响甲壳动物免疫系统,降低其代谢能力[30]。此剂量范围是否影响中华绒螯蟹免疫系统,降低其代谢能力,抑制打斗行为,有待进一步研究。关于多巴胺在中华绒螯蟹体内代谢时长及其在打斗行为中作用机理亦需进一步探讨。
3.2 中华绒螯蟹打斗后的胜负关系与体内多巴胺含量
分析打斗结束后,各组胜利方多巴胺含量高于失败方。Sneddon等[31]研究结果表明,岸蟹(Carcinusmaenas)的打斗强度与打斗行为受到体内多巴胺水平的影响。打斗结束后,获胜者体内多巴胺水平高于失败者,与本试验结果一致。当打斗双方胜负关系确立后,失败方长期处于逃避胜利方攻击的状态中,其攻击行为显著下降。相关研究表明[32],多巴胺拮抗剂可以使胜负关系确立的胜利方小鼠攻击行为下降,使胜利者效应减弱;多巴胺作为一种奖励机制神经递质,具有一定补偿性,饱食状态与长期饥饿状态的螺类多巴胺水平相近[33];多巴胺作为一种补偿性神经递质参与缢蛏(Sinonovaculaconstricta)的损伤修复过程[34]。本试验中,中华绒螯蟹在打斗过程中,多巴胺作为一种奖励机制神经递质[35]可使胜利方保持胜利者效应,当面对失败方时,其打斗次数与打斗强度始终高于失败方。多巴胺的补偿作用抑制了中华绒螯蟹打斗损伤造成的攻击行为弱化,导致胜利方的攻势较失败方更为强烈。在不利环境因素中,水生生物体内多巴胺含量会减少,其个体生长与攻击行为随之减弱[36],打斗失败后,在优势方不断进攻的情况下,失败方处于不利环境因素中,其体内多巴胺含量低于正常水平,导致其打斗行为显著减弱[37]。
4 结 论
本试验结果表明,多巴胺注射剂量在10-8mol时,促进了中华绒螯蟹打斗行为;随着多巴胺注射剂量的增加,中华绒螯蟹打斗行为整体呈现减弱趋势。打斗结束后,胜利方体内多巴胺水平高于失败方,失败方低于正常含量水平。

