铜、锌对泥鳅细胞DNA损伤及金属硫蛋白表达的影响
姜 姗,李 霞,李状状,杨艳津,王 钰,朱元辰,秦艳杰
( 大连海洋大学,辽宁省海洋生物资源恢复与生境修复重点实验室,农业农村部北方海水增养殖重点实验室,辽宁 大连 116023 )
生物标志物监测是现代毒理学效应评估的主要手段,可以有效地评估重金属暴露对生物体的毒性效应和对生态环境的健康风险。理想的生物标志物要求能够敏感有效地反映出生物体发生严重损伤之前的生物学指标变化,并能准确评估生物体所处的污染状态及其潜在危害,为严重毒性效应的出现提供早期警报[1]。体外培养的鱼类细胞可以直接和污染物接触,具有灵敏度高、均一性好、观察方便等特点,是毒理学研究中理想的生物标志物。早在1968年研究者首次利用体外培养的鱼类肌肉细胞系检测环境中锌的毒性作用,得出细胞存活率与锌离子浓度之间呈正相关的毒性效应[2]。之后的系列毒性效应研究结果表明,重金属因种类、状态、细胞系类别和代数不同,其毒性效应差别明显[3-7],锌和铜两种重金属对大多数细胞系表现为中度毒性,但毒性效应并没有一定的规律性。
生物体内DNA、RNA等遗传物质受内外因素影响会发生断裂、缺失等损伤,从而引起系列的遗传损伤。遗传损伤常用的检测方法包括DNA电泳、彗星试验、微核等。研究发现,草鱼(Ctenopharyngodonidellus) ZC7901细胞[8],野生细鳞(Theraponjarbua)鳍细胞系(JF细胞),罗非鱼(Oreochromis)卵巢细胞系(TO-2细胞)[9],乌鳢(Channaargus)肝细胞[10],金头鲷(Sparusaurata)SAF-1细胞系[11],泥鳅(Misgurnusanguillicaudatus)DIMF、TRMF细胞系[12-13]等在不同重金属诱导下均出现不同程度的DNA特异降解、断裂和损伤,从而导致细胞凋亡。细胞损伤程度和凋亡比例与重金属种类、重金属浓度及细胞种类有关。金属硫蛋白是细胞内与重金属结合相关的特异性蛋白质,其生理功能主要包括调节细胞内金属离子含量、抗氧化作用、参与细胞调节、免疫调节等。另外,由于金属硫蛋白能够响应重金属胁迫,并在一定范围内反映重金属污染及其毒性效应的程度,早在20世纪70年代就有学者指出,水生动物金属硫蛋白可以作为指示水环境重金属污染物毒性效应早期预警的重要生物标志物,用以评价重金属污染物的毒性,指示重金属对生物体和环境的污染程度[14]。
笔者以实验室此前建立的泥鳅鳍细胞系为试验材料,探究硫酸铜和氯化锌对泥鳅鳍细胞系的遗传学损伤及金属硫蛋白基因表达的影响,旨在探究必需重金属对泥鳅细胞的遗传毒性,为研究重金属的生理学功能及重金属环境监测提供理论依据。
1 材料与方法
1.1 试验材料
试验所用60~70代泥鳅鳍细胞系(DIMF)是大连海洋大学细胞工程实验室于2012年建立的。细胞系培养采用含15%胎牛血清(FBS,Omega)的DME/F12培养基于25 ℃、5% CO2的恒温培养箱中培养。
1.2 试验方法
1.2.1 细胞系染毒处理
取处于对数生长期、生长状态良好的鳍细胞系,用0.25%的胰蛋白酶消化处理贴壁细胞成悬浮细胞,用血球计数板计算出细胞密度并调整到密度为2×105个/mL,每孔以200 μL的量接种到96孔板上,或者以5 mL的细胞量接种到25 mL细胞培养瓶中。在恒温培养箱(5% CO2,25 ℃)中培养24 h后,弃去旧细胞培养液,加入相同体积、添加浓度为0、200、400、800、1600 μmol/L氯化锌的新细胞培养液;另一个试验添加浓度为0、100、200、400、800 μmol/L硫酸铜的细胞培养液,每个浓度设3个平行组,然后放置于25 ℃、5% CO2恒温培养箱继续培养24 h。
1.2.2 单细胞凝胶电泳试验(彗星试验)
单细胞凝胶电泳试验参照文献[15]的方法进行,并略有改动。取预热的磨砂载玻片浸入45 ℃、0.7%的正常熔点琼脂糖中,迅速加盖玻片使胶铺平,放置于4 ℃固化过夜,制成第一层胶。取下盖玻片,将各浓度分别染毒的细胞处理成悬液,以1∶7的比例与37 ℃、0.8%琼脂糖(0.08 g低熔点琼脂糖溶于7 mL TAE缓冲液中)混合,取混合液100 μL加到第一层胶上,盖上盖玻片,4 ℃固化10 min。固化好的载玻片在冰冷的碱性裂解液中低温避光裂解1 h。从裂解液中取出载玻片,用蒸馏水将其冲洗3次,然后放置于电泳液(0.186 g Na2EDTA和6 g NaOH溶于500 mL去离子水中,pH调整为13.0)中,低温避光解旋30 min。设置电压为25 V,电流为200 mA,调整电泳液液面使电流保持为200 mA,低温避光电泳30 min。电泳结束后,取出载玻片,用蒸馏水清洗3次,保存于潮湿的片盒中,观察时每片滴加25 μL 20 μg/L的溴化乙啶,盖上盖玻片即可进行观察。
在波长为460 nm时用200倍荧光显微镜观察并拍照。用彗星分析软件(CASP)处理分析彗星试验结果图,每个浓度处理分析200个细胞,测量拖尾率、彗星尾长、彗尾DNA比例、彗星尾距和Olive尾矩5项数据。
1.2.3 金属硫蛋白表达量的测定
将不同浓度氯化锌和硫酸铜染毒的细胞用胰蛋白酶处理成悬浮细胞,放置离心管中以4000 r/min离心3 min,用1 mL磷酸缓冲盐溶液重悬,按照总RNA提取试剂盒(TaKaRa)的方法提取细胞总RNA,并用水平电泳仪和核酸分析仪检测RNA完整性、含量和纯度。根据测定结果将RNA质量浓度调整为500 ng/μL。按照全式金反转录试剂盒,以20 μL RNA反转录体系反转录成cDNA第一条链,-20 ℃保存备用。以泥鳅β-Actin基因(AB200265)作为内参基因,根据参考文献[16]设计金属硫蛋白扩增引物。按照全式金实时荧光定量试剂盒步骤,以20 μL体系进行实时定量PCR,同时设置阴性对照组。试验结果以2-ΔΔCt法处理:
ΔΔCt=(样品Ct-内参Ct)-(对照Ct-内参Ct)
1.3 数据处理
试验结果以平均值±标准差表示,比较分析采用SPSS 16.0软件检验试验组与对照组之间的差异显著性,P<0.05表示存在显著差异。
2 结 果
2.1 硫酸铜对泥鳅鳍细胞系DNA损伤的影响
显微观察和对应的CASP彗星软件处理结果见图1。倒置荧光显微镜观察发现,正常未处理的细胞经裂解液裂解并电泳后,移动距离较短,且细胞多以圆形存在,边界较清晰(图1a);硫酸铜浓度为100 μmol/L时,细胞也接近圆形,但边缘有所扩大且模糊不清(图1b);硫酸铜浓度为200 μmol/L细胞边缘进一步扩大,且出现拖尾情况,尾部轮廓宽大呈放射状(图1c);当硫酸铜浓度为400、800 μmol/L时,多数细胞出现明显的拖尾情况,尾部范围逐渐扩大,且逐渐清晰拉长(图1d~e)。总体来看,随着硫酸铜浓度的升高,其彗星尾部范围逐渐增大。软件分析中各彗星图片的数量指标(表1)表明,当硫酸铜浓度为100 μmol/L时,仅拖尾率与对照组出现显著差异(P<0.05),其他4个指标均与对照组差异不显著(P>0.05)。当硫酸铜浓度为200、400 μmol/L和800 μmol/L时,5个数量指标均显著高于对照组(P<0.05)。

图1 硫酸铜处理后泥鳅鳍细胞系的彗星试验结果

表1 硫酸铜处理后泥鳅鳍细胞系的DNA损伤情况
注:同一列中,*表示与对照组差异显著(P<0.05),下同.
Note: * means significant different in the same column from the control group, et sequentia.
2.2 硫酸铜对泥鳅鳍细胞系MT表达量的影响
泥鳅鳍细胞系经不同浓度硫酸铜染毒处理24 h之后,细胞内金属硫蛋白mRNA相对表达量见图2,泥鳅细胞金属硫蛋白的表达量随着硫酸铜浓度的增大均呈先稳定后下降的趋势,在硫酸铜浓度为100 μmol/L时,金属硫蛋白表达量与对照组相比有所升高,但差异不显著(P>0.05)。当硫酸铜浓度为200、400、800 μmol/L时,金属硫蛋白表达量与对照组相比明显降低(P<0.01)。

图2 不同浓度硫酸铜对泥鳅鳍细胞内金属硫蛋白相对表达量的影响
2.3 氯化锌对泥鳅鳍细胞DNA损伤的影响
显微观察和对应的CASP彗星软件处理结果见图3。倒置荧光显微镜观察发现,正常未凋亡的细胞经裂解液裂解并电泳后,移动距离较短,且细胞多以圆形存在(图3a);氯化锌浓度为200 μmol/L时,细胞也接近圆形,但边缘有所扩大且模糊不清(图3b);氯化锌浓度为400、800 μmol/L时,细胞边缘进一步扩大,且出现拖尾情况,尾部轮廓宽大呈放射状(图3c~d);氯化锌浓度为1600 μmol/L时,多数细胞出现明显的拖尾情况,尾部清晰且拉长(图3e)。综合来看,可见随着氯化锌浓度的升高,彗星尾部从放射状逐渐清晰并拉长。
软件分析中各彗星图片的数量指标(表2)表明,当氯化锌浓度为200 μmol/L时,仅拖尾率与对照组差异显著(P<0.05),其他4个指标均与对照组差异不显著(P>0.05)。当氯化锌浓度为400、800、1600 μmol/L时,5个数量指标均与对照组差异显著(P<0.05)。

图3 氯化锌处理后泥鳅鳍细胞系的彗星试验结果

表2 氯化锌处理后泥鳅鳍细胞系的DNA损伤情况
2.4 氯化锌对泥鳅鳍细胞系金属硫蛋白表达量的影响
金属硫蛋白mRNA相对表达量的试验结果见图4,氯化锌浓度为200 μmol/L时,泥鳅鳍细胞中金属硫蛋白mRNA的表达量即显著高于对照组,在400 μmol/L氯化锌处理时其表达量达到最大值,是对照组的1.23倍,此后细胞内金属硫蛋白表达量急剧下降,在800、1600 μmol/L时表达量显著低于对照组,且1600 μmol/L时泥鳅鳍细胞系金属硫蛋白相对表达量接近于0。
3 讨 论
3.1 重金属引起泥鳅细胞DNA损伤的机理
重金属能够诱导鱼类细胞系凋亡或坏死,均可以表现为细胞内DNA损伤[8,10]。本研究彗星试验的结果显示,铜、锌两种重金属会不同程度地引起泥鳅细胞的DNA损伤。与对照组相比,当硫酸铜浓度为200 μmol/L,氯化锌浓度为400 μmol/L时,拖尾率、细胞彗尾DNA比例、彗星尾长、慧尾DNA比例、尾距和Olive尾距5个指标均显著高于对照组。且泥鳅细胞的DNA损伤程度与两种重金属浓度之间存在明显的剂量依赖关系,这种现象与谭凤霞等[17-19]的研究结果类似。分析认为,铜和锌均为生物体必需元素,参与多种酶催化的生化反应,但超过机体内必需浓度时,可诱导产生大量自由基,这些活性自由基攻击DNA链使其发生断裂,从而通过单细胞凝胶电泳可观察到明显的DNA损伤。
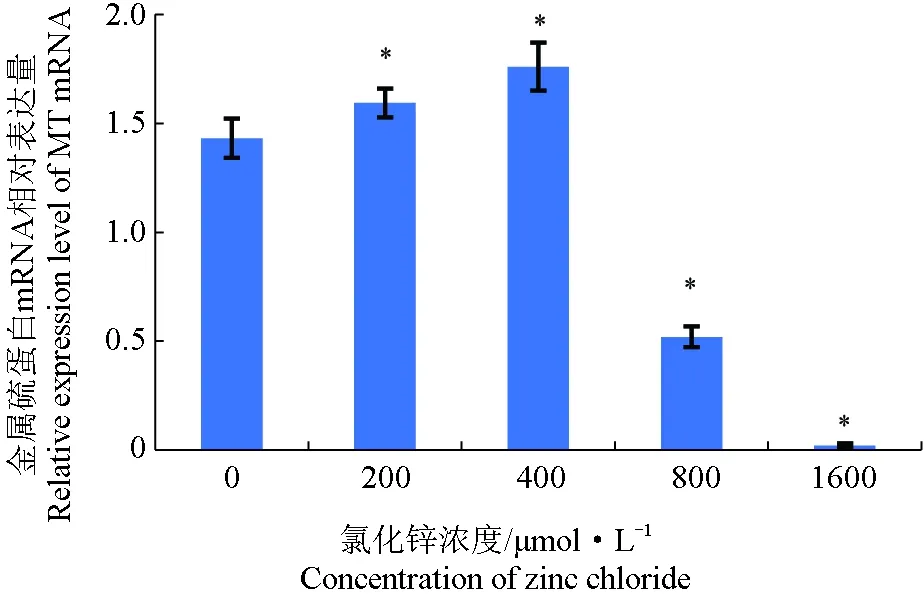
图4 不同浓度氯化锌对泥鳅鳍细胞内金属硫蛋白相对表达量的影响
3.2 铜和锌对泥鳅细胞金属硫蛋白的诱导作用
金属硫蛋白可以对进入生物有机体的重金属进行捕获和储存,进而降低其对生物体细胞和组织的毒性作用[20],因此在生物受到重金属胁迫的研究中经常被作为应激反应的指标。重金属在鱼体组织器官的积累的相关研究表明,鳍组织可能不是金属硫蛋白表达的最主要部位[21-22],因此,本试验对照组泥鳅鳍细胞系的金属硫蛋白表达量很低,这与王磊[23]在活体泥鳅鳍组织中金属硫蛋白表达量很低的报道相符。但是在重金属刺激下,细胞金属硫蛋白表达量会存在不同程度的诱导现象。本试验结果显示,硫酸铜处理后泥鳅细胞金属硫蛋白表达量仅在低浓度时维持与对照组一致的水平,随着硫酸铜浓度的升高金属硫蛋白表达量显著降低;而氯化锌处理后,泥鳅鳍细胞金属硫蛋白表达量显著升高,超过一定浓度后显著下降。说明一定范围的氯化锌胁迫后,泥鳅鳍细胞会通过金属硫蛋白的表达水平维持或增加,对相应重金属进行捕获和解毒,从而避免了重金属对细胞造成的DNA损伤、代谢紊乱、氧化损伤等。类似的解毒机制在Cheuk等[6,24]对斑马鱼尾鳍细胞系和肝细胞系中均有报道。超过一定浓度范围的硫酸铜和氯化锌处理,重金属诱导表达的金属硫蛋白无法继续捕获更多的重金属,使得这些重金属直接或间接地干扰DNA的遗传控制和修复机制,同时也可能使机体产生过多的自由基而引起DNA碱基突变,这些DNA损伤的累积将最终导致细胞的死亡。
3.3 不同细胞对重金属的敏感性差异
锌参与DNA聚合酶、RNA聚合酶的合成,参与和维持细胞膜的结构和功能,而浓度过高时影响这两种聚合酶的活性,直接影响膜性结构的脂质双分子层生理稳态,导致细胞功能障碍。同时,高浓度的锌还会影响铁、铜、钙等的吸收和代谢[25-26]。铜是真核生物代谢过程中重要的微量元素,是机体内蛋白质和酶的重要组成,许多关键的酶均需要铜的参与和活化。体内的铜主要依靠超氧化物歧化酶和金属硫蛋白转运,过量的铜对细胞的毒性作用表现在能量代谢降低、氧化损伤及DNA损伤[27]。可见,两种重金属对生物体及细胞的毒性机理不同,细胞对两种重金属的耐受机理也势必会存在差异。本试验结果显示,硫酸铜和氯化锌对泥鳅鳍细胞的毒性效应存在一定差异,泥鳅鳍细胞系对氯化锌的耐受力更强,而对硫酸铜更加敏感。类似的,Park等[28]通过研究敲除金属硫蛋白基因的小鼠发现,金属硫蛋白对一些金属解毒能力的顺序为Cd>Zn>Cu>Ag;谭凤霞等[7]研究了Zn2+、Cd2+、Cu2+和Cr6+4种重金属对稀有鲫鳍细胞系的毒性作用,结果显示,4种重金属对稀有鲫鳍细胞的毒性效应均随传代数的增大而呈下降的趋势,且4种重金属毒性大小为Cr+6>Cd2+>Cu2+>Zn2+;这些报道与本试验结果相似。但Tan等[5]研究了4种重金属对草鱼鳍条细胞系(GCF)、草鱼肾细胞系(CIK)、鲤鱼(Cyprinuscarpio)上皮瘤细胞系(EPC)、斑点叉尾(Ictaluruspunctatus)卵巢细胞系(CCO),褐色大头鲇(Ameiurusnebulosus)肌肉细胞系(BB)和黑头呆鱼(Pimephalespromelas)肌肉细胞系(FHM)6种鱼类细胞系细胞毒性的作用,结果表明,6种细胞系对4种重金属的敏感性大小为Cr>Cd>Zn>Cu。究其原因,可能是与动物种类、细胞种类及不同重金属形态(价态、不同阴离子根等)有关[29-30]。
4 结 论
综合本研究中单细胞凝胶电泳及金属硫蛋白的表达结果,发现铜对泥鳅鳍细胞的毒性效应更大,而锌可以通过诱导金属硫蛋白的转录表达从而短暂减缓对细胞的损伤。

