中国西沙群岛底栖甲藻热带库里亚藻(Coolia tropicalis)的形态学、系统发育及毒性研究
黄丽芬, 李群, 吕颂辉, 张亮, 谢学东
海洋生物学
中国西沙群岛底栖甲藻热带库里亚藻()的形态学、系统发育及毒性研究
黄丽芬1, 李群1, 吕颂辉1, 张亮2, 谢学东2
1. 暨南大学赤潮与海洋生物学研究中心, 广东 广州 510632; 2. 广东省环境监测中心, 广东 广州 510632
库里亚藻()是一类广泛分布且具有生物毒性的海洋底栖甲藻。本研究对近年来在中国南海西沙群岛海域采集分离的4株库里亚藻, 通过光镜及电镜下的形态学观察, 并结合基于核糖体大亚基(large subunit, LSU)rDNA(D1-D3)和内部转录间隔区(internal transcribed spacer, ITS)的序列进行系统发育分析, 鉴定该4个株系为热带库里亚藻()。在卤虫()生物毒性试验中, 热带库里亚藻不同株系毒素提取液对卤虫幼虫表现出了毒性差异, XS554株系的48h半致死浓度(LC50)为1.42mg·mL–1(约相当于1.1×105cells·mL–1), 5XS15株系的LC50为1.92mg·mL–1(约相当于1×105cells·mL–1)。
热带库里亚藻; 形态学; 系统发育; 毒性; 卤虫
海洋底栖甲藻是一类在全球广泛分布的重要的甲藻生态类群, 具有多个潜在的有害物种, 藻细胞产生的有毒化合物通过食物链传递, 最终会对人体及动物的健康产生极大的负面影响。近几十年来, 由于在热带、亚热带地区到温带地区的明显扩张, 海洋底栖甲藻引起了科学界的广泛关注(Berdalet et al, 2017)。
库里亚藻属()属于海洋底栖甲藻, 具有重要的生态意义, 广泛分布在全世界热带至温带的近海海域(Faust, 1995; Rhodes et al, 2000; Aligizaki et al, 2006; Fraga et al, 2008; Armi et al, 2010)。在我国海南三亚海域, 刘宁宁等(1999)首次报道了, 该物种在香港海域也已发现(Leung et al, 2017)。库里亚藻可产生丰富的粘液, 通过粘液附着在多种多样的基质表面生存(Besada et al, 1982), 如沙石、大型藻类、珊瑚及红树林等。
库里亚藻最早是Meunier在比利时尼乌波特的牡蛎床上发现(Meunier, 1919), 并命名为。目前,a属共鉴定出8个种:Meunier (Meunier, 1919)、热带库里亚藻(Faust, 1995)、Ten-Hage, Turquet, Quod et Coute (Ten-Hage et al, 2000)、S. Fraga (Fraga et al, 2008)、Leaw, Lim & Usup (Leaw et al, 2010)、Karafas, Tomas&York、Karafas, Tomas&York (Karafas et al, 2015)和sp. nov.David, Laza-Martínez, Rodríguez (David et al, 2020)。在库里亚藻的物种鉴别中, 相关特征特别是部分甲板的形态被用于种间比较。种间差异主要是第一顶板(1′)和第七沟前板(7′′)的形状、顶孔的长及甲板表面的装饰物等(Faust, 1995; Ten-Hage et al, 2000; Fraga et al, 2008; Leaw et al, 2010; Karafas et al, 2015)。但仅仅以形态上的微小差异鉴别不同物种还存在难度, 使用核糖体大亚基(large subunit, LSU) rDNA(Fraga et al, 2008)、内部转录间隔区(internal transcribed spacer, ITS)包括ITS1和ITS2(Penna et al, 2005)及其二级结构(Leaw et al, 2010)的分子信息方法也已用于支持物种鉴定。
已有报道称库里亚藻部分藻株会产生生物毒素和其他生物活性化合物, 并通过对人类细胞、小鼠、海洋无脊椎动物等进行细胞毒性生物测定及溶血活性测定得到了证实(Rhodes et al, 2010, 2014; Karafas et al, 2015;Leung et al, 2017; De Queiroz Mendes et al, 2019)。Cooliatoxin是一种扇贝毒素(yessotoxins, YTXs)的类似物, 是从热带库里亚藻澳大利亚株系中首次鉴定出的(Holmes et al, 1995)。随后, Wakeman等(2015)从藻株中鉴定出了另外5种扇贝毒素的类似物, 且不同于Holmes等人先前描述的Cooliatoxin。库里亚藻的细胞毒性具有物种特异性(Laza-Martinez et al, 2011; Rhodes et al, 2014; Karafas et al, 2015; Leung et al, 2017), 且热带库里亚藻细胞的生物毒性在不同报道中也存在差异。
目前国际上对库里亚藻的分类学已有许多研究, 但国内的相关研究报道还较少。本文通过结合形态学及系统发育分析, 对采集自中国西沙群岛的4个藻株进行了分类鉴定, 丰富了我国库里亚藻属种类的分类学信息, 并运用卤虫()生物毒性测定法对其细胞毒性的影响展开研究, 以期为有害藻华的防治提供参考。
1 材料与方法
1.1 藻种采集与培养
实验所用库里亚藻株采集自中国西沙群岛(表1、图1), 于死珊瑚及礁岩底质上分离而得, 活体藻株保存于暨南大学赤潮与海洋生物学研究中心藻种库。
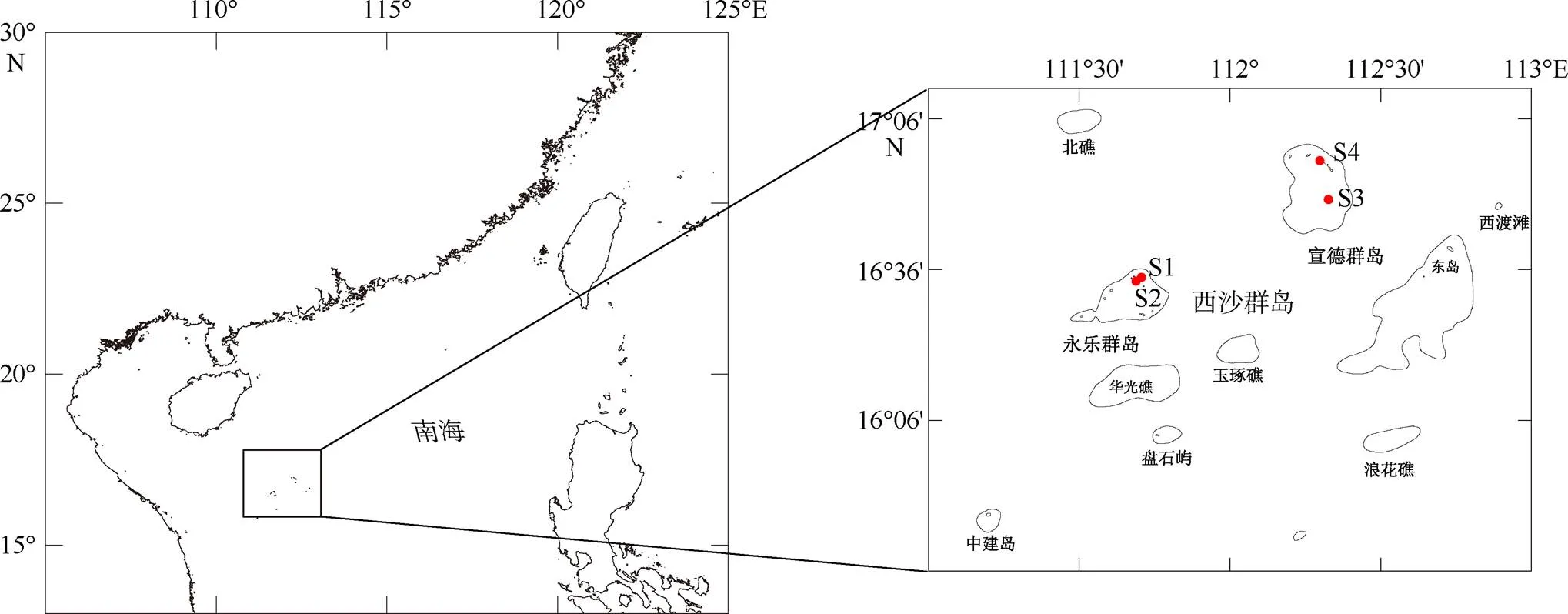
图1 采样位点示意图
地图来源于Surfer软件自带底图
Fig. 1 Map of sampling sites
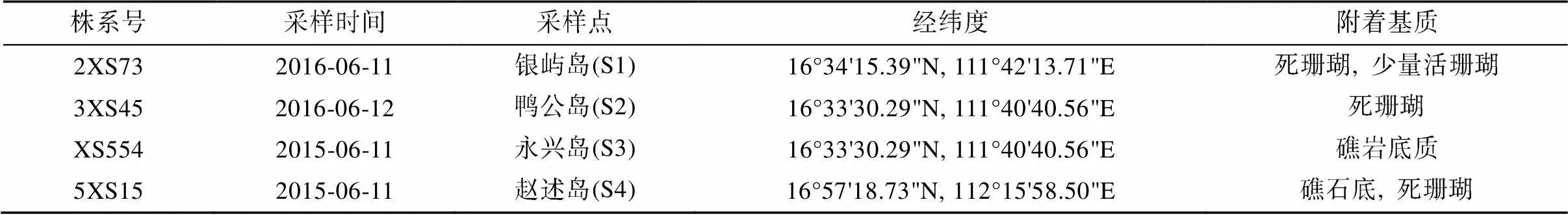
表1 藻株采样信息
藻株使用L1培养基(Guillard et al, 1993)培养, 培养温度为25℃(±0.5℃), 盐度为30‰(±1‰), 光暗周期比为12L︰12D, 光照强度为160~180μmol photons·m–2·s–1。
1.2 形态学观察
本实验结合光学显微镜及扫描电子显微镜的观察对藻株进行形态鉴定。
在光学显微镜Olympus BX41 microscope (Olympus, Tokyo, Japan)下对活细胞进行初步观察, 对关键的分类学特征进行图片采集, 选取30个以上细胞进行测量细胞的长度、宽度等数据。在荧光显微镜下观察细胞色素的形态及分布, 并分别使用SYBR Safe DNA (Thermo Fisher, Waltham, MA, USA)及Calcofluor White (Sigma-Aldrich, Steinheim, Germany)对细胞进行染色, 在360~370nm激发和420~460nm的激发光下分别观察细胞核及初步观察细胞表面甲板的组成, 拍摄图像进行分析。
对于扫描电子显微镜, 取适量细胞并用戊二醛固定(终浓度=2.5%), 置于4℃下过夜。然后将固定的细胞过滤至核孔滤膜上(孔径=8μm, Whatman, Little Chalfont, UK), 用一系列梯度海水冲洗除盐, 随后用蒸馏水冲洗10分钟以除去剩余的盐和固定剂, 再依次用体积分数为10%、20%、30%、40%、50%、60%、70%、80%、90%和100%的乙醇梯度脱水, 使用CO2超临界干燥仪 Leica EM CPD300(Leica Microsystems, Mannheim, Germany)进行临界点干燥, 并在真空溅射仪(Leica EM SCD500, Leica, Wetzlar, Germany)中喷金后在扫描电子显微镜(Carl Zeiss Inc., Oberkochen, Germany)下观察细胞表面细微结构并拍照。
1.3 DNA提取、PCR扩增及测序
取足量的藻液离心收集成藻团, 并用蒸馏水冲洗三次以除盐后储存于80℃下30min。按照试剂盒MiniBEST Universal DNA Extraction Kit(TaKaRa Bio, Inc., Kusatsu, Shiga, Japan)中的方法提取DNA。大亚基(LSU)rDNA(D1—D3)使用引物D1R-F(5′-ACCC GCTGAATTTAAGCATA-3′) (Scholin et al, 1994)和D3B-R(5′-TCGGAGGGAACCAGCTACTA-3′) (Nunn et al, 1996)进行扩增及测序, 内部转录间隔区(ITS)使用通用引物ITS1F(5′-ACCCGCTGAATTTAAGC ATA-3′)和ITS1R(5′-ATATGCTTAAGCTCAGCGGG- 3′) (Pin et al, 2001)进行扩增及测序。PCR扩增在50μL体系中进行, 反应物包含: 25μL TaqPCR MasterMix (Zoman Biotechnology, Beijing, China), 22μL灭菌水, 1μL正向引物, 1μL反向引物和1μL基因组DNA。 PCR反应中先预变性4min, 而后进行30个循环, 每一循环包括94℃的变性1min, 45℃退火1min和72℃延伸1min, 最后延伸步骤为72℃, 7min。PCR产物交由专门的生物技术公司进行纯化及测序。
1.4 系统发育分析
将测序获得的LSU和ITS序列与从GenBank数据库中获得的参考序列使用MUSCLE(Edgar, 2004)进行多重比对。采用CIPRES中的RAxML- HPC2 v.8中的最大似然法(maximum likelihood, ML)进行系统发育分析, 运行1000次自举检验。此外, 运行MrBayes v3.2.6(Ronquist et al, 2012)进行贝叶斯推断(Bayesian inference, BI)分析, 其经PAPU v. 4.0构建的最佳拟合模型是GTR+G。使用MEGA 7.0软件查看系统发育树。用MEGA 7.0计算不同序列间遗传距离。
1.5 毒性分析
实验选用2株热带库里亚藻(XS554、5XS15)藻株及1株(HSJ19)藻株, 将无毒的分离株HSJ19作为阴性(无毒)对照。
1.5.1 毒素粗提液制备
取处于稳定期前期的细胞培养物, 离心收集后将藻团冷冻干燥。藻团中加入纯甲醇, 在冰浴条件下用超声波细胞破碎仪破碎10min, 镜检确保无完整藻细胞后离心收集上清液, 再通入纯N2将其干燥。干燥后溶解于含1%Tween-60的磷酸盐缓冲液中(Rhodes et al, 2014), 制备的毒素粗提液的浓度为10mg·mL–1(干重浓度), 于4℃保存待用。
1.5.2 卤虫生物毒性实验
将卤虫(JBL Novotemia, 德国)的干燥孢囊在25℃下加入过滤后的人工海水中孵化。孵化24h后随机挑取生长状态一致的卤虫幼虫置于12孔板中, 每孔20只。卤虫幼虫暴露于2mL试验溶液中, 无毒对照组及实验组毒素粗提液预设浓度为5、2.5、1、0.75和0.5mg·mL–1, 由含1%Tween-60的磷酸盐缓冲液作为溶剂对照组的对应浓度为0.5%、0.25%、0.1%、0.075%、0.05% Tween-60, 加入过滤后的人工海水作为空白对照组。72h暴露实验于25℃(±0.5℃)、光暗周期比为12L︰12D培养箱中进行, 每组实验设置三组平行。于设定时间点计数每个孔中死亡的卤虫幼虫的数量, 计算死亡率, 并通过死亡率确定半致死浓度(LC50)。
1.6 统计分析
数据统计分析采用SPSS19.0软件进行, 差异性分析利用单因素方差分析(One-way ANOVA),<0.05为差异显著,<0.01为差异极显著。使用Origin9.4进行图表绘制。
2 结果
2.1 形态学
热带库里亚藻细胞如腹面观及底面观所示呈球形(图2b、d; 图3e、f; 图4a、b)。在侧面观中, 上壳与下壳略微倾斜, 且上壳比下壳稍小(图3a)。细胞中有许多金黄色的色素体(图2a), 在荧光下观察到在细胞中的排列如图2b所示。细胞核靠近细胞的背面, 呈U形(图2c), 细胞核长度大约为19.6~ 28.2µm(平均值为23.7µm,= 39), 宽为4.3~8.4µm (平均值为6.3µm,= 39)。荧光下能够初步观察到细胞表面的甲板组成(图2d)。热带库里亚藻细胞长为28.5~44.2µm(平均值为37.0µm,=34), 宽为25.5~ 43.3µm(平均值为32.3µm,=34), 背腹侧的高为22.6~47.9µm(平均值为33.2µm,=28)。壳表面光滑, 由形状不规则的、界限分明的、大小不一的甲板组成。所有的甲板表面都覆盖有许多分散的圆孔, 孔的平均直径为0.29µm(=70)。甲板排列式为(Po, 3′, 7′′, 6c, ?s, 5′′′, 2′′′′)。
热带库里亚藻细胞的上壳由11块甲板组成: 一块顶孔板(Po), 三块顶板(3′)和7块沟前板(7′′)。顶孔(Po)位于第二顶板上且偏离整个上壳的中心, 包含一条细缝和一些小孔, 从顶面看呈现出略弯曲形, 顶孔长为4.3~9.6µm(平均值为7.4µm,=40, 基于电镜图测量)(图3b)。顶孔板与第一顶板(1′)、第三顶板(3′)、第二沟前板(2′′)、第三沟前板(3′′)、第四沟前板(4′′)相连(图3c; 图4a)。第一顶板(1′)是上壳中面积最大的甲板, 呈细长的六边形状, 延伸到背腹侧, 与第二顶板(2′)/ 顶孔板(Po)、第三顶板(3′)、第一沟前板(1′′)、第二沟前板(2′′)、第六沟前板(6′′)、第七沟前板(7′′)相连(图3d; 图4a)。第三沟前板(3′′)、第四沟前板(4′′)、第五沟前板(5′′)在大小上几乎相等, 第六沟前板(6′′)是沟前板中面积最大的甲板(图3c; 图4a)。第七沟前板(7′′)宽且短, 其宽与长的比值为3.8(=6)。横沟围绕细胞一圈, 沟内有两排间隔相等的小孔。纵沟较深, 但没有延伸到细胞的背面。
下壳由7块甲板组成: 5块沟后板(5′′′)和2块底板(2′′′′)。第三沟后板(3′′′)比第四沟后板(4′′′)稍大(图3e), 第二沟后板(2′′′)和第五沟后板(5′′′)的面积都较小(图3f)。第一沟后板(1′′′)是面积最小的, 且在底面观中较难辨别(图3e、f)。第一底板(1'''')非常小, 第二底板(2′′′′)的形状为六边形(图3f、图4b)。
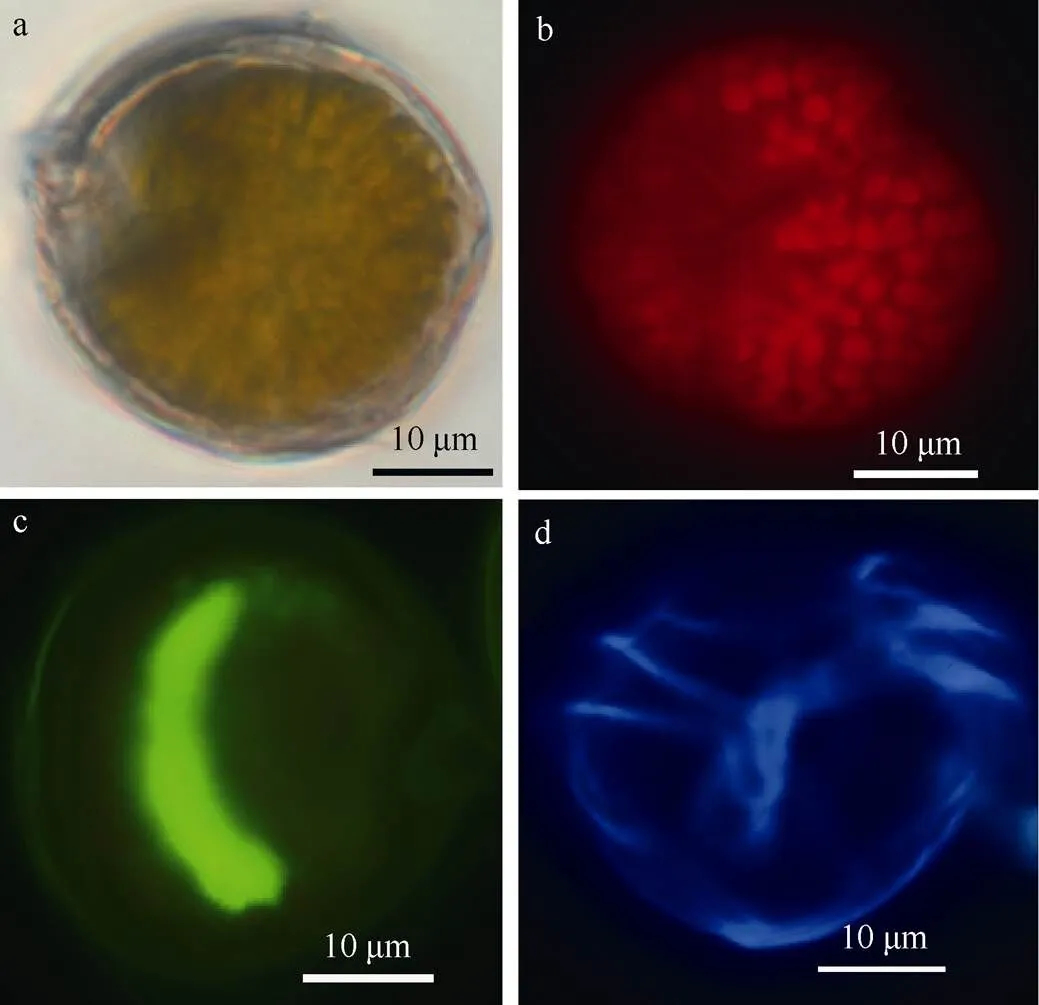
图2 热带库里亚藻的光镜图
a. 细胞呈圆球形; b. 色素体在细胞内的分布; c. 细胞核呈U形; d. 细胞腹面观, 显示了横沟和纵沟
Fig. 2 Light microscope (LM) images of. a) Cells showing spherical-shaped; b) the arrangement of chloroplasts; c) the U-shaped nucleus; d) ventral view showing cingulum and sulcus
2.2 分子系统发育分析
实验所用热带库里亚藻最初经由对活细胞的形态学观察来鉴定, 通过分子系统发育分析进一步确认。本研究获得了4株热带库里亚藻部分大亚基(LSU) rDNA(D1-D3)和内部转录间隔区(ITS)的序列。LSU rDNA和ITS的系统发育分析都以作为外类群。最大似然法(ML)与贝叶斯推断法(BI)构建的系统发育树产生了相同的拓扑结构, 因此, 本文仅展示了ML构建的系统发育树(图5、6)。分支节点处的数值表示对该分支的统计支持值, 分别为最大似然法自举检验值(100)和贝叶斯推断后验概率值(1)。
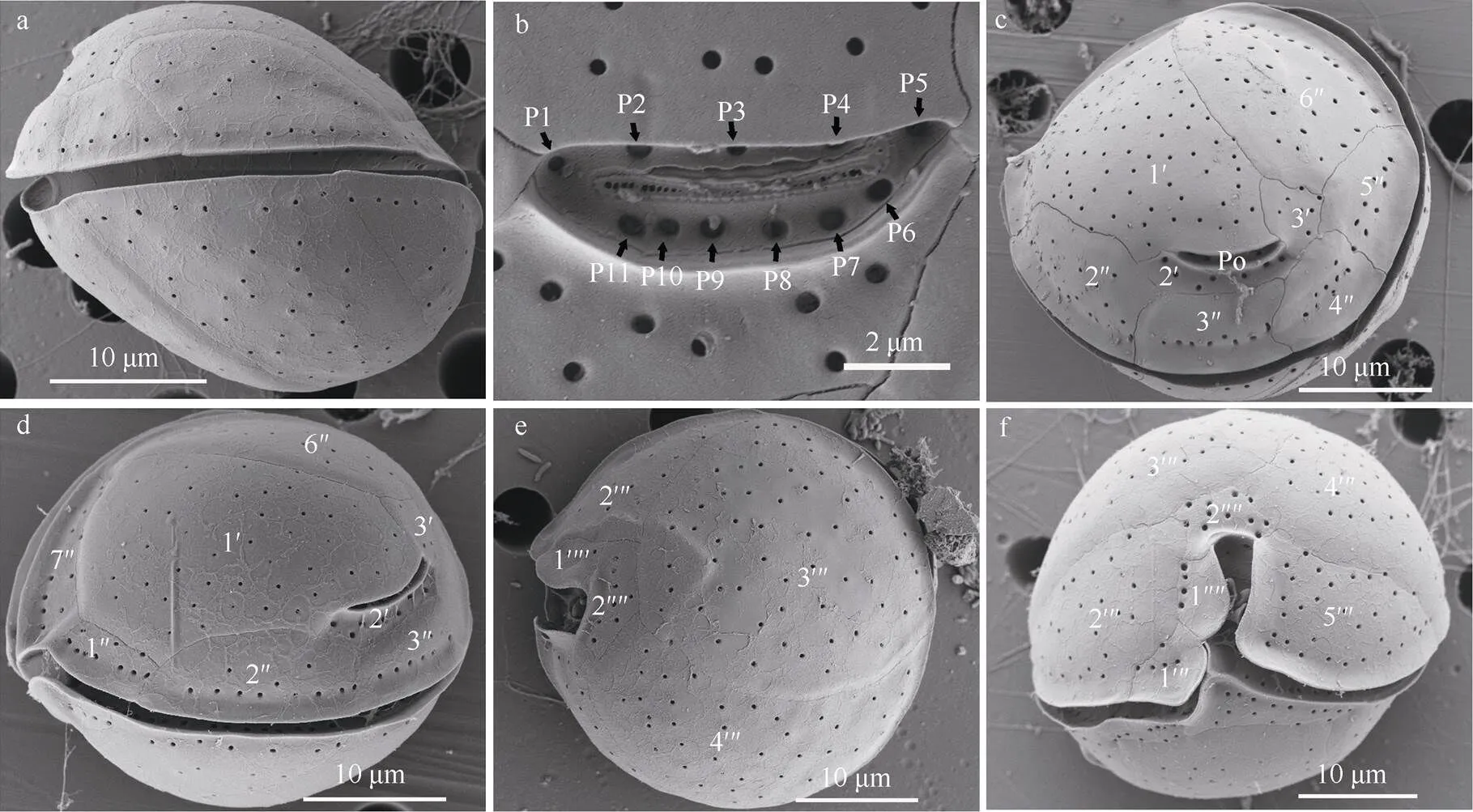
图3 热带库里亚藻的扫描电镜图
a. 侧面观; b. 顶孔复合体; c. 顶面观; d. 顶面观; e. 底面观; f. 腹面观
Fig. 3 Scanning electron microscope (SEM) images of. a) Lateral view; b) close-up of APC; c) apical view of the epitheca; d) apical view of the epitheca; e) antapical view of the hypotheca; f) ventral view
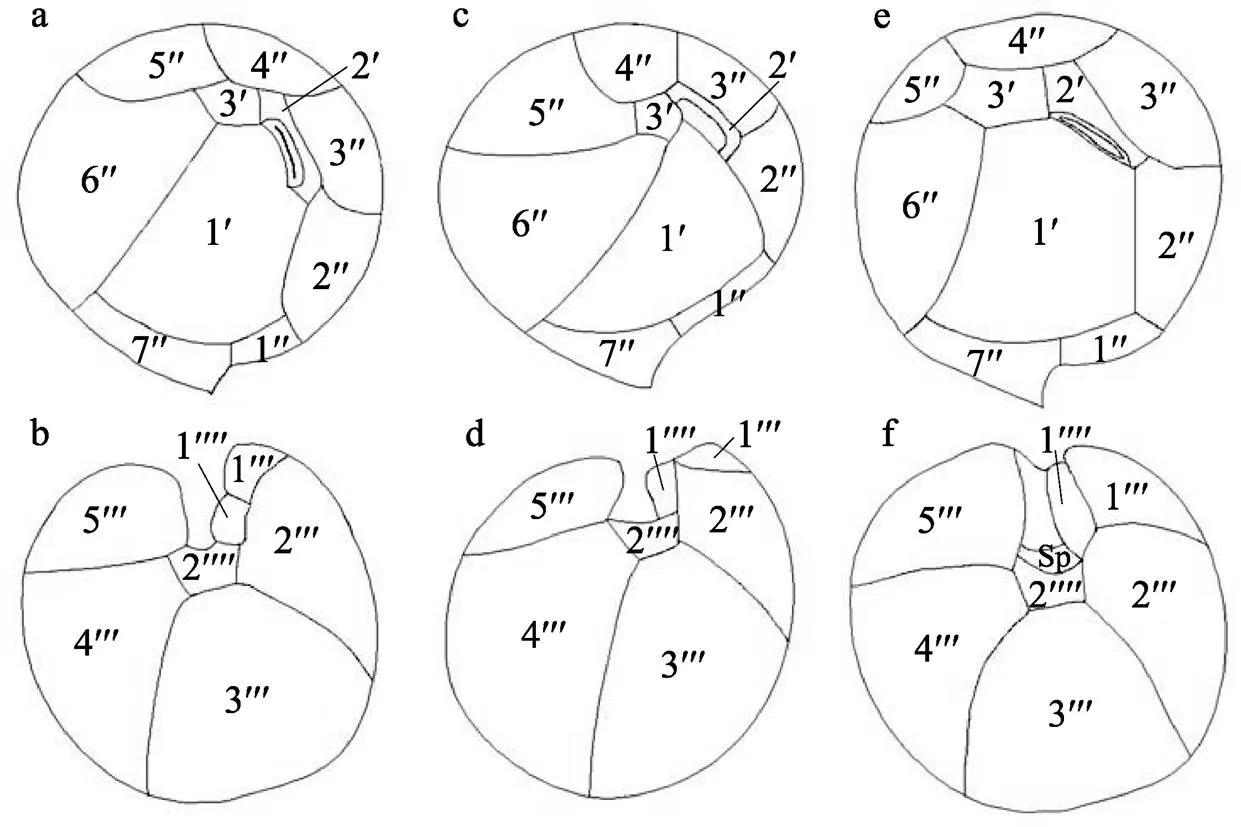
图4 热带库里亚藻的壳板图
a、b, 本研究; c、d, 重绘自Faust(1995); e、f, 重绘自Mohammad-Noor等(2013)。a、c、e为上壳板顶面观; b、d、f为下壳板底面观
Fig. 4 Thecal plate tabulation ofbased on original descriptions. (a, b) This study; (c, d) redrawn from Faust(1995); (e, f) redrawn from Mohammad-Noor et al (2013); (a, c, e) apical view of the epitheca; (b, d, f) antapical view of the hypotheca
对基于LSU rDNA序列的系统发育分析, 研究获得了4株热带库里亚藻部分大亚基(LSU) rDNA(D1-D3)序列, 结合从Genbank上获得的库里亚藻属的39个已发表序列及2个外类群, 共45个序列进行比对分析。基于LSU (D1-D3) rDNA基因的系统发育树显示所有序列形成了7个清晰且支持值良好的分支:和(图5)。本研究中4个西沙群岛热带库里亚藻株系与同种类来自世界各地的其他热带库里亚藻株系聚类在一起形成单一进化枝, 支持率高达99/1。本研究中的4个株系序列存在较小差异, 分别聚类在3个不同的子分支中, 热带库里亚藻株系间遗传距离最大为0.042(5XS15/2XS73)。其中, XS554与3XS45两条序列的碱基组成无差异, 与澳大利亚株(HQ897276、MH319016、MH319017)、泰国株(AB908159)和印度尼西亚株(AM902740)聚集在同一子分支中, 支持率为99/0.73; 5XS15与XS554、3XS45的序列间存在10个碱基差异, 与中国香港株系(KX589144、KX589145)聚集在同一子分支中, 拥有较高的支持率(99/1); 2XS73与马来西亚株(JX896691)和澳大利亚株(MH319018)聚集在同一子分支中, 支持率为73/1。另外, 2XS73与XS554、3XS45的序列差异为31个碱基, 与5XS11、5XS15的序列差异为38个碱基。热带库里亚藻分支中显示了一定程度的种内差异, 平均遗传距离为0.02。基于LSU rDNA序列的库里亚藻种间平均遗传距离为0.086 (×e)至0.450 (×) (表2)。
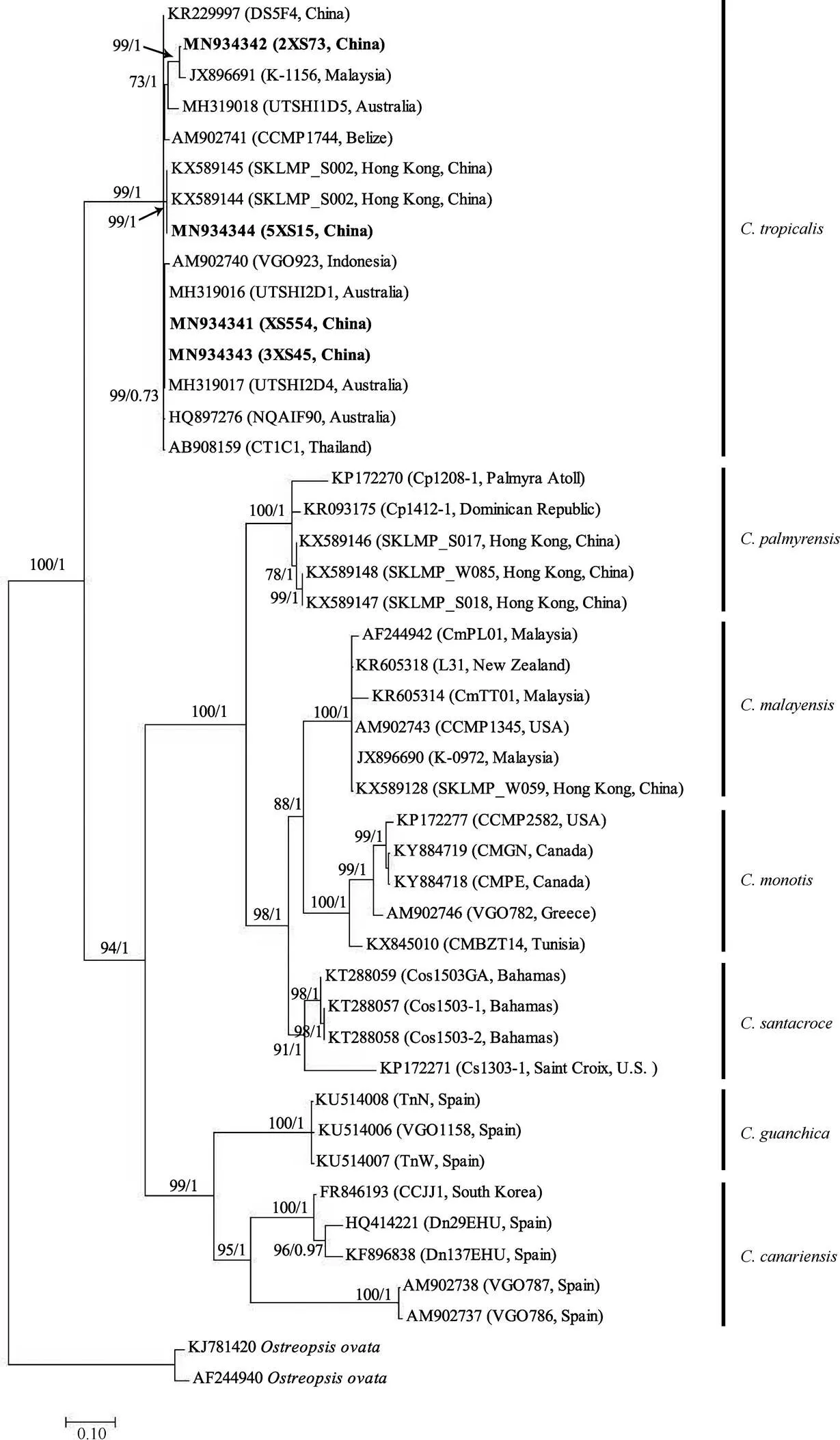
图5 基于核糖体大亚基(LSU)D1-D3区序列的系统发育树
以作为外类群, 分支节点处的数值表示对该分支的统计支持值, 分别为最大似然法自举检验值(100)和贝叶斯推断后验概率值(1)
Fig. 5 Molecular phylogenetic tree based on the D1-D3 region of LSU rDNA withas outgroups. The numbers at nodes indicate the maximum likelihood booststrap (BS) values (100) and Bayesian Inference posterior probability (PP) values (1), representing the levels of support

表2 库里亚藻不同物种间基于LSU rDNA序列的遗传距离
对基于ITS区段序列的系统发育分析, 结合从Genbank上获得的属的23个已发表序列及2个外类群, 共29个序列进行比对分析。由于GenBank中只有少数序列可供比对使用, 基于ITS区序列构建的系统发育树总体上支持LSU的结果, 但系统发育树的综合性不够全面, 有待进一步完善 (图6)。本研究中4个西沙群岛热带库里亚藻株系与其余来自世界各地的热带库里亚藻株系聚类在一起形成单一进化枝, 支持率为99/1。本研究中的4个序列间存在差异, 在系统发育树中可以看到2XS73株更早的与热带库里亚藻的其他株系分离开, 形成单一子分支, 支持率为99/1; 而其余三个株系进入另一分支中。其中XS554与3XS45两条序列的碱基组成无差异, 与西班牙株(KR605300、KR605299)和中国株(MF805767)聚集在同一子分支中, 支持率为60/1; 5XS15与XS554、3XS45株系存在9个碱基差异, 也与该分支中其余株系分离开, 形成单一子分支, 支持率为92/1; 另外, 2XS73与XS554、3XS45的序列差异为36个碱基, 与5XS15的序列差异为40个碱基。热带库里亚藻分支中也显示了一定程度的种内差异, 平均遗传距离为0.019, 其中西沙群岛株系间的最大遗传距离为0.097(5XS15/2XS73)。基于ITS rDNA序列的库里亚藻种间平均遗传距离为0.128(×)至0.798(×)(表3)。
2.3 毒性分析
西沙群岛热带库里亚藻株系XS554、5XS15毒素粗提物对卤虫()的毒性影响结果如图7所示。无毒对照组HSJ19的卤虫游动正常, 与海水对照组无明显差别; 与对照组相比, 两个株系对卤虫均出现了明显的生物毒性作用, 前期表现为游动迟缓或不动, 随着暴露时间的延长而致死。在暴露12h时, 高浓度组(5mg·mL–1)出现了明显的致死效应, XS554株系组死亡率高达73.33%, 而5XS15株系组死亡率为18.33%; 24h时观察到两个株系的高浓度组(5mg·mL–1)中卤虫的死亡率接近100%。XS554株系的2.5mg·mL–1浓度组的卤虫死亡率在12h至48h间有明显增加, 48h时卤虫死亡率接近100%; 而在此浓度下, 5XS15株系组卤虫在暴露24h后致死率才有明显的增加, 直至72h时死亡率达到100%。卤虫暴露在粗提液中72h后, 其余三个低浓度组的致死率仍较低, 大致为20%, 但几乎所有的卤虫与对照组相比都有异常表现, 如游动迟缓或不动。实验结果表明, 在相同时间内, 藻株毒素粗提液对卤虫的毒性效应随着浓度升高而增强; 而在一定的浓度下, 对卤虫的毒性作用随着暴露时间的延长而增加。在卤虫暴露在毒素粗提物中48h时, XS554株系的LC50为1.42mg·mL–1(相当于大约1.1×105cells·mL–1), 5XS15株系的LC50为1.92mg·mL–1(相当于大约1×105cells·mL–1), 两者间存在显著性差异(<0.05)。实验结果表明, 热带库里亚藻同一种内的不同株系间提取物的致死效力存在差异。
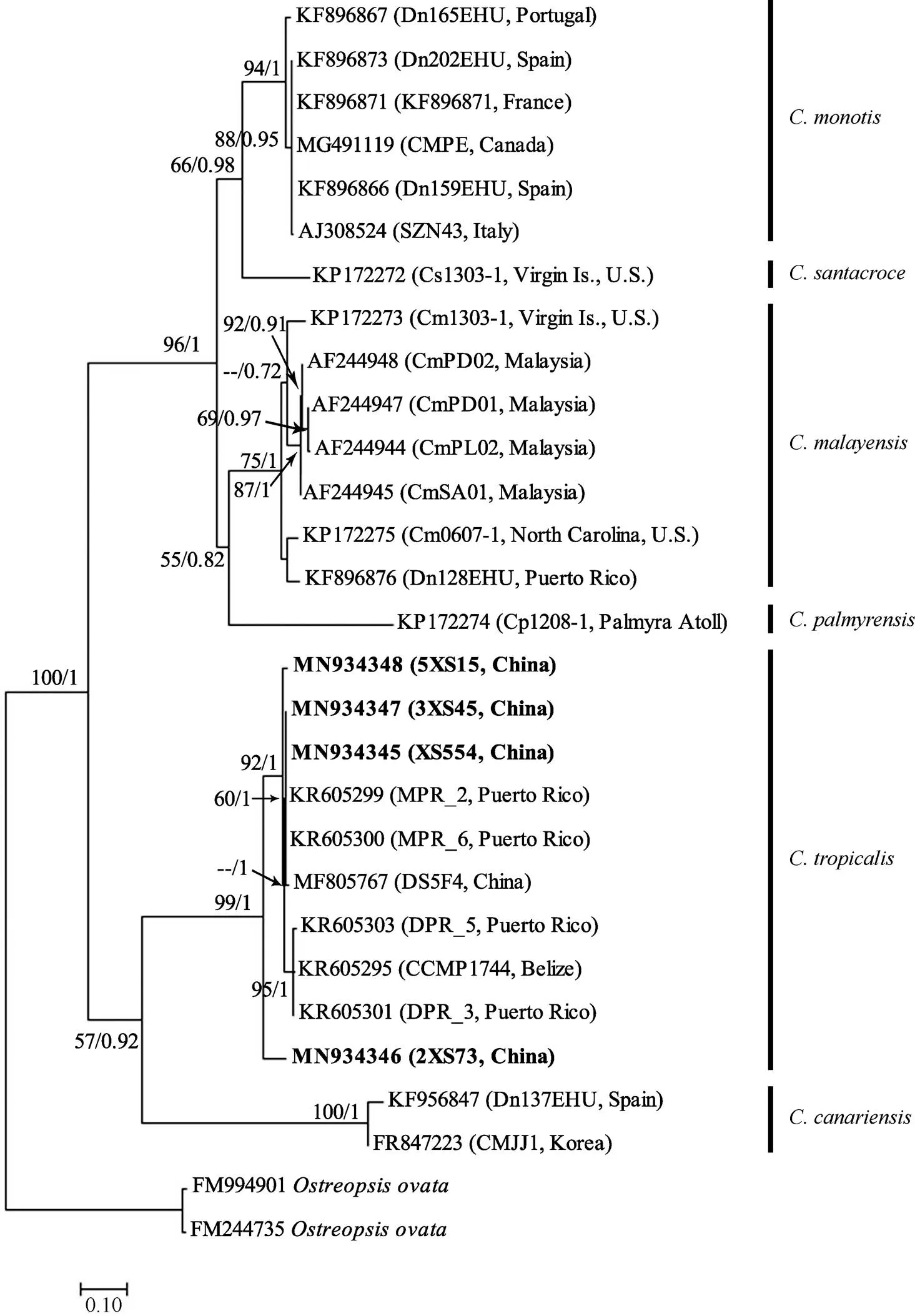
图6 基于核糖体转录间隔区ITS序列的系统发育树核糖体
以作为外类群, 分支节点处的数值表示对该分支的统计支持值, 分别为最大似然法自举检验值(100)和贝叶斯推断后验概率值(1)
Fig. 6 Molecular phylogenetic tree based on the ITS region withas outgroups. The numbers at nodes indicate the maximum likelihood booststrap (BS) values (100) and Bayesian Inference posterior probability (PP) values (1), representing the levels of support
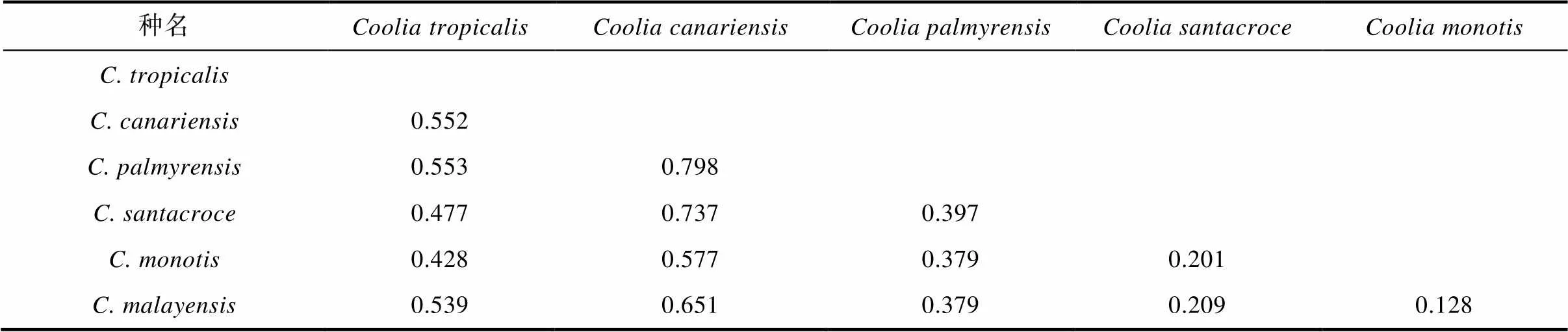
表3 库里亚藻不同物种间基于ITS区序列的遗传距离
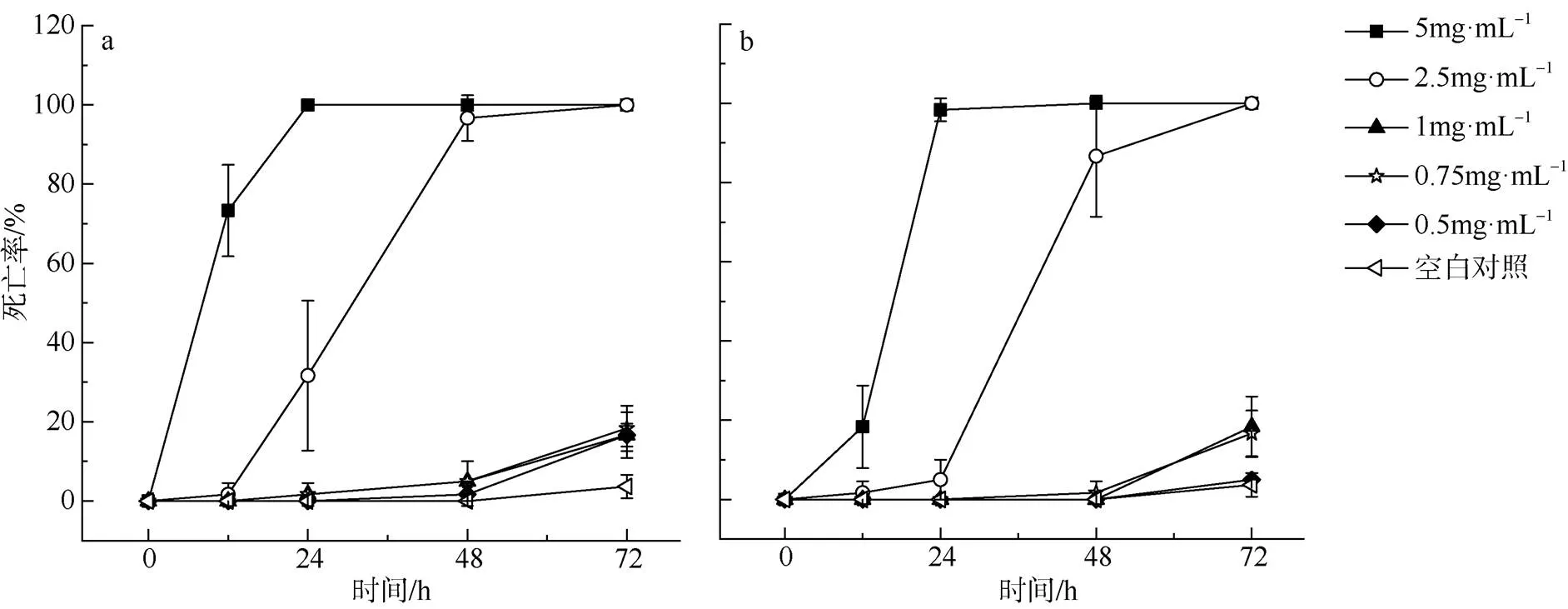
图7 热带库里亚藻不同浓度毒素粗提物在72h内对卤虫的致死率
a. 藻株XS554; b. 藻株5XS15
Fig. 7 The death rate ofexposed to crude toxin extract ofwithin 72 h. a) XS554; b) 5XS15
3 讨论与分析
3.1 热带库里亚藻的形态学比较
本研究中的西沙群岛株系间虽然在分子序列上存在微小差异, 但其形态特征上无明显差异。基于形态的库里亚藻属物种之间的区别一直存在争议(Mohammad-Noor et al, 2013; Leaw et al, 2016)。然而, 已经明确的是, 不同种间第一顶板(1′)及第七沟前板(7′′)的大小和形状与分子数据基本一致, 并广泛被用于鉴定该种类, 特别是第七沟前板(7′′)的宽长比(Fraga et al, 2008)。
Faust(1995)首次对热带库里亚藻进行了形态上的描述。本研究所用的西沙群岛藻株的形态与其原始描述虽存在部分细微差异, 但基本一致, 而也更符合随后更多研究中的描述(Mohammad-Noor et al, 2013; Momigliano et al, 2013; Ho et al, 2014; Nascimento et al, 2019; De Queiroz Mendes et al, 2019)。
西沙群岛热带库里亚藻株系的细胞大小比原始描述中的伯利兹株略大(Faust, 1995), 而已报道的马来西亚株细胞则更大(Mohammad-Noor et al, 2013)。然而, Jeong等(2012)观察到活细胞的大小明显大于扫描电子显微镜(scanning electron microscope, SEM)下拍摄后测量的细胞大小, 因此认为经过扫描电镜的一系列前处理会使得细胞明显缩小。在本研究中也观察到了同样的现象。因此, 在比较库里亚藻种类的细胞大小时, 应该考虑SEM下可能存在的细胞明显收缩的情况。伯利兹株细胞通过扫描电镜拍摄后测量的长为23~40µm, 宽为25~39µm; 马来西亚株细胞的长为35~47µm(平均值: 40±4.7µm), 宽为30~45µm(平均值: 37±5.2µm); 而本研究中西沙群岛株细胞长为28.5~44.2µm(平均值: 37.0µm), 宽为25.5~43.3µm(平均值: 32.3µm)。顶孔的长平均为7.4µm, 与伯利兹株(7µm)、澳大利亚株(6.5~8µm)和巴西株(7.0±0.9µm)无太大差异(Faust, 1995; Momigliano et al, 2013; Nascimento et al, 2019); 与越南株(7~9µm)及马来西亚株(7.2~12µm)相比明显更短(Mohammad-Noor et al, 2013; Ho et al, 2014); 比巴西株(4.9µm)差异明显(De Queiroz Mendes et al, 2019)。
西沙群岛株与1995年原始描述的主要差异是在部分甲板的形状及大小(图4)。原始描述中的第一顶板(1′)被描述为楔形, 并且在Momigliano (2013)中被描述为五边形, 而在本研究中的西沙株是细长、六边形的, 与其他先前的描述类似(Mohammad-Noor et al, 2013; Ho et al, 2014)。但Mohammad-Noor (2013)通过仔细观察原始描述(Faust, 1995)中的扫描显微图片, 发现其中第一顶板(1′)的形状是被错误描述的。第七沟前板(7′′)的宽长比是用以鉴定库里亚藻种类的最重要特征之一, 已有报道表明热带库里亚藻的宽长比大约为4(Fraga et al, 2008; Laza-Martinez et al, 2011), 本研究中其比值为3.8, 符合前人的描述。另外, 在第二顶板(2′)、第三顶板(3′)以及第二底板(2′′′′)也发现了差异。在本研究中, 第二顶板(2′)为六边形, 第三顶板(3')为五边形; 在Faust(1995)的描述中, 第二顶板(2′)为四边形, 第三顶板(3′)被五块甲板围绕, 尽管它被描述为四边形。第二底板(2′′′′)在Faust (1995) 的描述中是四边形的, 而在Ho等(2014) 的描述中为五边形或六边形, 在本研究观察中为六边形。此外, 底板3′′′′和4′′′′在原始描述中大小相等, 而在本研究中, 甲板3′′′′略大于甲板4′′′′。
3.2 分子系统发育
基于LSU (D1-D3) rDNA和ITS rDNA的序列, 运用ML及BI建成的系统发育树产生了与近年报道中一致的主要进化枝(Rhodes et al, 2014; Leaw et al, 2016; Leung et al, 2017; Lewis et al, 2018; David et al, 2020), 分别为、、、、和。由于的rDNA基因数据至今未能获得, 在种间系统发育地位也无法确定。本研究中热带库里亚藻形成了一个具有高支持率的单系起源分支, 基于LSU rDNA和ITS rDNA序列分析结果显示西沙群岛的四个株系被确认为热带库里亚藻。对比基于LSU rDNA序列及ITS rDNA序列的系统发育分析结果发现, 在两个系统发育树中藻株间的亲缘远近关系是一致的, 表现为2XS73株系与其余3个株系的亲缘关系较为疏远。而由于GenBank中只有少数ITS区序列可供比对使用, 基于ITS区序列构建的系统发育树总体的可信度不及基于LSU rDNA序列构建的系统发育树。由于地理上的邻近性, 推测西沙群岛株系与中国香港株系及海南株系发育关系最密切。然而, 对LSU序列数据的分析表明, 西沙群岛4个株系均与海南株关系较为疏远, 仅5XS11、5XS15两个株系与中国香港株系关系最亲密。而由于西沙群岛株系间已存在较大的碱基差异, 其进化位置与地理区域间的关系也较为模糊。
在已有报道中发现库里亚藻不同种间的分子进化差异稍有不同(Leaw et al, 2010; Momigliano et al, 2013; Karafas et al, 2015; de Queiroz Mendes et al, 2019; Nascimento et al, 2019; David et al, 2020)。David等(2020)发现, 库里亚藻种间的最小平均遗传距离(基于LSU rDNA序列)是在和之间, 该结果与David等(2014)的研究结果一致, 而在本研究所参考的序列基础下, 发现基于LSU rDNA的种间遗传距离在和之间差异较小。基于ITS rDNA的种间遗传距离在和之间较小, 这与David等(2020)以及Karafas等(2015)的结果一致。
3.3 C. tropicalis毒性及差异
自从Holmes等(1995)学者首次报道Cooliatoxin以来, 通过对卤虫、鲍鱼幼体、海胆、鱼及小鼠等进行生物毒性测定, 研究表明库里亚藻属的毒性具有物种特异性, 且至今测定出仅热带库里亚藻、、及具生物毒性(Rhodes et al, 1997, 2000, 2010, 2014; Penna et al, 2005; Fraga et al, 2008; Paz et al, 2008; Mohammad-Noor et al, 2013; Leung et al, 2017)。Karafas 等(2015)验证了及对人体细胞的毒性作用, 尽管这不是一种生物测定法, 但在人体细胞上进行试验可以了解其毒素对人体组织的影响。
本研究通过观察藻细胞毒素粗提液对卤虫幼虫的致死率测定热带库里亚藻的毒性, 结果显示西沙群岛热带库里亚藻的两个株系均有明显的生物毒性, 暴露于毒素粗提液后卤虫均出现了游动异常或死亡现象, 分析得出在48h时XS554的LC50为1.42mg·mL–1(细胞密度约为1.1×105cells·mL–1), 但5XS15的LC50为1.92mg·mL–1(细胞密度约为1×105cells·mL–1), 两者间存在显著差异。然而, Leung等(2017)的研究结果显示, 卤虫暴露在含热带库里亚藻藻细胞毒素粗提液的试验溶液中并未出现明显的致死现象, 推测可能是由于其设置最高试验浓度较低, 仅为0.5mg·mL–1; 而的S020株系在48h时的 LC50 为0.086mg·mL–1(细胞密度约为3×105cells·mL–1), Ve051株系为0.117mg·mL–1(细胞密度约为1×105cells·mL–1)。若LC50使用细胞密度数值相比较, 则西沙群岛热带库里亚藻株系与中国香港株系对卤虫的致死率是相当的, 此结论与Leung等(2017)的结论不一致。故在随后的研究中, 应尽量减少因毒素粗提液浓度单位的设置对毒性结果的影响。随着研究的深入, 发现本研究中西沙群岛热带库里亚藻株系虽在形态上无明显差异, 但其不同株系间的生物毒性却存在较大差异, 类似情况也已有报道(Rhodes et al, 2014; Leung et al, 2017)。本研究中未提供西沙群岛藻株的相关特定毒素的信息, 但是其很可能类似于从热带库里亚藻澳大利亚株系鉴定出的Cooliatoxin(Holmes et al, 1995), 或从藻株中鉴定出的5种扇贝毒素的类似物(Wakeman et al, 2015)。
4 结论
基于形态学特征及系统发育分析, 鉴定本研究中4株库里亚藻为热带库里亚藻。不同藻株间形态特征上无明显差异, 但其分子序列信息却存在不同程度的差异。西沙群岛热带库里亚藻的两个株系均具有明显的生物毒性, 卤虫表现为游动异常或死亡。
刘宁宁, 林永水, 1999. 有毒甲藻Meunier的研究I. 甲板形态[J]. 热带海洋, 18(2): 1–4. LIU NINGNING, LIN YONGSHUI, 1999. Studies on toxic dinoflagellate,Meunier I. Thecal Morphology[J]. Tropic Oceanology, 18(2): 1–4 (in Chinese with English abstract).
Aligizaki K, Nikolaidis G, 2006. The presence of the potentially toxic generaand(Dinophyceae) in the North Aegean Sea, Greece[J]. Harmful Algae, 5(6): 717–730.
Armi Z, Turki S, Trabelsi E, et al, 2010. First recorded proliferation of(Meunier, 1919) in the North Lake of Tunis (Tunisia) correlation with environmental factors[J]. Environmental Monitoring and Assessment, 164(1–4): 423–433.
Berdalet E, Tester P A, Chinain M, et al, 2017. Harmful algal blooms in benthic systems: recent progress and future research[J]. Oceanography, 30(1): 36–45.
Besada E G, Loeblich L A, Loeblich III A R, 1982. Observations on tropical, benthic dinoflagellates from ciguatera-endemic areas:,, and[J]. Bulletin of Marine Science, 32(3): 723–735.
David H, Laza-Martínez A, Miguel I, et al, 2014. Broad distribution ofand restricted distribution ofcf.(Dinophyceae) on the Atlantic coast of the Iberian Peninsula[J]. Phycologia, 53(4): 342–352.
David H, Laza-Martínez A, Rodríguez F, et al, 2020.sp. nov. (Dinophyceae) a new epibenthic dinoflagellate from the Canary Islands (NE Atlantic Ocean)[J]. European Journal of Phycology, 55(1): 76–88.
de Queiroz Mendes M C, de Castro Nunes J M, Fraga S, et al, 2019. Morphology, molecular phylogeny and toxinology ofandstrains isolated from the tropical South Western Atlantic Ocean[J]. Botanica Marina, 62(2): 125–140.
Edgar R C, 2004. MUSCLE: multiple sequence alignment with high accuracy and high throughput[J]. Nucleic Acids Research, 32(5): 1792–1797.
Faust M A, 1995. Observation of sand-dwelling toxic dinoflagellates (Dinophyceae) from widely differing sites, including two new species[J]. Journal of Phycology, 31(6): 996–1003.
Fraga S, Penna A, Bianconi I, et al, 2008.sp. nov. (Dinophyceae), a new nontoxic epiphytic benthic dinoflagellate from the Canary Islands[J]. Journal of Phycology, 44(4): 1060–1070.
Guillard R R L, Hargraves P E, 1993. Stichochrysis immobilis is a diatom, not a chrysophyte[J]. Phycologia, 32(3): 234–236.
Ho T V, Nguyen L N, 2014. Morphology and distribution of the three epiphytic dinoflagellate species,, and(Ostreopsidaceae, Gonyaulacales, Dinophyceae) from Vietnamese coastal waters[J]. Ocean Science Journal, 49(3): 211–221.
Holmes M J, Lewis R J, Jones A, et al, 1995. Cooliatoxin, the first toxin from(dinophyceae)[J]. Natural Toxins, 3(5): 355–362.
Jeong H J, Yih W, Kang N S, et al, 2012. First report of the epiphytic benthic dinoflagellatesandin the waters off Jeju Island, Korea: Morphology and rDNA sequences[J]. Journal of Eukaryotic Microbiology, 59(2): 114–133.
Karafas S, York R, Tomas C, 2015. Morphological and genetic analysis of thespecies complex with the introduction of two new species,sp. nov. andsp. nov. (Dinophyceae)[J]. Harmful Algae, 46: 18–33.
Laza-MartInez A, Orive E, Miguel I, 2011. Morphological and genetic characterization of benthic dinoflagellates of the genera,andfrom the south-eastern Bay of Biscay[J]. European Journal of Phycology, 46(1): 15–65.
Leaw C P, Lim P T, Cheng K W, et al, 2010. Morphology and molecular characterization of a new species of thecate benthic dinoflagellate,sp. nov. (Dinophyceae)[J]. Journal of Phycology, 46(1): 162–171.
Leaw C P, Tan T H, Lim H C, et al,2016. New scenario for speciation in the benthic dinoflagellate genus(Dinophyceae)[J]. Harmful Algae, 55: 137–149.
Leung P T Y, Yan M, Yiu S K F, et al, 2017. Molecular phylogeny and toxicity of harmful benthic dinoflagellates(Ostreopsidaceae, Dinophyceae) in a sub-tropical marine ecosystem: the first record from Hong Kong[J]. Marine Pollution Bulletin, 124(2): 878–889.
Lewis N I, Wolny J L, Achenbach J C, et al, 2018. Identification, growth and toxicity assessment ofMeunier (Dinophyceae) from Nova Scotia, Canada[J]. Harmful Algae, 75: 45–56.
Meunier A, 1919. Microplancton de la Mer Flamande. 3. Les Péridiniens[J]. Mémoires du Musée Royal d’Histoire Naturelle de Belgique, 8: 1–116.
Mohammad-Noor N, Moestrup O, Lundholm N, et al, 2013. Autecology and phylogeny ofand(Dinophyceae), with emphasis on taxonomy ofbased on light microscopy, scanning electron microscopy and LSU r DNA 1[J]. Journal of Phycology, 49(3): 536-545.
Momigliano P, Sparrow L, Blair D, et al, 2013. The diversity ofspp. (Dinophyceae Ostreopsidaceae) in the Central Great Barrier Reef Region. PLOS ONE, 8(10): e79278.doi: 10.1371/journal.pone.0079278.
Nascimento S M, DA Silva R A F, Oliveira F, et al, 2019. Morphology and molecular phylogeny of Coolia tropicalis,and a new lineage of thespecies complex (Dinophyceae) isolated from Brazil[J]. European Journal of Phycology, 54(3): 484–496.
Nunn G B, Theisen B F, Christensen B, et al, 1996. Simplicity-correlated size growth of the nuclear 28S ribosomal RNA D3 expansion segment in the crustacean order Isopoda[J]. Journal of Molecular Evolution, 42(2): 211–223.
Paz B, Daranas A H, Norte M, et al, 2008. Yessotoxins, a group of marine polyether toxins: an overview[J]. Marine Drugs, 6(2): 73–102.
Penna A, Vila M, Fraga S, et al, 2005. Characterization ofand(Dinophyceae) isolates in the western Mediterranean Sea based on morphology, toxicity and internal transcribed spacer 5.8S rDNA sequences[J]. Journal of Phycology, 41(1): 212–225.
Pin L C, Teen L P, Ahmad A, et al, 2001. Genetic Diversity of(Dinophyceae) from Malaysia[J]. Marine Biotechnology, 3(3): 246–255. Rhodes L, Adamson J, Suzuki T, et al, 2000. Toxic marine epiphytic dinoflagellates,and(Dinophyceae), in New Zealand[J]. New Zealand Journal of Marine and Freshwater Research, 34(2): 371–383.
Rhodes L, Smith K, Papiol G G, et al, 2014. Epiphytic dinoflagellates in sub-tropical New Zealand, in particular the genusMeunier[J]. Harmful Algae, 34: 36–41.
Rhodes L L, Smith K F, Munday R, et al, 2010. Toxic dinoflagellates (Dinophyceae) from Rarotonga, Cook Islands[J]. Toxicon, 56(5): 751–758.
Rhodes L L, Thomas A E, 1997.(Dinophyceae): a toxic epiphytic microalgal species found in New Zealand (Note)[J]. New Zealand Journal of Marine and Freshwater Research, 31(1): 139–141.
Ronquist F, Teslenko M, VAN DER Mark P, et al, 2012. MrBayes 3.2: efficient Bayesian phylogenetic inference and model choice across a large model space[J]. Systematic Biology, 61(3): 539–542.
Scholin C A, Herzog M, Sogin M, et al, 1994. Identification of group-and strain-specific genetic markers for globally distributed(Dinophyceae). II. Sequence analysis of a fragment of the LSU rRNA gene[J]. Journal of Phycology, 30(6): 999–1011.
Ten-Hage L, Turquet J, Quod J P, et al, 2000.sp. nov. (Dinophyceae), a new sand-dwelling dinoflagellate from the southwestern Indian Ocean[J]. Phycologia, 39(5): 377–383.
Wakeman K C, Yamaguchi A, Roy M C, et al, 2015. Morphology, phylogeny and novel chemical compounds from(Dinophyceae) from Okinawa, Japan[J]. Harmful Algae, 44: 8–19.
Morphology, phylogeny and toxicity of(Dinophyceae) from the Xisha Islands, China
HUANG Lifen1, LI Qun1, LÜ Songhui1, ZHANG Liang2, XIE Xuedong2
1. Research Center for Harmful Algae and Marine Biology, Jinan University, Guangzhou 510632, China; 2. Guangdong environmental monitoring center, Guangzhou 510362, China
is a widespread and toxic genus of benthic marine dinoflagellate. In this study, four strains ofspecies were examined as, which were collected in the Xisha Islands of the South China Sea in recent years. Morphology was determined using light microscopy and scanning electron microscopy. Phylogenetic analyses were constructed based on the sequences of the large subunit rDNA and the internal transcribed spacer region. The bioassay toxicity test of brine shrimp () demonstrated that the algal lysates extracted from different strains ofexhibited different toxic effects. At 48 h, the LC50 of XS554 strain was 1.42 mg·mL–1(approximately 1.1×105cells·mL–1) and 5XS15 strain was 1.92 mg·mL–1(approximately 1×105cells·mL–1).
; morphology; phylogeny;toxicity;
Q178.53; Q945.45
A
1009-5470(2020)03-0086-12
10.11978/2019129
http://www.jto.ac.cn
2019-12-11;
2020-02-03。
林强编辑
国家自然科学基金项目(41876173、41706126); 科技基础资源调查专项(2018FY100200、2018FY100100)
黄丽芬(1995—), 女, 广东省清远市人, 硕士研究生, 研究方向为藻类分类。E-mail: hhhliii22@163.com
吕颂辉。E-mail: lusonghui1963@163.com
2019-12-11;
2020-02-03.
Editor: LIN Qiang
National Natural Science Foundation of China(41876173, 41706126); Science & Technology Basic Resources Investigation Program of China (2018FY100200, 2018FY100100)
LÜ Songhui. E-mail: lusonghui1963@163.com

