刺巨藤壶精子的发生及其超微结构
周欢, 林岗, 饶小珍
海洋生物学
刺巨藤壶精子的发生及其超微结构
周欢, 林岗, 饶小珍
福建师范大学生命科学学院, 福建 福州 350117; 福建省特色海洋生物资源可持续利用重点实验室(福建师范大学), 福建 福州 350117
采用扫描和透射电镜技术, 观察刺巨藤壶()精子发生和精子的超微结构特征。结果显示, 刺巨藤壶精子发生经历精原细胞、初级精母细胞、次级精母细胞、精细胞和精子等5个阶段。在精子形成期间, 圆形或椭圆形的细胞核在微管的作用下沿轴丝延长并在胞质内弯曲, 核和轴丝随着精细胞的纵向伸长而延长, 细胞核最终成为线状; 斑块状的染色质逐渐解体, 呈细小颗粒状和粗颗粒状, 最后浓缩成高密度的均质物; 高尔基体分泌的囊泡不断融合, 形成大小不一的附属小滴前体, 最后融合并延伸成一个纺锤形的附属小滴; 许多小的线粒体不断融合成一个细长的线粒体, 移至核的后端。精子为前部带有附属小滴的长线状, 全长约58.39μm, 可分为顶体、颈部、中段和尾部四部分。长锥形的顶体位于精子最前端, 其后为基体; 颈部由基体产生的“9+2”型轴丝和与之并行的线状核组成; 顶体和颈部两者长共约6.65μm。中部长约42.95μm, 纺锤形的附属小滴(长约9.33μm, 最宽处约2.13μm)紧靠核和轴丝, 其后为颗粒状糖原及一个细长的线粒体; 尾部长约8.79μm, 只有轴丝贯穿。
刺巨藤壶; 精子发生; 精子; 超微结构; 附属小滴
鱼类、贝类和甲壳类的精子发生和精子超微结构研究是这些经济动物繁殖学和遗传育种的基础, 也是进行动物分类和种系发生分析的重要依据(Barnes et al, 1971; Kubo et al, 1979; 王艺磊等, 1998; 许星鸿等, 2012; 郑学斌等, 2018; 陈奇成等, 2019)。Brown (1970) 根据有无鞭毛把甲壳动物的精子分为鞭毛型和非鞭毛型两类, 其中鳃尾亚纲(Branchiua)、须虾亚纲(Mystacocarida)和蔓足下纲(Cirripedia)为鞭毛型, 能运动; 鳃足纲(Branchiopoda)、软甲纲(Malacostraca)、桡足亚纲(Copepoda)等为非鞭毛型, 缺乏运动能力。
国外对软甲纲十足目(Decapoda)虾、蟹的无鞭毛类型精子(Poljaroen et al, 2010; Bento et al, 2019)和蔓足下纲的围胸总目(Thoracica)动物的鞭毛型精子形态结构(Kubo et al, 1979; Healy et al, 1990)均有较多研究, 但国内绝大部分研究都集中在软甲纲十足目经济种类精子结构的探究, 如中国明对虾() (葛少钦等, 2008)、罗氏沼虾() (王玉凤等, 2003)、三疣梭子蟹() (管卫兵等, 2009)、中华绒螯蟹()和长江华溪蟹() (堵南山等, 1999; 王兰等, 2000)等, 有关蔓足下纲种类的研究仅见于围胸总目的龟足() (林岗等, 2003)和纹藤壶() (王艺磊等, 1999)。
无柄蔓足类中巨藤壶属的种类个体大, 闭壳肌和卵巢可食用, 具较高的经济价值(López et al, 2010), 近年来人们还对其中某些种类开展了繁育研究(Nunes et al, 2017)。刺巨藤壶()属于节肢动物门(Arthropoda)甲壳亚门(Crustacea)蔓足下纲(Cirripedia)围胸总目(Thoracica), 栖息于热带和亚热带海域低潮带或潮下带, 在我国主要分布于东海和南海(刘瑞玉等, 2007), 往往是沿海污损生物的重要组成(严涛等, 2012; 韩帅帅等, 2018), 同时也是我国沿海居民常采集食用的海鲜。本研究通过扫描和透射电镜技术, 对刺巨藤壶精子发生和精子的超微结构进行了详细观察, 以期为蔓足类精子发生、精子形态与亲缘关系、人工繁育以及污损生物防治等研究积累基础资料。
1 材料和方法
1.1 实验材料
刺巨藤壶采自福建省平潭综合实验区芦洋乡马腿村海区的泡沫浮标。活体解剖, 取出精巢、贮精囊, 切成小块。
1.2 实验方法
1.2.1 扫描电镜
将刺巨藤壶小块贮精囊置于3%戊二醛-1.5%多聚甲醛液中固定(保存于4℃环境下)。将解剖出的精子涂在盖玻片上, 用0.1mol∙L–1的磷酸缓冲液漂洗3次后吸干。加入叔丁醇覆盖样品, 用冷冻干燥仪进行干燥。离子溅射仪喷金, 日立6308-LV型扫描电镜观察并拍照。
1.2.2 透射电镜
将刺巨藤壶小块精巢和小块贮精囊加入到3%戊二醛-1.5%多聚甲醛液中固定几天(保存于4℃环境下)。用0.1mol∙L–1的磷酸缓冲液充分漂洗, 再用1%的锇酸-1.5%亚铁氰化钾液固定1.5h。漂洗, 铀块染色, 酒精丙酮梯度脱水后, 环氧树脂渗透、包埋, LKB-II型超薄切片机切片, 切片用醋酸铀和柠檬酸铅双染色。日立HT7700型透射电镜观察并拍照。
2 结果
刺巨藤壶精子的发生不同步, 从精细管基底膜朝管腔方向, 依次排列着精原细胞、初级精母细胞、次级精母细胞、精细胞和精子等不同阶段的细胞。
2.1 精原细胞
精原细胞紧靠基底膜, 多不规则, 是生精细胞中体积最大的(图1a)。其细胞核较大, 呈不规则形, 核内染色质呈小团块, 大多附于核内膜、少量松散分布于核质中, 核膜界限明显。细胞质电子密度低, 胞质中含有较多近圆形的小线粒体, 多分布于细胞一侧, 线粒体基质电子密度较低, 嵴不发达。早期精原细胞经一次有丝分裂形成晚期精原细胞, 其明显变化是染色质小团块稍增多。图1b显示精原细胞的细胞核将一分为二而胞质未分开的状态。
2.2 初级精母细胞
初级精母细胞经精原细胞转化而来(图1c)。其胞体呈多边形, 体积较精原细胞略小。细胞核较大, 核膜完整, 染色质小团块较精原细胞明显增加, 且部分染色质连在一起, 不均匀分散于核质中。较多椭圆形线粒体分布于细胞一侧; 细胞质无明显变化。图1d为正在分裂的初级精母细胞, 其核已分裂而胞质仍在一起。
2.3 次级精母细胞
次级精母细胞由初级精母细胞经减数第一次分裂而成(图1e)。胞体近椭圆形, 大小约为6.20μm×4.20μm。细胞核占据细胞大部分空间, 双层核膜清晰完整, 核质比明显增大。核中可见一个核仁, 染色质团块增大, 大部分连在一起, 密度增加。细胞质电子密度变大。胞质中椭圆形或圆形线粒体密度增加, 分布于细胞一侧, 极性明显; 高尔基体发育良好, 由数层扁平囊泡构成(图1e)。正在进行减数第二次分裂的次级精母细胞胞体呈椭圆形或圆形, 核内染色质团块逐渐解体, 常出现细胞核已分裂而胞质尚未分开、两个核同在一个细胞中的现象(图1f)。
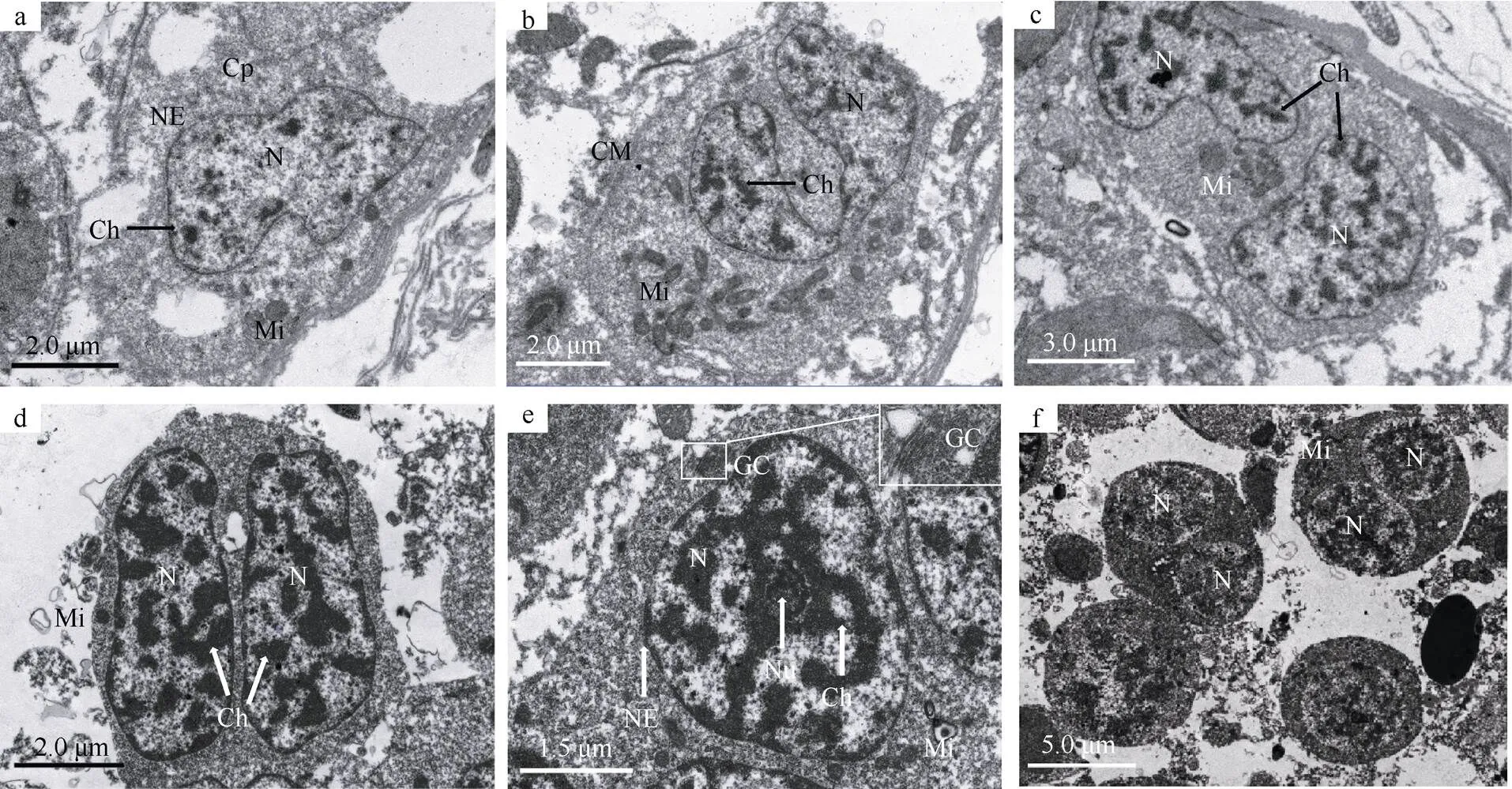
图1 刺巨藤壶精原细胞和精母细胞的超微结构
a. 精原细胞; b. 正在分裂的精原细胞; c. 初级精母细胞; d. 正在分裂的初级精母细胞; e. 次级精母细胞; f. 正在分裂的次级精母细胞。CM: 质膜; Cp: 胞质; GC: 高尔基体; Ch: 染色质; Mi: 线粒体; N: 细胞核; Nu: 核仁; NE: 核膜
Fig. 1 Ultrastructure of spermatogonium and spermatocyte of(a) Spermatogonium; (b) splitting spermatogonium; (c) primary spermatocyte; (d) splitting primary spermatocyte; (e) secondary spermatocyte; (f) splitting secondary spermatocyte. CM: Cell membrane; Cp: cytoplasm; GC: Golgi complex; Ch: chromatin; Mi: mitochondrion; N: nucleus; Nu: nucleolus; NE: nuclear envelope
2.4 精细胞
精细胞由次级精母细胞经减数第二次分裂而成, 并进一步发育形成精子。根据精细胞形状、细胞核的形态、染色质的变化、轴丝和附属小滴的出现, 将精细胞阶段划分为三个时期: 前期精细胞、中期精细胞、后期精细胞。
2.4.1 前期精细胞
刚由次级精母细胞分裂而来的精细胞, 胞体圆形或近椭圆形, 大小约为5.92μm×5.32μm(=10)(图2a)。细胞核较大, 椭圆形或圆形, 大小约为4.12μm×3.84μm(=10), 占据胞体大部分空间; 斑块状染色质逐渐解体、密度变小, 不均匀分布于核质中。随着精细胞的发育, 胞体多变为不规则, 染色质呈细小颗粒较均匀分布于核质中; 线粒体开始融合, 基质密度增加, 体积增大, 嵴增长(图2b)。轴丝开始出现, 紧靠在核一侧, 为典型的“9+2”型结构。细胞核靠近轴丝处凹陷, 核膜靠近轴丝的区域电子密度增加, 双层核膜间隙消失, 其他区域的双层核膜仍清晰可见(图2c)。轴丝紧靠细胞核而逐渐弯曲, 因而有的切面可见两个轴丝紧靠细胞核(图2d)。胞质中可见电子密度高的高尔基体囊泡(图2d)。
2.4.2 中期精细胞
胞体不规则。细胞核仍较大, 开始沿轴丝伸长; 染色质呈粗颗粒状且密度增高、分布更均匀(图2e)。以轴丝为中心在核膜的周缘出现均匀分布的微管(图2e—g)。胞质中可见高尔基体分泌的许多高尔基体囊泡, 囊泡逐渐融合形成多个大小不一的附属小滴前体。附属小滴前体呈圆形或椭圆形, 内含高电子密度的物质, 由双层膜包被(图2h、i)。胞质中可见膨大的线粒体, 嵴发达(图2i); 微管在核膜的周缘逐渐扩大分布, 但未见其围绕整个核周(图2g)。在微管的作用下, 细胞核沿着轴丝进一步伸长变细, 并在胞质中弯曲(图2f)。因细胞核靠近轴丝处凹陷, 最终形成横切面呈“三角形”的核。由于核紧靠轴丝在胞质中伸长弯曲, 因而有的切面往往可见几个胞核, 最多可见4对核与轴丝的组合(图2i)。
2.4.3 后期精细胞
胞体逐渐沿纵向伸长。染色质不断浓缩, 形成高电子密度的均质物, 伸长的细胞核紧贴轴丝同时沿细胞纵轴延伸; 在此期间微管逐渐消失; 高尔基体仍继续分泌高尔基体囊泡, 囊泡不断融合进入附属小滴前体, 多个附属小滴前体也相互融合成一个大的附属小滴前体(图2j)。细胞核的后端可见一个细而长的线粒体(图2k)。最后, 高电子密度的附属小滴前体紧靠核和轴丝, 沿着精细胞纵轴方向延伸成纺锤形的附属小滴, 横切面可见附属小滴直径是核的数倍(图2l)。细长的细胞核紧靠轴丝继续横向收缩、纵向拉长, 精细胞丢弃多余的细胞质形成线形成熟精子。
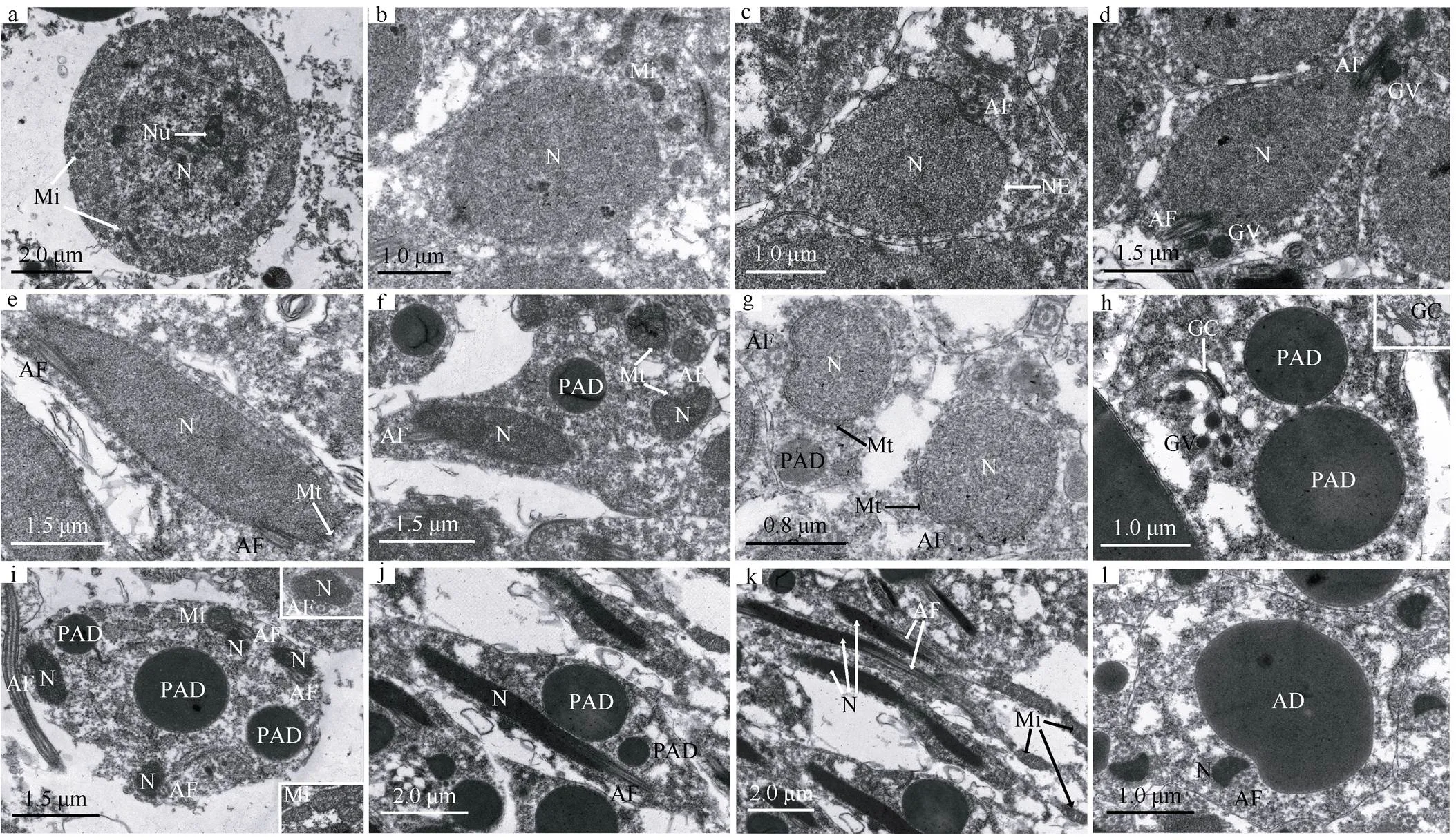
图2 刺巨藤壶精细胞的超微结构
a—d. 逐步发育的早期精细胞; e. 中期精细胞示伸长的细胞核; f. 中期精细胞示核膜周缘微管和伸长弯曲的细胞核; g. 中期精细胞示核膜周缘微管; h. 中期精细胞示高尔基体; i. 中期精细胞横切; j. 后期精细胞纵切; k. 后期精细胞纵切示一个线粒体; l. 后期精细胞横切。AD: 附属小滴; AF: 轴丝; GV: 高尔基体囊泡; Mi: 线粒体; Mt: 微管; N: 细胞核; PAD: 附属小滴前体
Fig. 2 Spermatid ultrastructure of(a-d) Developing early spermatid; e) mid-spermatid showing elongated nucleus; f) mid-spermatid showing perinuclear microtubules, elongated and curved nucleus; g) mid-spermatid showing perinuclear microtubules; h) mid-spermatid showing Golgi complex; i) cross section of mid-spermatid; j) longitudinal section of late spermatid; k) longitudinal section of late spermatid showing a single mitochondrion; l) cross section of late spermatid. AD: Accessory droplet; AF: axial filament; GV: Golgi vesicle; Mi: mitochondrion; Mt: microtubules; N: nucleus; PAD: precursor of accessory droplet
2.5 成熟精子
扫描电镜下可见刺巨藤壶精子为前部带有一纺锤形附属小滴的长线形结构(图3a)。精子全长约为58.39μm(=10), 可分为顶体、颈部、中段和尾部四部分, 由顶体、基体、线状的核、与核并行并贯穿末端的轴丝、核后一细长的线粒体及糖原颗粒组成。
顶体呈长锥形, 位于精子最前端, 其电子密度中等, 较核和附属小滴低(图3b)。从横切面可见顶体内含物的分布不均匀, 较高密度的顶体物质围绕外周, 中央为密度较低的呈絮状的顶体物质(图3c)。顶体正后方为基体, 轴丝由基体产生并延伸至精子末端, 纵贯整个精子(图3d)。纵切面可见高电子密度的线状核与轴丝并行延伸; 横切面可见线状核呈“三角形”, 长约0.36μm、宽约0.23μm(图3e、f)。附属小滴位于中段的前端, 紧靠核和轴丝, 由双层膜构成, 电子密度高且均匀; 纵切面可见附属小滴呈纺锤形, 长约9.33μm, 最宽处约2.13μm(图3g); 横切面的附属小滴呈大小不一有个小缺口的圆形(图3j)。核后方是一细长的线粒体, 纵切面可见其电子密度比核和附属小滴低(图3h)。附属小滴近末端开始出现大量颗粒状糖原直至线粒体近前端, 糖原分布于核和轴丝的外侧(图3h、i)。线粒体之后只有“9+2”型轴丝延伸至精子末端。
颈部从基体前端至附属小滴之前, 较短, 主要由轴丝和核组成, 横切面可见呈“三角形”的核紧靠着“9+2”型的轴丝(图3f)。顶体和颈部两者长约6.65μm。中段从附属小滴前端起一直到线粒体末端为止, 长约42.95μm, 除轴丝始终纵贯外, 依次有与轴丝伴行的线状核、附属小滴、糖原颗粒及核后细长的线粒体。不同位置的中段横切面结构不同: 过附属小滴的横切面可见“三角形”的核、“9+2”型轴丝及圆形的附属小滴, 附属小滴直径是核的数倍(图3j); 过附属小滴末端的横切面可见“三角形”的核、轴丝、圆形的附属小滴及糖原颗粒(图3k); 过糖原的横切面可见“三角形”的核、轴丝及糖原颗粒(图3l中①); 过线粒体前端的横切面可见椭圆形线粒体、轴丝和糖原颗粒(图3l中②); 过线粒体中部以后的横切面可见椭圆形线粒体和轴丝(图3m)。尾部从线粒体末端一直到精子末端为止, 长约8.79μm, 细线形, 主要由轴丝和质膜组成, 横切面只能观察到典型的“9+2”型结构的轴丝(图3n)。
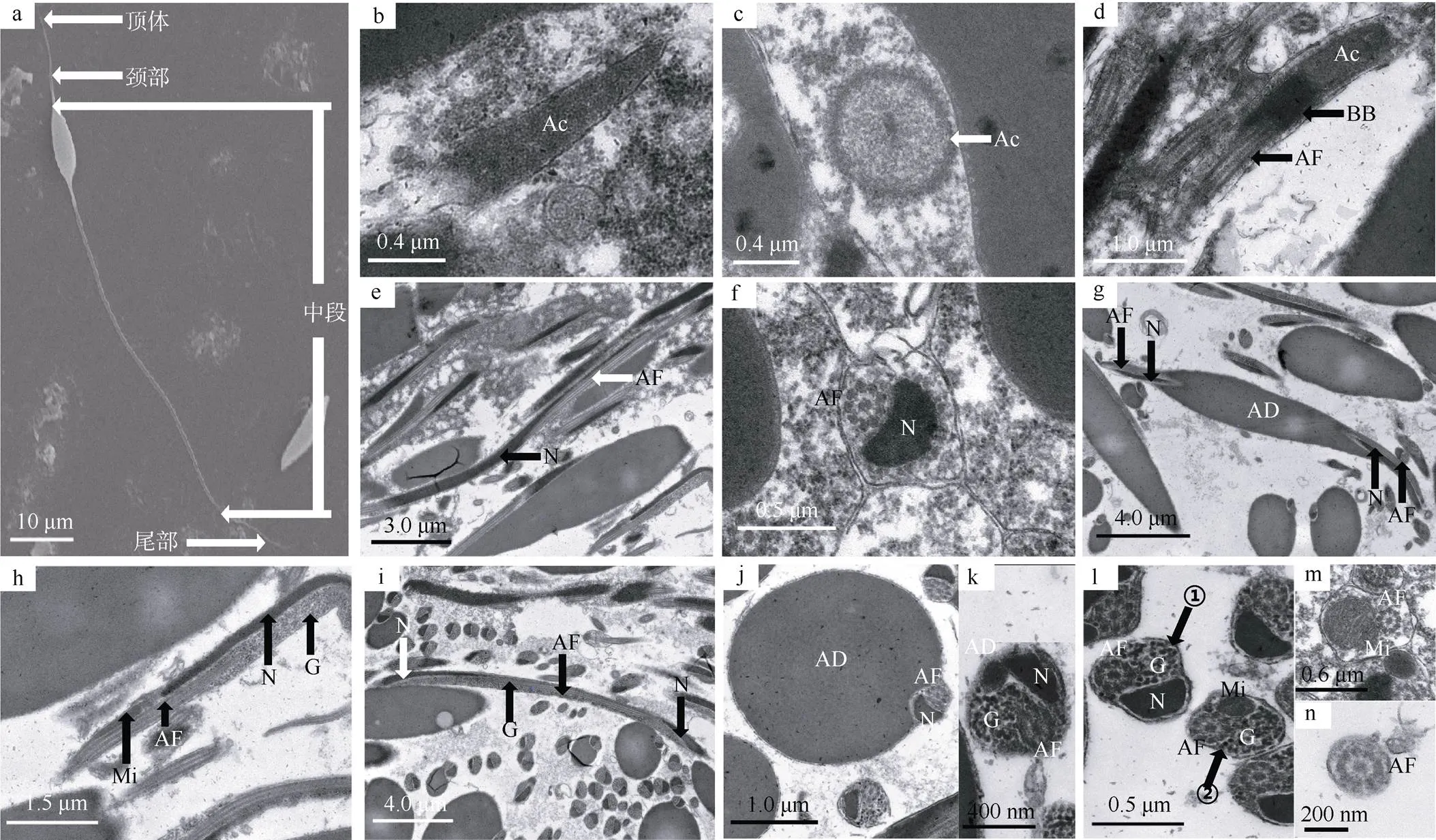
图3 刺巨藤壶精子形态及超微结构
a. 成熟精子; b. 顶体纵切; c. 顶体横切; d. 过基体纵切; e. 精子纵切; f. 过颈部横切; g. 过附属小滴纵切; h. 中段过线粒体纵切; i. 中段过糖原颗粒纵切; j. 中段过附属小滴横切; k. 中段过附属小滴末端横切; l. ①中段过糖原颗粒横切, ②中段过线粒体前端横切; m. 中段过线粒体横切; n. 尾部横切。Ac: 顶体; AD: 附属小滴; AF: 轴丝; BB: 基体; G: 糖原颗粒; Mi: 线粒体; N: 细胞核
Fig. 3 Spermatozoon morphology and ultrastructure of. a) Whole spermatozoon; b) longitudinal section of acrosome; c) cross section of acrosome; d) longitudinal section of basal body; e) longitudinal section of sperm; f) cross section of neck; g) longitudinal section of accessory droplet; h) longitudinal section of mitochondrion in middle piece; i) longitudinal section of glycogenosome in middle piece; j) cross section of accessory droplet in middle piece; k) cross section of accessory droplet posterior in middle piece; l) ① Cross section of glycogenosome in middle piece; ②cross section of mitochondrion anterior in middle piece; m) cross section of mitochondrion in middle piece; n) cross section of tail. Ac: Acrosome; AD: accessory droplet; AF: axial filament; BB: basal body; G: glycogenosome; Mi: mitochondrion; N: nucleus
3 讨论
刺巨藤壶精子发生由精原细胞形成初级精母细胞, 初级精母细胞经减数分裂形成次级精母细胞和精细胞, 精细胞再经过一系列形态结构的变化形成成熟精子, 这与Dionisio 等(2007)观察到巨藤壶()精巢的精细管中依次排列着精原细胞、精母细胞、精细胞和精子等不同阶段细胞的结果相对应。另外, 类似于蔓足类其他成员(Kubo et al, 1979; Healy et al, 1990), 刺巨藤壶的精子同样具有典型的有鞭毛精子的结构特征, 即为前部带有附属小滴的线形结构, 可分为顶体、颈部、中段和尾部四部分, 由顶体、顶体覆盖着的基体、轴丝与线状的核并行贯穿始终、核后一细长的线粒体及糖原颗粒组成。
3.1 细胞核
在刺巨藤壶精子发生过程中, 细胞核的变化显著, 形状由最初的多边形或椭圆形逐渐变为线形; 斑块状的染色质逐渐解体, 密度减小, 呈小颗粒状较均匀分布, 接着呈粗颗粒状均匀分布, 最后浓缩成高密度的均质物。刺巨藤壶染色质的这一变化过程与有柄类的龟足相类似(林岗等, 2003)。细胞核沿轴丝伸长变细, 横切面可见多对核与轴丝的组合, 且精子中并行的核和轴丝的长度是精细胞直径的数倍, 由此可推测在精细胞整体未延伸之前, 伸长的核和轴丝在精细胞内部是弯曲的, 最后才随着精细胞的纵向伸长而伸长。
虽然在无脊椎动物的精子发生中核质浓缩是普遍现象, 但核周微管分布状态与核延伸的关联性仅在某些种类中可观察到, 其中除了与刺巨藤壶亲缘关系较近的围胸总目无柄目(Sessilia)中的白脊管藤壶() (Kubo et al, 1979)、有柄目(Pedunculata)中的龟足(林岗等, 2003)和(Azevedo et al, 1982)外, 也可在亲缘关系较远的节肢动物昆虫纲(Insecta)的蜂()、黑腹果蝇() (Adiyodi et al, 1983)和软体动物中的虎斑乌贼() (陈奇成等, 2019)等种类中观察到。
刺巨藤壶在精子发生过程中, 微管虽在以轴丝为中心的核膜周缘出现, 但始终未围绕整个核周, 伸长的核及并行的轴丝在精细胞内部是弯曲的, 最后才随着精细胞的纵向伸长而伸长。这与同为无柄类的白脊管藤壶的精子发生明显不同, 后者整个核膜周缘均出现微管, 细胞核紧靠轴丝随着胞体的伸长而直接伸长, 且没有在精细胞内部弯曲的过程(Kubo et al, 1979)。至于有柄类龟足, 其后期精细胞的轴丝、核及附属小滴均在中段弯曲成U形, 精子在储精囊成熟后才弹开呈长线状, 核周微管呈V型排列并出现核囊结构(林岗等, 2003)。
核周微管的出现可能与精子细胞核的形成存在着某种密切联系, Mclntoshr和Porter认为, 核的形状是由于核周微管施加压力产生的结果(丁汉波等, 1987)。Martínez-Soler 等(2007) 提出, 细胞核的弯曲同样与核周微管分布有关, 微管通过与染色质发生连接影响了细胞核的形变。刺巨藤壶中期精细胞的核周出现微管但分布不均匀, 后期精细胞染色质浓缩形成致密核时微管消失, 细胞核经历由弯曲到直线的变化, 说明微管可能对核施加大小不同的力以矫正弯曲的精核。因此, 刺巨藤壶精子发生过程中出现的核周微管, 进一步说明了核周微管在精子细胞核形成过程中的作用。
蔓足类成熟精子过细胞核的横切面形态是分类的重要依据, 在围胸总目中呈“三角形”(triangular), 尖胸总目(Acrothoracica)中呈“哑铃形”(dumb-bell shaped), 根头总目(Rhizocephala)中呈“新月形”(crescentic) (Healy et al, 1990)。刺巨藤壶成熟精子的细胞核呈典型的线状, 与其他蔓足类的精子形状一致, 但其过细胞核的横切面呈“三角形”, 体现了围胸总目精子细胞核的形态特征。
3.2 附属小滴
蔓足类精子的最主要特征之一是具有附属小滴, 但从本研究结果和以往报道(Kubo et al, 1979; Healy et al, 1990; 王艺磊等, 1999)可以看出, 附属小滴在巨藤壶属3个种之间的大小相差不多, 形状也较类似, 且内部结构均呈致密均匀状; 然而, 对于藤壶科不同属之间的成员而言, 附属小滴的差异则较大, 不仅表现出形状多样化, 而且大小也差异显著(如纹藤壶附属小滴长度可达巨藤壶属的2~3倍), 甚至内部结构也呈现出不同状态(表1)。因此, 附属小滴的形状、位置和内部结构在蔓足类系统分类和演化上有重要意义。
有关附属小滴的形成, Kubo 等 (1979) 认为其是白脊管藤壶精子发生过程中形成的一种独特的高尔基体产物。然而, 王艺磊等 (1999) 并未在附属小滴上检测到高尔基体产物所含的酸性磷酸酶和多糖, 但观察到其膜表面布满核糖体, 由此推测纹藤壶的附属小滴可能由粗面内质网形成。基于在刺巨藤壶的中期和后期精细胞中可观察到高尔基体周围出现许多高尔基体囊泡, 逐渐融合形成大小不一的高密度附属小滴前体, 并最终融合成一个附属小滴, 因此, 刺巨藤壶的附属小滴可能同样是由高尔基体形成的。
3.3 线粒体
线粒体是细胞中供应能量的主要细胞器, 其数量、大小的变化反映了精子发生过程中对能量需求的变化。在刺巨藤壶精子发生的前期, 线粒体数量多而小, 随后内部嵴增多、密度增大、数量变少, 说明精子发生前期对能量的需求是不断增加的; 后期线粒体数量逐渐减少, 直至形成成熟精子后只余一个位于细胞核后的细长线粒体, 这应与其在体外的运动时间较短相适应, 同时与中段具有大量糖原颗粒能提供能量相关联。
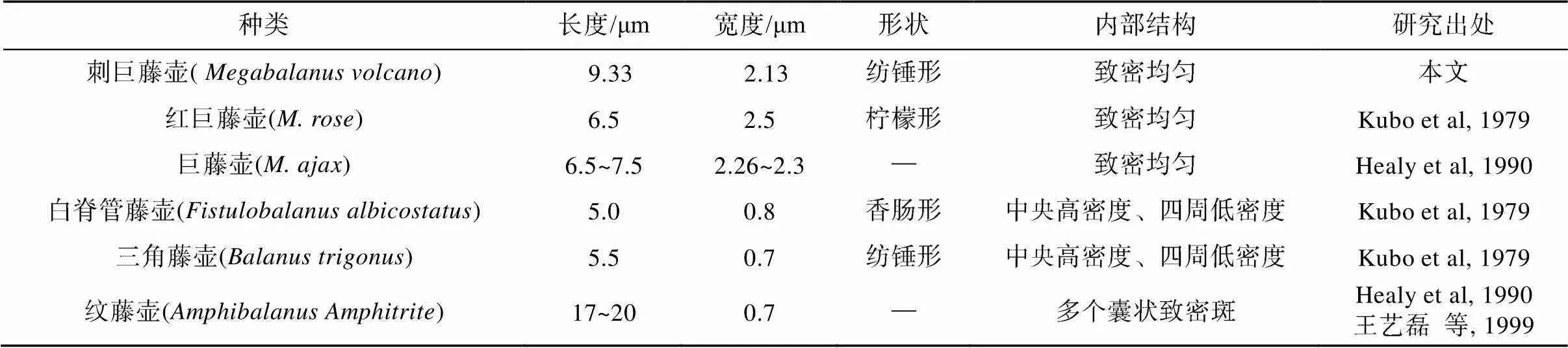
表1 刺巨藤壶等6种藤壶精子附属小滴的比较
精子尾部运动需依靠线粒体提供能量, 大多数能运动的精子均具有大量的线粒体或由一些小的线粒体融合形成相当大的线粒体(Munn et al, 1970)。刺巨藤壶成熟精子只余一个位于细胞核后的细长线粒体的现象, 在白脊管藤壶(Kubo et al, 1979)、纹藤壶(王艺磊等, 1999)、(Azevedo et al, 1982)和龟足(林岗等, 2003)等种类中也可观察到, 应是蔓足类精子的一个特征。
陈奇成, 蒋霞敏, 韩庆喜, 等, 2019. 虎斑乌贼精子发生及精子超微结构[J]. 宁波大学学报(理工版), 32(2): 1–8. CHEN QICHENG, JIANG XIAMIN, HAN QINGXI, et al, 2019. Spermatogenesis and sperm ultrastructure of[J]. Journal of Ningbo University (Natural Science and Engineering Edition), 32(2): 1–8 (in Chinese with English abstract).
丁汉波, 仝允栩, 黄浙, 1987. 发育生物学[M]. 北京: 科学出版社: 55–60. DING HANBO, TONG YUNXU, HUANG ZHE, 1987. Developmental biology[M]. Beijing: Science Press: 55–60 (in Chinese).
堵南山, 赖伟, 陈立侨, 等, 1999. 蟹类精子超微结构的比较研究[J]. 动物学研究, 20(5): 372–378. DU NANSHAN, LAI WEI, CHEN LIQIAO, et al, 1999. Studies on the comparative ultrastructure of crab spermatozoa (Crustacea, Decapoda, Reptantia, Brachyura)[J]. Zoological Research, 20(5): 372–378 (in Chinese with English abstract).
葛少钦, 康现江, 郭明申, 等, 2008. 中国明对虾精子形成过程中顶体的发生[J]. 台湾海峡, 27(1): 51–57. GE SHAOQIN, KANG XIANJIANG, GUO MINGSHEN, et al, 2008. Development of acrosome during spermiogenesis of(Osbeck)[J]. Journal of Oceanography in Taiwan Strait, 27(1): 51–57 (in Chinese with English abstract).
管卫兵, 宣富君, 戴小杰, 等, 2009. 东海三疣梭子蟹精子发生及精荚形成[J]. 中国水产科学, 16(2): 173–182. GUAN WEIBING, XUAN FUJUN, DAI XIAOJIE, 2009. Spermatogenesis and spermatophore formation of swimming crab (Miers, 1876) in East China Sea[J]. Journal of Fishery Sciences of China, 16(2): 173–182 (in Chinese with English abstract).
韩帅帅, 曹文浩, 严涛, 等, 2018. 雷州半岛东部近海浮标大型固着生物污损特点[J]. 海洋与湖沼, 49(4): 851–857. HAN SHUAISHUAI, CAO WENHAO, YAN TAO, et al, 2018. Biofouling by sessile macro-organisms on offshore buoys east of the Leizhou Peninsula, the Northern South China Sea[J]. Oceanologia Et Limnologia Sinica, 49(4): 851–857 (in Chinese with English abstract).
林岗, 饶小珍, 陈文列等, 2003. 龟足精子发生和成熟精子的超微结构[J]. 应用与环境生物学报, 9(4): 417–421. LIN GANG, RAO XIAOZHEN, CHEN WENLIE, et al, 2003. Ultrastructure of spermatogenesis and spermatozoom in(Cirripedia)[J]. Chinese Journal of Applied and Environmental Biology, 9(4): 417–421 (in Chinese with English abstract).
刘瑞玉, 任先秋, 2007. 中国动物志: 第四十二卷-无脊椎动物 (甲壳动物亚门, 蔓足下纲, 围胸总目)[M]. 北京: 科学出版社: 513–515. LIU RUIYU, REN XIANQIU, 2007. Fauna sinica: Volume 42; Invertebrata (Crustacea, Cirripedia, Thoracica)[M]. Beijing: Science Press: 513–515 (in Chinese).
王兰, 堵南山, 赖伟, 2000. 长江华溪蟹精子的超微结构[J]. 动物学报, 46(2): 227–229. WANG LAN, DU NANSHAN, LAI WEI, 2000. Ultrastructure of sperm in freshwater crab ()[J]. Acta Zoologica Sinica, 46(2): 227–229 (in Chinese with English abstract).
王玉凤, 杨晓菁, 朱朝兵, 等, 2003. 罗氏沼虾精子发生的超微结构[J]. 华中师范大学学报(自然科学版), 37(4): 531–536, 539. WANG YUFENG, YANG XIAOJING, ZHU CHAOBING, et al, 2003. Ultrastructure of spermatogenesis in freshwater prawn,(Crustacea: Decapoda)[J]. Journal of Central China Normal University (Natural Sciences), 37(4): 531–536, 539 (in Chinese with English abstract).
王艺磊, 张子平, 李少菁, 1998. 甲壳动物精子学研究概况Ⅱ. 精子发生与精子的生化组成[J]. 动物学杂志, 33(4): 52–57. WANG YILEI, ZHANG ZIPING, LI SHAOJING, 1998. A survey of spermology in crustaceans Ⅱ. Spermatogenesis and sperm biochemical composition[J]. Chinese Journal of Zoology, 33(4): 52–57 (in Chinese).
王艺磊, 张子平, 李少菁, 1999. 纹藤壶精子发生和成熟精子的超微结构[J]. 动物学报, 45(3): 355–358. WANG YILEI, ZHANG ZIPING, LI SHAOJING, 1999. Ultrastructure of spermatogenesis and spermatozoon in[J]. Acta Zoologica Sinica, 45(3): 355–358 (in Chinese with English abstract).
许星鸿, 阎斌伦, 郑家声, 等, 2012. 甲壳动物精子生物学的研究进展[J]. 海洋湖沼通报, (1): 6–14. XU XINGHONG, YAN BINLUN, ZHENG JIASHENG, et al, 2012. A review on biological characteristic of crustacean sperm[J]. Transactions of Oceanology and Limnology, (1): 6–14 (in Chinese with English abstract).
严涛, 黎祖福, 胡煜峰, 等, 2012. 中国沿海无柄蔓足类研究进展[J]. 生态学报, 32(16): 5230–5241. YAN TAO, LI ZUFU, HU YUFENG, et al, 2012. A review on the balanomorph barnacles in the coastal waters of China[J]. Acta Ecologica Sinica, 32(16): 5230–5241 (in Chinese with English abstract).
郑学斌, 张清科, 乐韵, 等, 2018. 香鱼()精子的超微结构及其与鲤形目及鲑形目其他鱼类精子结构的比较研究[J]. 海洋与湖沼, 49(4): 866–872. ZHENG XUEBIN, ZHANG QINGKE, YUE YUN, et al, 2018. Scanning and transmission electron microscopic observation of spermatozoon in[J]. Oceanologia Et Limnologia Sinica, 49(4): 866–872 (in Chinese with English abstract).
ADIYODI K G, ADIYODI R G, 1983. Reproductive biology of invertebrates: Volume II; Spermatogenesis and sperm function[M]. New York: John Wiley and Sons: 407–449.
AZEVEDO C, CORRAL L, 1982. Ultrastructural study of spermatozoon and spermiogenesis of(Crustacea; Cirripedia), with special reference to nucleus maturation[J]. Journal of Submicroscopic Cytology, 14(4): 641–654.
BARNES H, KLEPAL W, MUNN E A, 1971. Observations on the form and changes in the accessory droplet and motility of the spermatozoa of some cirripedes[J]. Journal of Experimental Marine Biology and Ecology, 7(2): 173–196.
BENTO M A G, LÓPEZ GRECO L S, ZARA F J, 2019. Seminal fluid production and sperm packaging in dromiid crabs (Brachyura, Podotremata)[J]. Zoology, 132: 17–30.
BROWN G G, 1970. Some comparative aspects of selected crustacean spermatozoa and crustacean phylogeny[M] // BACCETTI B. Comparative spermatology. New York: Academic Press: 183–203.
DIONISIO M, RODRIGUES A, COSTA A, 2007. Reproductive biology of(Pilsbry), the Azorean Barnacle[J]. Invertebrate Reproduction and Development, 50(3): 155–162.
HEALY J M, ANDERSON D T, 1990. Sperm ultrastructure in the Cirripedia and its phylogenetic significance[J]. Records of the Australian Museum, 42(1): 1–26.
KUBO M, NAKASHIMA S, TSUKAHARA J, et al, 1979. Spermiogenesis in barnacles with special reference to organization of the accessory body[J]. Development, Growth and Differentiation, 21(5): 445–456.
LÓPEZ D A, LÓPEZ B A, PHAM C K, et al, 2010. Barnacle culture: background, potential and challenges[J]. Aquaculture Research, 41(10): e367–e375.
MARTÍNEZ-SOLER F, KURTZ K, CHIVA M, 2007. Sperm nucleomorphogenesis in the cephalopod[J]. Tissue and Cell, 39(2): 99–108.
MUNN E A, BARNES H, 1970. The fine structure of the spermatozoa of some cirripedes[J]. Journal of Experimental Marine Biology and Ecology, 4(3): 261–286.
NUNES C, RODEIA J, PAULINO B, et al, 2017. Larval rearing of the giant Azorean barnacle,(Pilsbry, 1916): feeding trials, larval development and settlement on artificial substrata[J]. Aquaculture Research, 48(6): 2812–2826.
POLJAROEN J, VANICHVIRIYAKIT R, TINIKUL Y, et al, 2010. Spermatogenesis and distinctive mature sperm in the giant freshwater prawn,(De Man, 1879)[J]. Zoologischer Anzeiger, 249(2): 81–94.
Ultrastructure of spermatogenesis and spermatozoon of
ZHOU Huan, LIN Gang, RAO Xiaozhen
College of Life Sciences, Fujian Normal University, Fuzhou 350117, China;Fujian Key Laboratory of Special Marine Bio-resources Sustainable Utilization, Fujian Normal University, Fuzhou 350117, China
The ultrastructural characteristics of spermatogenesis and spermatozoon of the barnaclewere observed by scanning and transmission electron microscopy. The results showed that its spermatogenesis included five developmental stages, i.e., spermatogonium, primary spermatocyte, secondary spermatocyte, spermatid, and mature spermatozoon. During spermatogenesis, a circular or oval nucleus extended along with an axial filament and bent in cytoplasm under the action of microtubules. The nucleus further elongated with longitudinal extension of a spermatid, and finally became filiform. Massive chromatin of nucleus underwent disintegration, fine granules, coarse granules, and eventually condensed into a high electron density homogenizer.The vesicles secreted by the Golgi complexcoalesced to different sizes of precursors of accessory droplet, and finally fused into an accessory droplet of high electron density. Many small mitochondria fused to a slender one that was eventually positioned behind the nucleus. The spermatozoon (about 58.39 μm in length), which was divided into acrosome, neck, middle piece, and tail, was long filiform with an accessory droplet. The conical acrosome was located at the spermatozoon anterior, followed by a basal body. The neck was composed of a "9+2" type axial filament, and the filiform nucleus was parallel to the axial filament. The length of acrosome and neck was about 6.65 μm. The middle piece was about 42.95 μm in length. The spindle-shaped accessory droplet (about 9.33 μm long and 2.13 μm wide) was adjacent to the nucleus and axial filament, followed by a mass of glycogenosomes and a slender mitochondrion. The tail (about 8.79 μm in length) only had a typical "9+2" axial filament.
; spermatogenesis; spermatozoon; ultrastructure; accessory droplet
Q492.4; Q959.223+.41
A
1009-5470(2020)03-0098-08
10.11978/2019082
http://www.jto.ac.cn
2019-09-01;
2019-12-29。
林强编辑
福建省高校产学合作项目(2018N5007)
周欢(1994—), 女, 重庆市开州区人, 研究生, 研究方向甲壳动物生理生态。E-mail:18396111485@163.com
饶小珍(1966—), 教授。E-mail: xzrao@fjnu.edu.cn
2019-09-01;
2019-12-29.
Editor: LIN Qiang
Cooperative Project on production and education of University in Fujian Province (2018N5007)
RAO Xiaozhen. E-mail: xzrao@fjnu.edu.cn

