三亚湾肥胖软箭虫成体与幼体现场摄食差异研究
王崚力, 胡思敏, 郭明兰, 李涛,4, 王有军, 黄晖,4, 刘胜
海洋生物学
三亚湾肥胖软箭虫成体与幼体现场摄食差异研究
王崚力1,2,3, 胡思敏1,3, 郭明兰1,3, 李涛1,3,4, 王有军1,2, 黄晖1,3,4, 刘胜1,3
1. 中国科学院热带海洋生物资源与生态重点实验室, 广东省应用海洋生物学重点实验室, 中国科学院南海海洋研究所, 广东 广州 510301; 2. 中国科学院大学, 北京 100049; 3. 中国科学院南海生态环境工程创新研究院, 广东 广州 510301; 4. 中国科学院海南热带海洋生物实验站, 海南 三亚 572000
毛颚类是热带近岸海域中上层鱼类的食物来源, 同时又是重要的肉食性浮游动物, 数量丰富, 然而其维持种群结构的生存策略尚不清晰。本文运用分子生物学技术, 分析了三亚湾海域毛颚类优势种肥胖软箭虫()成体与幼体的肠道食物组成, 以期从食物资源利用的角度揭示其维持种群结构的营养策略。研究结果显示, 幼体和成体摄食的浮游生物种类分别为21种和19种, 共同的食物类群有桡足类、小型水母类、硅藻和多毛类。成体与幼体食物偏好差异显著, 成体主要的食物来源是小型水母类(59%), 而幼体主要的食物来源是桡足类(60%); 幼体营养生态位(5.16)高于成体(2.89), 且二者食物重叠度低(0.21), 表明成体与幼体食物分化明显。研究结果揭示, 即使成体与幼体大量共存, 它们也可以通过摄食分化避免食物资源竞争, 这种分配策略对毛颚类保证足够幼体存活率和维持种群数量具有重要意义。
肥胖软箭虫; 成体与幼体; 摄食分化; 营养策略; 种群结构
毛颚类主要摄食小型浮游动物, 自身又是鱼类的优质饵料, 处于海洋浮游食物链传递的中心位置。毛颚类的食物种类丰富, 桡足类无节幼虫通常被认为是其主要的食物来源(Bone et al, 1991), 枝角类、水母类、端足类和磷虾类也常有发现(Kehayias et al, 1996; Øresland, 2000)。毛颚类成体与幼体的主要食物类群同为水体中高丰度的桡足类无节幼虫和枝角类(Kehayias et al, 2005; Lie et al, 2012), 在食物资源受限的环境中, 成体与幼体食物竞争激烈(尤其是温带海域), 同类相食率高并成为毛颚类幼体死亡的主因, 进而影响种群结构(Kehayias et al, 1996; Øresland, 2000)。但在近岸海域中毛颚类数量丰度高, 且常聚群出现, 成体和幼体通常大量共存(Goswami et al, 1982), 幼体比上成体比例达0.68~3.26(Lie et al, 2012)。因此, 研究成体和幼体现场食物组成对于认识它们之间的摄食差异及大量共存的适应机制具有重要意义。以往研究发现, 毛颚类在生长发育不同阶段存在食性转变的现象, 即随着个体生长, 其对食物资源的利用会发生明显的改变, 成体和幼体可能通过食物分化减少竞争(Kehayias et al, 1996; Kehayias et al, 2008), 但是并没有热带珊瑚礁海域的毛颚类摄食研究。
研究毛颚类食性的传统方法主要是显微镜检肠道内容物(Bone et al, 1991), 该方法虽能获得部分食物信息, 但由于毛颚类空消化道比例高(Yoon et al, 2016; Amano et al, 2019), 且存在消化道食糜组分难以准确鉴定(Kehayias et al, 2008)的问题, 难以真实反映毛颚类的摄食组成 (Grigor et al, 2015)。近年来, 分子生物学方法已经成功应用于浮游动物食谱研究, 该方法不仅可以精准高效地分析海洋浮游生物现场食物组成, 而且能“半定量”不同食物源对消费者的贡献(King et al, 2008; Hu et al, 2015; Lin et al, 2018), 但目前该方法在毛颚类食性分析中应用较少, 仅Bonnet等 (2010)实践了该方法, 他利用哲水蚤16S rDNA特有引物成功鉴定出英吉利海峡毛颚类肠道中全年均存在桡足类海岛哲水蚤(), 证明了二者间的摄食关系, 从而解释了这两种生物丰度在该海域的相关性。
三亚湾是我国重要的热带海湾, 湾内分布着发育良好的珊瑚礁, 海洋生物资源丰富。毛颚类是三亚湾周年均出现的优势类群, 其中最主要的优势种为肥胖软箭虫(), 调查显示成体和幼体在夏季通常大量共存(尹健强等, 2004b; 时翔等, 2007; 柯志新等, 2011)。本文以三亚湾夏季毛颚类为研究对象, 应用分子生物学方法分析其肠道内容物, 研究主要优势种肥胖软箭虫成体和幼体的食物组成差异, 进而从食物资源利用角度探讨肥胖软箭虫成体与幼体共存策略。研究结果有助于认识热带海湾毛颚类的种群维持策略, 并且可为解析近岸生态系统物质能量的传递路径提供基础数据。
1 材料与方法
1.1 野外采样与处理
1.1.1 样品采集与现场处理
基础环境指标(水深、水温和盐度)使用多参数水质分析仪(YSI6600)测量。2014年7月, 在三亚湾海域W3(109°27′2.10″E, 18°13′0.12″N)、W4(109°25′29.28″E, 18°12′1.08″N)和W9(109°22′0.36″E, 18°12′59.88″N) 站位(图1) 浮游动物样品, 采样站位名称来自中国科学院海南热带海洋生物实验站的生态网络季度调查航次。采用浅水I型和II型浮游生物网从底到表垂直拖网采集, 拖网速度约为0.5m·s–1。浅水I型网采集的样品一份立即用中性鲁哥氏液(Lugol’s solution)固定(终浓度为2%), 遮光低温保存, 用作肥胖软箭虫成体与幼体数量比例计算与摄食分析; 另一份使用5%甲醛固定, 用作背景场浮游动物种类鉴定。因毛颚类摄食的大部分为体型较小或处于幼虫状态的桡足类, 而浅水Ⅱ型网网目为160μm, 相比浅水Ⅰ型网能更真实地反映小型桡足类或桡足类无节幼虫数量(Li et al, 2016), 故用浅水Ⅱ型网采集的桡足类用作背景场主要食物数量分析, 该网采集的样品立即用中性鲁哥氏液固定(终浓度为2%)。
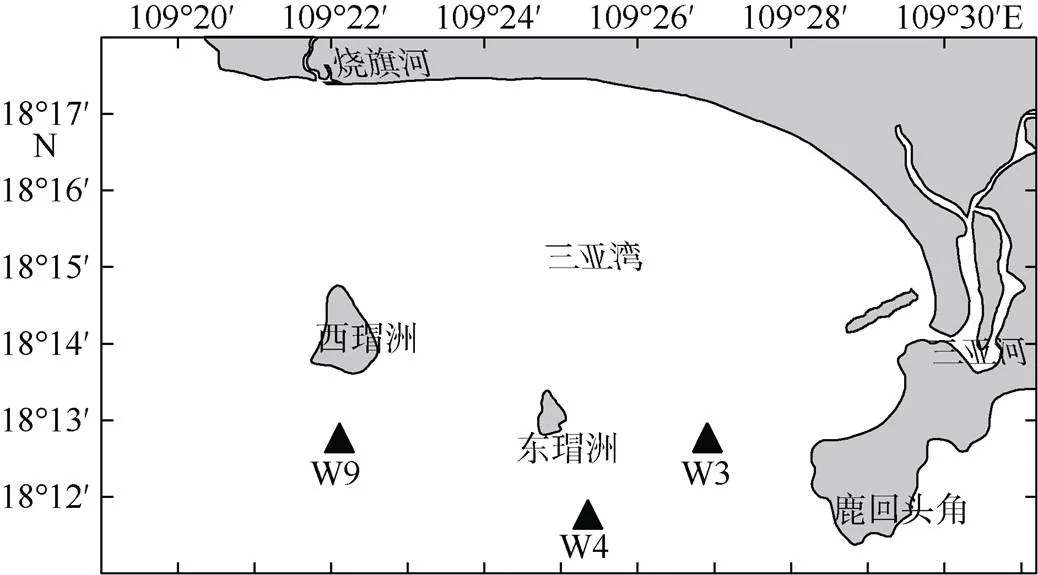
图1 采样站位图
地图来源于Surfer软件底图
Fig. 1 The sampling stations in Sanya Bay
1.1.2 浮游动物样品的室内处理
在体视镜(Lecia, S8APO)下鉴定并计数背景场浮游动物, 从各站位鲁戈氏液固定的I型网样品中分选出浮游动物样品中的肥胖软箭虫成体(Ⅳ期) 30只, 幼体(Ⅰ—Ⅲ期)100只, 并将其置于0.22μm滤膜过滤的现场海水中(加入中性鲁哥氏液, 终浓度为2%)暂存。在超净工作台中对肥胖软箭虫逐个进行冲洗并镜检, 确保肥胖软箭虫体表没有其他生物或者碎屑附着后提取DNA。
1.1.3 毛颚类总基因组DNA提取
避免拖网过程种浮游生物富集造成的网囊摄食误差, 我们将箭虫肠道前1/3食道去除之后使用玻璃匀浆器充分研磨样品(Bonnet et al, 2010)。待样品研磨完全后加入500μL细胞裂解液[0.5%SDS, 100mmol·L–1EDTA, 10mmol·L–1Tris-HCl, 200μg·mL–1Proteinase K (pH8.0)], 振荡混匀55℃水浴48h, 使用CTAB法提取基因组DNA(以下简称DNA)并将其溶解于30μL10mmol·L–1Tris-HCl(pH 8.0)中, –20℃保存。
1.1.4 PCR扩增与基因克隆
为获得毛颚类以外尽可能多的其他真核生物(潜在食物)类群的序列, 本实验使用Cheatognath diet primer set引物对提取的DNA进行PCR扩增(王崚力等), 该引物可覆盖毛颚类足够广泛的食物类群, 扩增序列包含了V2、V3、V4三个18S rDNA可变区, 长度约为780bp。25μL反应体系包含2.5μL 10× Taq buffer(2.5μmol·L–1), 2μL dNTP Mix(2.5μmol·L–1), 1μL模板DNA, 25μmol–1引物各1μL(上游引物: 5′-GAGCTAATACATGCNAARAVDCTC-3′; 下游引物: 5′-GCAAATGCTTTCGCWGTAGTYHGT-3′, 该引物可回避毛颚类自身序列, 并尽可能多地扩增其他真核生物18S rDNA序列), 0.125μL ExTaq酶(2.5U·μL–1), 17.375μL ddH2O。PCR程序为: 95℃预变性1min; 95℃变性10s, 55℃退火30s, 72℃延伸40s, 进行35个循环; 最后72℃延伸7min。使用Agarose Gel DNA Purification Kit v2.0(Takara)对PCR产物进行纯化。胶回收后对PCR产物末端加A, 完成连接、转化、培养、蓝白斑筛选等一系列基因克隆过程。随机挑选若干个阳性克隆送至英潍捷基(上海)贸易有限公司进行序列测定。
1.2 数据分析
1.2.1 序列比对和分析
检查峰图人工校正原始序列, 将去掉引物后的有效序列在NCBI (www.ncbi.nlm.nih.gov)的GenBank数据库中进行BLAST(Basic Local Alignment Search Tool), 筛选同源序列信息, 基于NCBI的分类浏览器命名法(Taxonomy Browser nomenclature), 按照相似度大于94%的最佳匹配序列推定到最低分类阶元。对检测序列与数据库中匹配的最相似序列使用MEGA6.0进行排列, 并构建邻接树(Maximum Likelihood tree, ML树)。选择Kimura 2-parameter核苷酸替代模型, 用Model Test计算Gamma值, 使用1000次重复自举值(Boostrap value), 其他参数设置均为默认值。
1.2.2 特征值计算公式
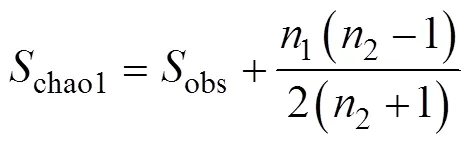
1.2.3 二分食物网
将样品在OTU水平上的出现频率数据构建二分食物网, 展示肥胖软箭虫成体与幼体在食物来源上的重叠关系, 使用R语言(Ri386 3.3.3)“bipartite”包绘制。
2 结果
2.1 环境参数与背景场浮游动物群落组成
站点W3、W4和W9水深分别为19、25和28m, 水体温度层化明显(<0.01), 表、底温差为3℃, 盐度分布均匀, 为35‰。采样站位检测到毛颚类、桡足类、软体动物、十足类、介形类、水母类、枝角类、被囊类、浮游幼虫以及鱼卵仔鱼共10类浮游动物(图2), 其中桡足类是第一大类群, 占浮游动物总丰度的52%, 且Ⅱ型浮游生物网中桡足类无节幼虫丰度达2705.84ind·m–3, 主要种类包括锥形宽水蚤()、红纺锤水蚤()、奥氏胸刺水蚤()、瘦歪水蚤()和微刺哲水蚤() (图2)。浮游动物幼虫是第二大类群, 占浮游动物总丰度的29%, 包括莹虾幼体、蛇尾长腕类幼体、多毛类幼虫、长尾类幼虫、短尾类幼虫以及无节幼虫。毛颚类丰度为9ind·m–3居第三, 占浮游动物总丰度的6%, 肥胖软箭虫是最主要的优势种, 占毛颚类丰度的63%, 其中成体与幼体丰度比例为0.48。水母类在浮游动物组成中占比约为2%, 而在Ⅱ型浮游生物网中丰度达47ind·m–3, 共检测到7种, 包括拟细浅室水母()、双生水母()、半口壮丽水母()、贝氏真囊水母()、肉质介穗水母()、双小水母()和球型侧腕水母()。另有数量较少的十足类、介形类、枝角类、被囊类以及鱼卵仔鱼(图2)。
2.2 摄食克隆序列有效性、多样性指数、组成以及营养生态位宽度和重叠度
测得种类数(OTU数)与Chao1指数结果显示, 各克隆样品测序结果基本达到平台期, 测序深度能覆盖较多的食物类群(表1)。在OTU数、香农多样性指数数值上, 幼体高于成体(表1)(OTU数:=0.145; 香农多样性指数:=0.432), 并且幼体营养生态位宽度高于成体, 分别为5.16和2.89。
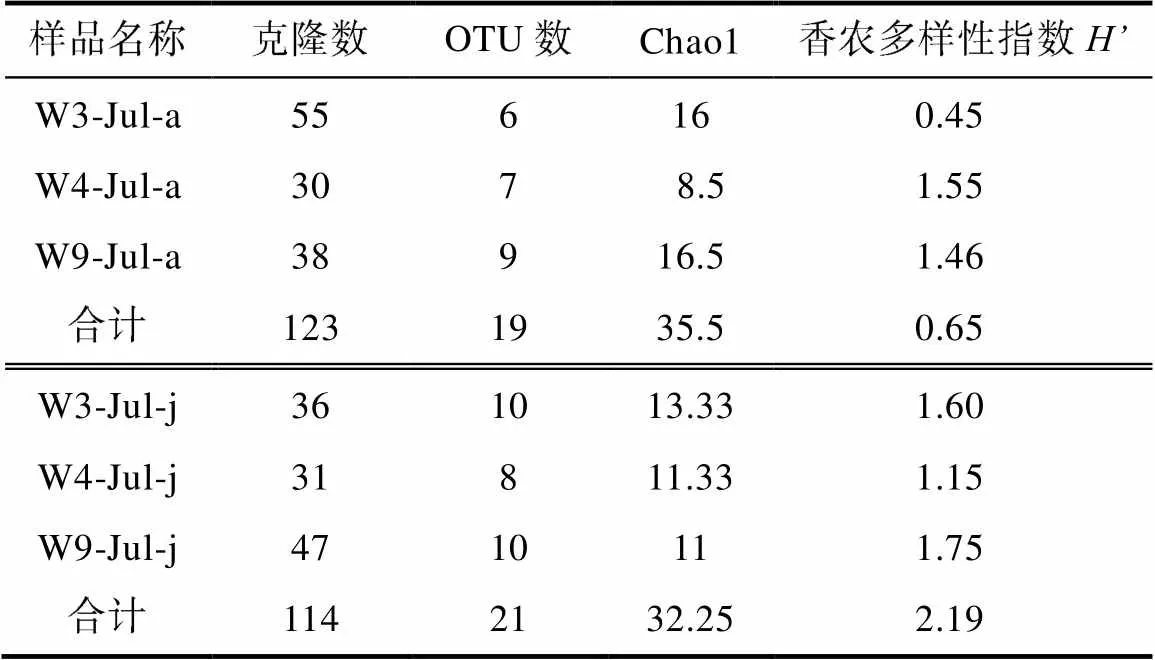
表1 肥胖软箭虫的克隆序列信息表
注: W3、W4和W9表示站位; Jul表示7月; a表示肥胖软箭虫成体, j表示肥胖软箭虫幼体; 测序样品中成体包含30只肥胖软箭虫, 幼体包含100只肥胖软箭虫。
肥胖软箭虫的摄食对象覆盖7大浮游生物类群, 包括小型水母类、桡足类、硅藻、甲藻、隐藻、多毛类和棘皮动物。其中成体摄食19种浮游生物, 幼体摄食21种浮游生物, 共同的食物类群有桡足类、小型水母类、硅藻和多毛类; 共同的食物种类有8种, 包括小型水母类中的爱神带水母()和球型侧腕水母, 桡足类中的微刺哲水蚤、锥形宽水蚤、真刺唇角水蚤()和瘦歪水蚤, 以及硅藻中的两种角毛藻(图3)。
肥胖软箭虫成体与幼体的消化道内含物DNA克隆序列在门类组成上差异显著(图3)。小型水母类是成体克隆序列中最优势的类群, 占总克隆序列组成的59%, 主要种类为爱神带水母和球型侧腕水母, 另有少量的双小水母; 而小型水母类仅占幼体总克隆序列的9%, 种类为爱神带水母和球型侧腕水母。桡足类是幼体克隆序列中最优势的类群, 占总克隆序列组成的60%, 主要种类为锥形宽水蚤、微刺哲水蚤、双斑平头水蚤()和真刺唇角水蚤; 而桡足类仅占成体总克隆序列组成的23%, 主要种类是长腹剑水蚤(sp.)和强额孔雀水蚤()。浮游植物也是二者重要的食物类群, 并以硅藻为主, 其中角毛藻()分别占到成体与幼体克隆序列组成的15%和22%, 成体克隆序列中还有少量的原甲藻()以及隐藻(Unidentified cryptophyte) (图3)。另外还检测到少量的多毛类, 幼体中种类为spec.和博金斯稚磷虫, 而在成体中则是蛇杂毛虫()。棘皮动物属仅在幼体克隆序列中检测到(图3)。
所有检测到的OTU有32个, 在肥胖软箭虫成体与幼体的6个样品中共建立起40条营养生态连接(图4)。二分食物网显示成体与幼体在主要的食物来源上重叠现象较少, 营养生态位重叠度仅为0.21, 表明成体与幼体营养生态位重叠程度处于较低水平。
3 讨论
3.1 肥胖软箭虫的食物组成
在肥胖软箭虫检测到的食物类群中, 桡足类是主要的食物来源之一, 主要种类如腹剑水蚤、锥形宽水蚤、微刺哲水蚤均为夏季三亚湾代表种类(尹健强等, 2004b; 时翔等, 2007; Li et al, 2016)。腹剑水蚤和锥形宽水蚤的无节幼虫(体长100~300μm)可被毛颚类直接摄食(李松等, 1990), 且自然环境中桡足类无节幼虫数量庞大, 因而也是经典镜检肠道食物法中最常被检测出的食物门类(Bone et al, 1991)。小型水母是另一主要的食物来源(图3)。由于18S序列片段具有相对保守性, 在种类的鉴定上不如COI序列, 因而检测到爱神带水母也可能为其他栉水母种类。早期研究也曾在毛颚类肠道中发现水母胶质碎片, 由于水母太大不能被毛颚类摄食, 普遍认为是采样过程中网底收集管里浮游生物密度过大, 毛颚类在网囊中摄食水母碎片造成的(Bone et al, 1991)。而本研究检测到的水母种类均为小型水母(如双小水母和球型侧腕水母), 且为三亚湾常见种, 其中球型侧腕水母的卵直径约300μm, 在毛颚类的摄食粒径范围内(郑慧苑等, 1990), 因此, 小型水母可能是以卵的形式被毛颚类所摄食。检测到属于浮游植物来源的序列中, 绝大部分为角毛藻, 还有少量的甲藻和隐藻。推测浮游植物可能是通过食物打包效应(如浮游植物被桡足类摄食)或黏附在被摄食生物体表而进入毛颚类肠道中(Pierrotbults, 1996), 也有学者认为毛颚类很可能是杂食性或者碎屑食性的, 可直接摄食浮游植物(Grigor et al, 2015)。底层水体中棘皮类的卵、胚胎或者幼体在受扰动时会向上悬浮(Schoener, 1967; Hendler, 1977), 因此, 本次研究中检测到的棘皮类有可能是在该过程中被肥胖软箭虫摄食的。此外, 之前的研究在毛颚类肠道中曾多次发现多毛类(Giesecke et al, 2004, 2012), 本次研究中检测到的多毛类蛇杂毛虫和博金斯稚磷虫是三亚湾常见的底栖生物, 其幼体丰度为1ind·m–3。它们都有长达超过4周的浮游期且大小适口, 其游泳运动产生的水流可被毛颚类识别(Mileikovsky, 1973; Nozais et al, 1997; Bhaud et al, 2000)。此外, 曾有研究拍摄到毛颚类利用颚刺和列齿以及释放神经毒素摄食浮蚕(多毛类)成体的照片, 因此我们认为多毛类是被毛颚类直接摄食的。

图3 肥胖软箭虫成体与幼体消化道内含物18S rDNA序列组成及其与Genbank中匹配的相似序列所构建的ML(maximum likelihood)进化树
进化树仅显示拓扑结构并以大鼠(sp.)的18S rDNA序列作为外群, 分支处基于1000次重复自举值, 不同宽度的分支代表不同的值, 进化树分支中不同符号的序列标签代表不同站点的样品; 热图值代表样品中食物种类克隆数所占比例
Fig. 3 Composition and Maximum Likelihood (ML) tree of 18S rDNA sequences retrieved from supplied food samples used inadults and juveniles diet analysis. Tree is rooted withsp. (M11188.1). Shown at nodes are bootstrap confidence values based on 1000 replicates, and branch thickness depicts the strength of bootstrap support of the corresponding node. The stations of the sample are denoted by different symbols. The thermogram value represents the proportion of food species clones in the sample
3.2 肥胖软箭虫成体与幼体的摄食分化
本研究中, 分子分析结果精确鉴定到毛颚类食物组成, 这一信息对于认识其所摄入食物种类及营养物质的来源是非常重要的(Miyamoto et al, 2019)。虽然成体与幼体摄入的食物种类数无显著差异, 但是总体上幼体肠道食物的多样性指数高于成体。而且成体与幼体食物组成存在明显差异, 成体主要的食物来源为小型水母类的卵, 幼体主要以桡足类体为食, 我们推测主要摄食的是桡足类无节幼虫, 表明幼体和成体具有摄食分化。Giesecke等(2008)研究发现肥胖软箭虫StageⅠ和StageⅡ个体主要摄食小型的小拟哲水蚤()和长腹剑水蚤(spp. ), 而成熟的个体更多选择性地摄食智利哲水蚤()。Kehayias等(2005)研究也发现幼体毛颚类(StageⅠ)摄食较多的枝角类, 而成体更多地摄食其他种类的生物如毛颚类、甲壳类幼体, 水螅水母以及莹虾。
通常认为毛颚类的摄食选择性主要与个体成熟程度有关, 随生长发育, 毛颚类的摄食器官逐渐成熟(如头宽、颚刺和列齿增长), 因而可捕获的食物平均体宽、体长增加(Alvarez-Cadena, 1993; Marazzo et al, 1997)。Pearre(1980)研究发现, 肥胖软箭虫头宽与体长的比例为0.0758, 且肥胖软箭虫头宽()与食物大小()存在以下线性回归关系:=0.3330.274, 因此毛颚类会随生长发育会出现食性转变。这应该是肥胖软箭虫成体与幼体之间有明显摄食分化的主要原因。本研究在幼体中检测到的主要桡足类种类无节幼虫体长小于在成体中检测到主要小型水母的卵直径。此外, 毛颚类成体、幼体与食物之间的空间分布差异可能也是造成其摄食分化的原因之一。毛颚类成体因具有较强的游泳能力, 且生殖结构更易被捕食者看见, 白天为躲避捕食者或因在更冷的水体中有保存能量的优势通常分布在下层水体, 而幼体毛颚类通常分布在表层(Kehayias et al, 2008)。与此同时, 在垂直方向上食物资源分布也有不同, Lie等(2012)的研究结果验证了本观点。本研究结果也支持该观点, 夏季三亚湾浮游动物群落结构具有明显的垂直分布模式, 肥胖软箭虫成体与幼体的分布模式与上述研究一致, 且桡足类无节幼虫分布于中上水层(尹健强等, 2004a), 而小型水母的卵更多地分布在底层水体(郑慧苑等, 1990)。
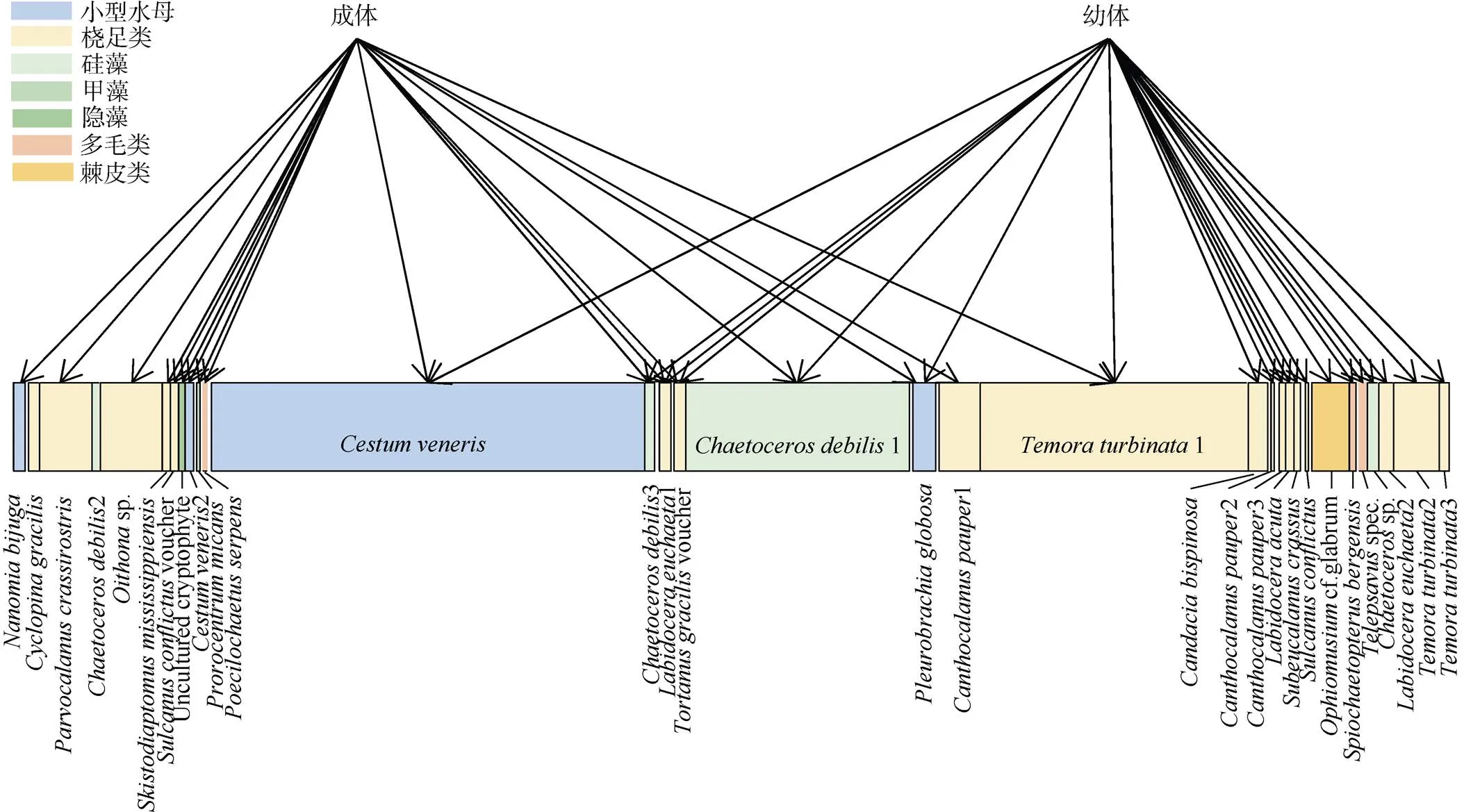
图4 肥胖软箭虫成体与幼体食物来源的二分食物网
上层表示不同生长阶段的肥胖软箭虫, 下层代表肥胖软箭虫在OTU水平上的食物来源, 上层与下层的每个连接表示最少一次检测到的摄食事件, 连接的宽度表示检测到的频数, 宽度越宽表示频数越高
Fig. 4 Bipartite networks depicting the main dietary complementary and overlaps of chaetognath adults and juveniles. The upper layer representsat different growth stages, and the lower layer represents the food source ofat OTU level. Each connection between the upper layer and lower layer represents at least one detected feeding event. The width of the lower layer represents the frequency detected, and wider width represents higher frequency
从“能量”角度来看, 研究发现不同体长肥胖软箭虫的物质含量(C、N含量和C: N百分比)没有显著差异(Bohata et al, 2013), 但通常早期毛颚类的生长速率高, 随着发育逐渐降低直到为0(Nagasawa, 1984), 这些研究结果暗示幼体较成体而言, 为了满足快速生长可能需要摄入更多的能量。研究也发现近岸海湾肥胖软箭虫幼体的日摄食率高于成体(Lie et al, 2012)。从“营养”角度, 水母类含水量(~95%)通常高于桡足类(~88%), 二者粗蛋白质含量(湿重的7%~9%)差异较小, 但桡足类粗脂肪(湿重的~1%)及多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)含量(湿重的~60%)高于水母类(粗脂肪为湿重的~0.7%, PUFA为湿重的~25%), 且无节幼虫多不饱和脂肪酸含量(~60%)高于小型水母类(~25%)(蒋建斌等, 2012; 彭瑞冰等, 2014; Liu et al, 2015), 因此桡足类较小型水母类具有更高的营养价值, 可能更利于幼体的快速生长。此外, 研究显示水母各形态幼体的摄食目标包括小型桡足类、桡足类幼体, 包括本文中的腹剑水蚤和宽水蚤(Pagès et al, 1996; 刘春洋等, 2011; 孙婷婷, 2018), 因而成体摄食水母卵可进一步减少其潜在竞争者, 从而更利于幼体获取食物。Giesecke等(2008)提出了毛颚类与食物相互作用的概念模型: 成体毛颚类为新产生的后代创造喜爱的食物环境, 使得幼体能更多地存活, 从而保证其种群能在主要生殖季(秋季)有足够的成体数量。我们推测三亚湾肥胖软箭虫的摄食策略与上述一致, 幼体更多地摄食营养价值相对较高的桡足类(幼体), 而成体主要选择仅能维持代谢所需的水母, 一方面可有利于幼体获取更多食物, 减少同类竞争降低死亡率, 维持种群数量, 实现二者在同海域的共存; 另一方面, 由于毛颚类丰度较高, 而且是重要的肉食性浮游动物, 因此成体箭虫可能对水母有一定控制作用, 且成体与幼体的选择性摄食也可能对浮游动物的群落结构有显著影响(Lie et al, 2012)。由于本研究方法的限制, 成体与幼体在“能量”与“营养”之间选择食物的平衡有待通过室内试验进一步验证。
4 结论
三亚湾夏季肥胖软箭虫成体与幼体在食物组成上分化明显, 食物重叠度低。小型水母类是成体主要的优势食物类群, 而桡足类是幼体主要的优势食物类群, 这种食物分配策略可能在一定程度上为幼体提供更好的食物资源, 减少种内竞争, 实现与成体在同海域的共存, 维持种群繁衍。
蒋建斌, 陆建学, 2012. 海水桡足类的营养分析及在鱼、虾蟹幼体培育中的应用[J]. 水产养殖, 33(9): 1–3.
柯志新, 黄良民, 谭烨辉, 等, 2011. 三亚珊瑚礁分布海区浮游生物的群落结构[J]. 生物多样性, 19(6): 696–701. KE ZHIXIN, HUANG LINAGMIN, TAN YEHUI, et al, 2011. Plankton community structure and diversity in coral reefs area of Sanya Bay, Hainan Province, China[J]. Biodiversity Science, 19(6): 696–701 (in Chinese with English abstract).
李松, 方金钏, 1990. 中国海洋浮游桡足类幼体[M]. 北京:海洋出版社.
刘春洋, 王彬, 李轶平, 等, 2011. 海蜇不同生长阶段的摄食方式和摄食习性[J]. 水产科学, 30(8): 491–494. LIU CHUNYANG, WANG BIN, LI YIPING, et al, 2011. The feeding methods and feeding habit of jellyfishat different developmental phases[J]. Fisheries Science, 30(8): 491–494 (in Chinese with English abstract).
彭瑞冰, 蒋霞敏, 乐可鑫, 等, 2014. 5种饵料动物的营养成分分析及评价[J]. 水产学报, 38(2): 257–264. PENG RUIBING, JIANG XIAMIN, LE KEXIN, et al, 2014. Nutritive composition and evaluation of five food animals[J]. Journal of Fisheries of China, 38(2): 257–264 (in Chinese with English abstract).
时翔, 王汉奎, 谭烨辉, 等, 2007. 三亚湾浮游动物数量分布及群落特征的季节变化[J]. 海洋通报, 26(4): 42–49. SHI XIANG, WANG HANKUI, TAN YEHUI, et al, 2007. Seasonal variation of zooplankton community structure and species composition in the Sanya Bay[J]. Marine Science Bulletin, 26(4): 42–49 (in Chinese with English abstract).
孙婷婷, 2018. 基于高通量测序技术的两种水母现场食物研究[D]. 烟台: 烟台大学. SUN TINGTING. 2018. Determining the diet of two jellyfish species using high-throughput DNA sequencing techniques[D]. Yantai: Yantai University (in Chinese with English abstract).
王崚力, 郭明兰, 胡思敏, 等, 2018-08-10. 一种毛颚类现场食谱检测的分子方法: 中国, CN201810114142.9[P]. WANG LINGLI, GUO MINGLAN, HU SIMIN, et al, 2018-08-10.Molecular method for on-site recipe detection of chaetognatha: CN, CN201810114142.9[P] (in Chinese).
尹健强, 张谷贤, 黄良民, 等, 2004a. 三亚湾浮游动物的昼夜垂直移动[J]. 热带海洋学报, 23(5): 25–33. YIN JIANQIANG, ZHANG GUXIAN, HUANG LINAGMIN, et al, 2004a. Diel vertical migration of zooplankton in Sanya Bay, Hainan Province, China[J]. Journal of Tropical Oceanography, 23(5): 25–33 (in Chinese with English abstract).
尹健强, 张谷贤, 谭烨辉, 等, 2004b. 三亚湾浮游动物的种类组成与数量分布[J]. 热带海洋学报, 23(5): 1–9. YIN JIANQIANG, ZHANG GUXIAN, TAN YEHUI, et al, 2004b. Species composition and quantitative distribution of zooplankton in Sanya Bay, Hainan Province, China[J]. Journal of Tropical Oceanography, 23(5): 1–9 (in Chinese with English abstract).
郑慧苑, 丘书院, 1990. 厦门港球型侧腕水母(Moser)的生殖[J]. 动物学报, 36(4): 393–397. ZHENG HUIYUAN, QIU SHUYUAN. 1990. Reproduction ofMoser in Xiamen Bay[J]. Acta Zoologica Sinica, 36(4): 393–397 (in Chinese with English abstract).
ALVAREZ-CADENA J N, 1993. Feeding of the ChaetognathVerrill[J]. Estuarine, Coastal and Shelf Science, 36(2): 195–206.
AMANO K, ABE Y, MATSUNO K, et al, 2019. Yearly comparison of the planktonic chaetognath community in the Chukchi Sea in the summers of 1991 and 2007[J]. Polar Science, 19: 112–119.
BHAUD M, FERNANDEZ-ALAMO M A, 2000. Planktonic larvae ofin the Gulf of California: New evidence that the geographic distribution of species with a long planktonic larval life is relatively restricted[J]. Ophelia, 52(1): 65–76.
BOHATA K, KOPPELMANN R, 2013. Chaetognatha of the Namibian upwelling region: taxonomy, distribution and trophic position[J]. PLoS One, 8(1): e53839.
BONE Q, KAPP H, PIERROT-BULTS A C, 1991. The biology of chaetognaths[M]. New York: Oxford University Press.
BONNET D, LINDEQUE P K, HARRIS R P, 2010.predation onin the English Channel[J]. Journal of Plankton Research, 32(5): 725–737.
CHAO ANNE, 1984. Nonparametric estimation of the number of classes in a population[J]. Scandinavian Journal of Statistics, 11(4): 265–270.
GIESECKE R, GONZÁLEZ H E, 2004. Feeding ofand vertical distribution of chaetognaths in relation to low oxygen concentrations[J]. Journal of Plankton Research, 26(4): 475–486.
GIESECKE R, GONZÁLEZ H E, 2008. Reproduction and feeding ofin the Humboldt Current system off Chile[J]. ICES Journal of Marine Science, 65(3): 361–370.
GIESECKE R, GONZÁLEZ H E, 2012. Distribution and feeding of chaetognaths in the epipelagic zone of the Lazarev Sea (Antarctica) during austral summer[J]. Polar Biology, 35(5): 689–703.
GOSWAMI S C, 1982. Occurrence of swarms of(Chaetognatha) and(Ctenophora) in the coastal waters of Goa[J]. Mahasagar-Bulletin of National Institute of Oceanography, 1982, 15(3): 163–166.
GRIGOR J J, MARAIS A E, FALK-PETERSEN S, et al, 2015. Polar night ecology of a pelagic predator, the chaetognath[J]. Polar Biology, 38(1): 87–98.
HENDLER G, 1977. Development of(Verrill) (Echinodermata: Ophiuroidea): I. Larval biology[J]. The Biological Bulletin, 152(1): 51–63.
HU SIMIN, GUO ZHILING, LI TAO, et al, 2015. Molecular analysis ofdiets of coral reef copepods: evidence of terrestrial plant detritus as a food source in Sanya Bay, China[J]. Journal of Plankton Research, 37(2): 363–371.
KEHAYIAS G, LYKAKIS J, FRAGOPOULU N, 1996. The diets of the chaetognaths,.and.at different seasons in eastern Mediterranean coastal waters[J]. ICES Journal of Marine Science, 53(5): 837–846.
KEHAYIAS G, MICHALOUDI E, KOUTRAKIS E, 2005. Feeding and predation impact of chaetognaths in the north Aegean Sea (Strymonikos and Ierissos Gulfs)[J]. Journal of the Marine Biological Association of the United Kingdom, 85(6): 1525–1532.
KEHAYIAS G, NTAKOU E, 2008. Abundance, vertical distribution and feeding of chaetognaths in the upper 50 m layer of the eastern Aegean Sea[J]. Journal of Natural History, 42(5–8): 633–648.
KING R A, READ D S, TRAUGOTT M, et al, 2008. Molecular analysis of predation: A review of best practice for DNA-based approaches[J]. Molecular Ecology, 17(4): 947–963.
LEVINS R, 1968. Evolution in changing environments: some theoretical explorations[M]. New Jersey: Princeton University Press.
LI K Z, WU X J, TAN Y H, et al, 2016. Spatial and temporal variability of copepod assemblages in Sanya Bay, northern South China Sea[J]. Regional Studies in Marine Science, 7: 168–176.
LIE A A Y, TSE P, WONG C K, 2012. Diel vertical migration and feeding of three species of chaetognaths (,and) in two shallow, subtropical bays in Hong Kong[J]. Journal of Plankton Research, 34(8): 670–684.
LIN XIANZHI, HU SIMIN, LIU SHENG, et al, 2018. Unexpected prey of juvenile spotted scat () near a wharf: the prevalence of fouling organisms in stomach contents[J]. Ecology and Evolution, 8: 8547-8554.
LIU CHUNSHENG, CHEN SIQING, ZHUANG ZHIMENG, et al, 2015. Potential of utilizing jellyfish as food in culturingjuveniles[J]. Hydrobiologia, 754(1): 189–200.
MARAZZO A, MACHADO C F, NOGUEIRA C S R, 1997. Notes on feeding of chaetognatha in Guanabara Bay, Brazil[J]. Journal of Plankton Research, 19(7): 819–828.
MILEIKOVSKY S A, 1973. Speed of active movement of pelagic larvae of marine bottom invertebrates and their ability to regulate their vertical position[J]. Marine Biology, 23(1): 11–17.
MIYAMOTO H, VIJAI D, OKAZAKI Y, et al, 2019. Feeding ecology of chaetognathin the Kuroshio Region, western North Pacific[M] // NAGAI T, SAITO H, SUZUKI K, et al. Kuroshio current: physical, biogeochemical, and ecosystem dynamics. Washington: AGU-Wiley: 257–272.
NAGASAWA S, 1984. Laboratory feeding and egg production in the chaetognathTokioka[J]. Journal of Experimental Marine Biology and Ecology, 76(1): 51–65.
NOZAIS C, DUCHÊNE J C, BHAUD M, 1997. Control of position in the water column by the larvae of, (Polychaeta): the importance of mucus secretion[J]. Journal of Experimental Marine Biology and Ecology, 210(1): 91–106.
ØRESLAND V, 2000. Diel feeding of the chaetognathin the Zanzibar Channel, western Indian Ocean[J]. Marine Ecology Progress Series, 193: 117–123.
PAGÈS F, GONZÁLEZ H E, GONZÁLEZ S R, 1996. Diet of the gelatinous zooplankton in Hardangerfjord (Norway) and potential predatory impact by(Trachymedusae)[J]. Marine Ecology Progress Series, 139: 69–77.
PEARRE S JR, 1980. Feeding by Chaetognatha: The relation of prey size to predator size in several species[J]. Marine Ecology Progress Series, 3: 125–134.
PIERROT-BULTS A C, 1996. Chaetognatha[M] // GASCA R, SUAREZ E. Introduccion al Estudio del Zooplancton marino. Chetumal: El Colegio de la Frontera Sur (ECOSUR): 529–596.
SCHOENER A, 1967. Post-larval development of five deep-sea ophiuroids[J]. Deep Sea Research and Oceanographic Abstracts, 14(6): 645–660.
YOON H, KO A R, KANG J H, et al, 2016. Diet of chaetognathsand.in the Yellow Sea inferred from gut content and fatty acid analyses[J]. Ocean and Polar Research, 38(1): 35–46.
feeding differences between adults and juveniles of chaetognath () in Sanya Bay
WANG Lingli1,2,3, HU Simin1,3, GUO Minglan1,3, LI Tao1,3,4, WANG Youjun1,2, HUANG Hui1,3,4, LIU Sheng1,3
1. Key Laboratory of Tropical Marine Bio-resources and Ecology, Guangdong Provincial Key Laboratory of Applied Marine Biology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Innovation Academy of South China Sea Ecology and Environmental Engineering, Chinese Academy of Sciences Guangzhou 510301, China; 4. Tropical Marine Biological Research Statin in Hainan, Chinese Academy of Sciences, Sanya 572000, China
Chaetognatha is often the most abundant carnivorous zooplankton, and a vital food source for pelagic fish in marine ecosystem. However, their survival strategy of maintaining population structure in tropical coastal waters remains unclear. In this study, molecular method was applied to compare the field dietof juveniles and adults of dominant chaetognath speciesin Sanya Bay. We discuss the nutritional strategies of chaetognaths maintainingsubstantial population structure from the perspective of resource utilization. The results show that there were 21 and 19 species fed by juveniles and adults, respectively. Copepods, small jellyfish, diatoms, and polychaets were common food groups of both juveniles and adults. Food preferences differed significantly between the juveniles and adults. Small jellyfish made up 59% of the whole diet composition in adults, while copepods became the most abundant food items (60%) in juveniles. The trophic niche of juveniles (5.16) was higher than that of adults (2.89), and trophic overlap between them was low (0.21), suggesting that chaetognaths have obvious dietary shifts during different growth stages. These results reveal that even though adults and juveniles coexist in the same region with large numbers, they can reduce food competition by feeding differentiation. This feeding strategy is of great significance for maxillary species to ensure juvenile survival and maintain substantial population structure.
chaetognaths; adults and juveniles; feeding differentiation; nutrition strategy; population structure
Q179
A
1009-5470(2020)03-0057-09
10.11978/2019092
http://www.jto.ac.cn
2019-09-20;
2019-12-06。
林强编辑
中国科学院战略性先导科技专项(XDA13020100); 国家重点研发计划资助(2016YFC0502800, 2017YFC0506302); 广东省省级科技计划项目(2017B0303014052); 国家自然科学基金项目(41806188) ; 中国科学院南海生态环境工程创新研究院自主部署项目(ISEE2018PY01)
王崚力(1992—), 女, 四川省乐山市人, 博士研究生, 主要从事浮游动物摄食生态学研究。E-mail: wanglingli@scsio.ac.cn
刘胜, E-mail: shliu@scsio.ac.cn; 胡思敏, E-mail: husimin@scsio.ac.cn
2019-09-20;
2019-12-06.
Editor: LIN Qiang
The Strategic Priority Research Program of the Chinese Academy of Sciences (XDA13020100); National Key Research and Development Project of China (2016YFC0502800, 2017YFC0506302); Science and Technology Planning Project of Guangdong Province, China (2017B0303014052); National Natural Science Foundation of China (41806188); Innovation Academy of South China Sea Ecology and Environmental Engineering, Chinese Academy of Sciences (No.ISEE2018PY01)
LIU Sheng. E-mail:shliu@scsio.ac.cn; HU Simin. E-mail: husimin@scsio.ac.cn
——以“不同咖啡因饮料对水蚤心率的影响”为例

