共沉淀反应时间对LiNi0.5Co0.2Mn0.3O2 正极材料形貌和电化学性能的影响①
夏凌峰, 李灵均, 杨慧平, 赵子祥
(长沙理工大学 材料科学与工程学院,湖南 长沙410000)
锂离子电池LiNi0.5Co0.2Mn0.3O2正极材料具有高容量、低成本的优点,被认为是最有发展前景的正极材料之一[1-3]。
目前,该材料的制备方法主要有固相法、溶胶-凝胶法、共沉淀法等[4-6]。 其中,共沉淀法因易于控制材料形貌及粒度、有利于获得高体积能量密度的球形二次颗粒,成为工业化常用的制备方法。 在共沉淀法制备前驱体过程中,pH 值、反应温度和反应时间等都会影响材料的合成[7-8]。 相比于其它条件,反应时间影响着材料二次颗粒粒径大小,是决定材料循环和倍率性能的重要因素。 在前人研究基础上,本文采用共沉淀法制备球形Ni0.5Co0.2Mn0.3(OH)2前驱体,并合成了LiNi0.5Co0.2Mn0.3O2正极材料,重点研究反应时间对前驱体和正极材料结构、形貌以及电化学性能的影响。
1 实 验
1.1 实验原料及方法
采用共沉淀法制备Ni0.5Co0.2Mn0.3(OH)2前驱体。将摩尔比为5 ∶2 ∶3的NiSO4·6H2O(化学纯)、CoSO4·7H2O(化学纯)、MnSO4·H2O(化学纯)溶于去离子水中配成总金属浓度为2 mol/L 的硫酸盐溶液。 同样用去离子水配制2 mol/L 的NaOH(化学纯)溶液,同时将稀释后的氨水溶液倒入氨水罐中。 通过蠕动泵将上述溶液并流泵入反应釜中,反应过程中通入N2作为保护气,控制反应体系温度55 ℃,pH 值11,控制反应过程中的反应时间(12 h,16 h,20 h,24 h)。 反应结束后将溶液陈化4 h,经过3 ~4 次抽滤洗涤后在110 ℃烘箱中烘干。
采用固相法合成LiNi0.5Co0.2Mn0.3O2正 极 材 料。将上述Ni0.5Co0.2Mn0.3(OH)2前驱体与Li2CO3(化学纯)混合均匀(Ni0.5Co0.2Mn0.3(OH)2/Li2CO3摩尔比为2 ∶1.05),然后放入马弗炉中480 ℃预烧5 h,再880 ℃煅烧12 h,待自然冷却至室温后将样品取出。
1.2 材料的表征及电化学性能测试
通过X 射线衍射(XRD, Bruker D8 Advance,德国)对合成材料进行物相结构分析,使用扫描电子显微镜(SEM, Hitachi S530,日本)对样品进行材料微观形貌观测。
将正极材料、乙炔黑、PVDF 按8 ∶1 ∶1制备成正极片,金属锂片作为负极,隔膜型号为Celgard 2400,1 mol/L LiPF6与碳酸甲乙酯(EMC)、碳酸二甲酯(DMC)和碳酸乙烯酯(EC)的混合溶液作为电解液,其体积比为1 ∶1 ∶1,在充满氩气的手套箱中组装扣式电池。 在30 ℃、2.7~4.6 V 电压区间内采用充放电测试仪(BTS 400,深圳新威)进行电池电化学性能测试。
2 实验结果及讨论
2.1 Ni0.5Co0.2Mn0.3(OH)2 前驱体表征
2.1.1 XRD 物相表征
不同反应时间合成的Ni0.5Co0.2Mn0.3(OH)2前驱体的XRD 图谱见图1。 图中没有出现杂峰,4 组样品的XRD 曲线都对应着β-Ni(OH)2,且样品的衍射峰峰型都很尖锐,表明通过本方法成功地合成了不同反应时间的Ni0.5Co0.2Mn0.3(OH)2前驱体。
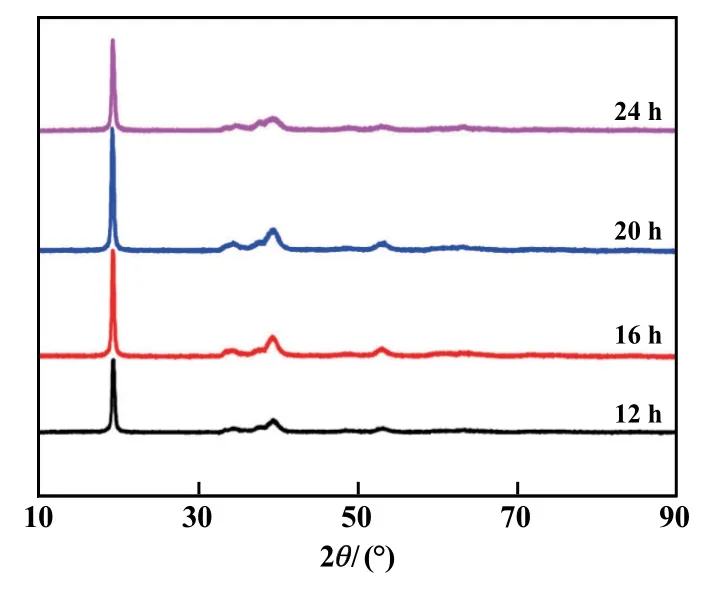
图1 Ni0.5Co0.2Mn0.3(OH)2 前驱体XRD 图谱
2.1.2 SEM 形貌表征
图2 为不同反应时间制备的Ni0.5Co0.2Mn0.3(OH)2前驱体SEM 图。 由图2 可知,所有样品二次颗粒呈类球状,随着反应时间增加,前驱体的二次颗粒粒径逐渐增大。 前驱体在制备过程中晶体的成核及长大相互作用。 在反应过程中反应时间越长,对应的反应速率越小,因此反应物中的过饱和度也越低。 根据晶体成核理论[9],过饱和度低,反应物中的晶体成核速率小于生长速率,因而反应结束后得到粒径较大的颗粒。

图2 Ni0.5Co0.2Mn0.3(OH)2 前驱体SEM 图
2.2 LiNi0.5Co0.2Mn0.3O2 正极材料表征
2.2.1 XRD 物相表征
图3 为不同反应时间制备的LiNi0.5Co0.2Mn0.3O2样品的XRD 图谱。 经过检索比对,所有样品均为α-NaFeO2结构,属于R-3 空间群并且没有出现杂峰。(006)/(012)和(018)/(110)存在明显的分裂峰,说明制备的样品具有良好的层状结构[10-14]。 样品的晶格参数和c/a 如表1 所示。 由表1 可知,随着反应时间增加,样品晶格参数均发生变化,反应时间16 h 时样品的c/a 值最大,说明样品具有较好的层状结构。
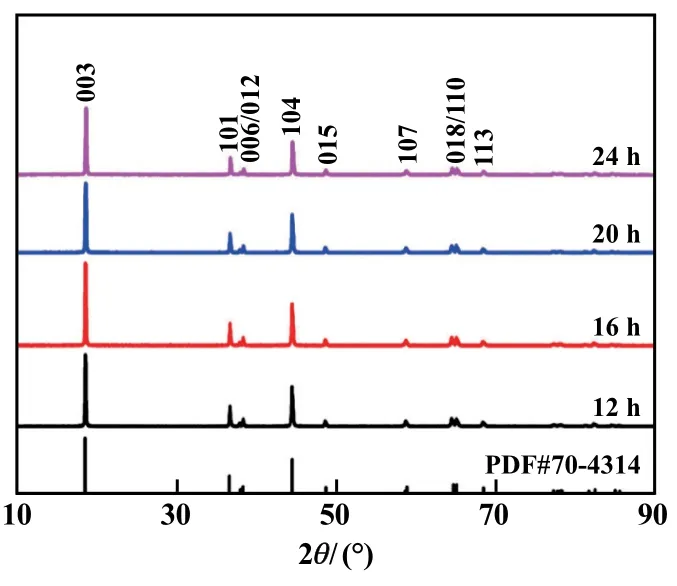
图3 LiNi0.5Co0.2Mn0.3O2 正极材料XRD 图
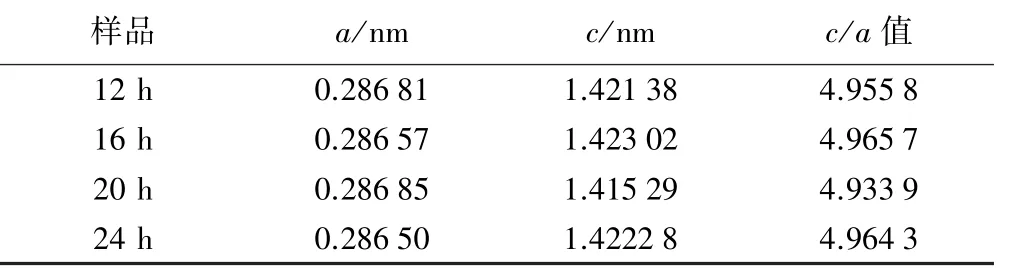
表1 LiNi0.5Co0.2Mn0.3O2 正极材料晶胞参数
2.2.2 SEM 形貌表征
图4 为不同反应时间制备的LiNi0.5Co0.2Mn0.3O2正极材料的SEM 图。 由图4 可知,所有样品都是由一次颗粒团聚而成的类球形二次颗粒,反应时间12 h 时样品二次颗粒的平均粒径约4 μm;随着反应时间增加,二次颗粒逐渐长大,24 h 样品二次颗粒的平均粒径约6 μm。

图4 LiNi0.5Co0.2Mn0.3O2 正极材料SEM 图
2.2.3 电化学性能表征
图5 为不同反应时间所得样品在0.1C 倍率时的初始充放电曲线。 由图5 可知,反应时间12 h 样品的初始放电比容量为213.1 mAh/g,库伦效率为87.88%;16 h、20 h 和24 h 样品的初始放电比容量分别为210.3、214.6 和211.9 mAh/g,库伦效率分别为88.08%、88.51%和88.34%,不同反应时间所得到的样品首次放电容量及库伦效率差别不是很大。
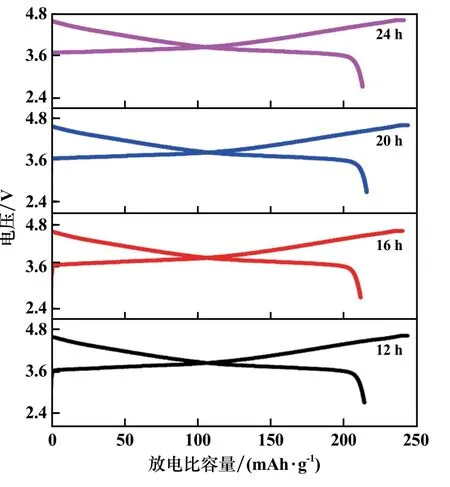
图5 LiNi0.5Co0.2Mn0.3O2 正极材料初始充放电比容量曲线
图6 为LiNi0.5Co0.2Mn0.3O2正极材料 在 不同 焙率下的循环曲线。 由图6 可知,在1C 倍率下,经过180圈循环后,反应时间12 h 样品的放电比容量从188.6 mAh/g 衰减到138.9 mAh/g,容量保持率为73.7%。16 h、20 h 和24 h 样品的容量保持率分别为75.3%、72.0%和73.1%。 在5C 倍率下,经过300 圈循环后,12 h、16 h、20 h 和24 h 样品的容量保持率分别为49.6%、56.0%、32.3%和40.9%。 16 h 样品展现出最佳的循环性能。
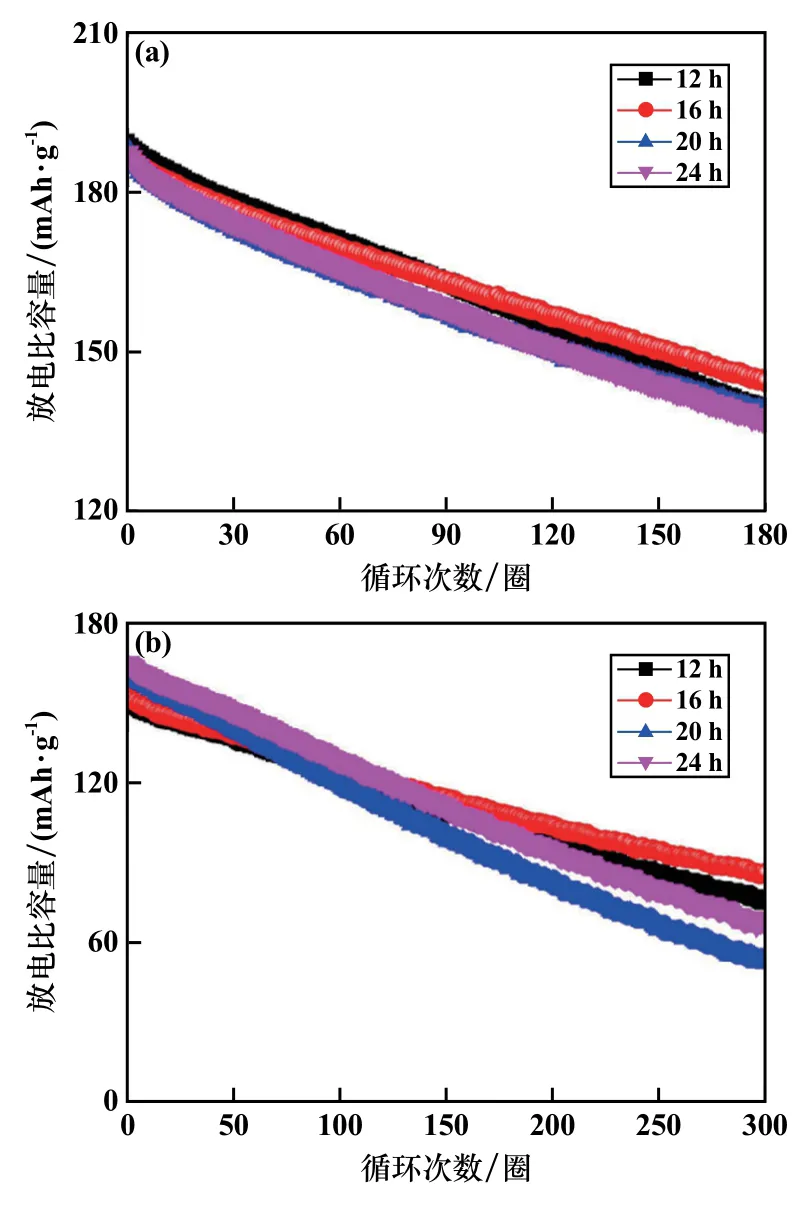
图6 LiNi0.5Co0.2Mn0.3O2 正极材料循环曲线
图7 为样品在不同电流密度下的倍率性能。 由图7 可知,不同反应时间的样品在大倍率电流密度下差别较大,其中反应时间16 h 样品在10C 倍率下具有最高的放电比容量,可达122.9 mAh/g。
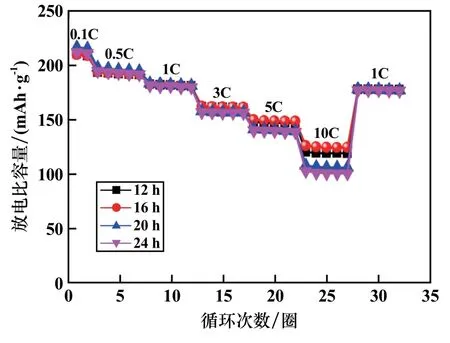
图7 LiNi0.5Co0.2Mn0.3O2 正极材料倍率曲线
反应时间过长或过短都不利于材料的倍率性能以及材料在大倍率(5C)下的循环性能。 这主要是因为反应时间较长时,获得的材料粒径较大,在充放电过程中不利于锂离子的脱嵌;而反应时间较短时,所合成材料二次颗粒的粒径较小,比表面积较大,使得材料在高压循环过程中易于与电解液发生副反应,恶化材料的循环性能。 因此,选择适当的反应时间对材料的电化学性能尤为重要。
3 结 论
采用共沉淀法制备Ni0.5Co0.2Mn0.3(OH)2前驱体,并合成了LiNi0.5Co0.2Mn0.3O2正极材料。 其中,16 h 反应时间合成的LiNi0.5Co0.2Mn0.3O2正极材料具有最佳的电化学性能,在2.7~4.6 V ,0.1C 下首次放电比容量为210.3 mAh/g,1C 电流密度下经过180 圈循环,容量保持率可达75.3%。 优异的电化学性能可能归因于以下原因:
1) 与24 h 样品相比,反应时间16 h 可获得相对更小粒径的二次颗粒,因而缩短了锂离子的扩散路径,这有助于增强材料的倍率性能。
2) 与12 h 样品相比,16 h 样品的二次颗粒粒径较大,材料比表面积更小,材料与电解液的副反应也更少,从而增强了材料在高电压、大倍率下的循环性能。

