氯霉素对铁还原菌/针铁矿异化还原的影响机制
李晓玲 史 柯 林欣雨 董华平
(绍兴文理学院 化学化工学院,浙江 绍兴 312000)
抗生素具有很强的杀菌和抑菌作用,主要用于预防和治疗人和动物经微生物感染引起的疾病,以及用作牲畜生长的食物添加剂[1].由于抗生素在生物体内不易代谢,大部分母体化合物随着人和动物的粪便排到环境中[2-3].通过土壤吸附、雨水冲刷和地表水渗漏等自然过程,使土壤、地下水和沉积物等厌氧环境中抗生素的含量不断累积和暴露,导致抗性基因的大量扩增和传播,严重威胁人类健康和生态平衡[4].目前,环境中抗生素的降解去除主要采用芬顿[5]、光芬顿[6]、UV/H2O2[7]和零价铁氧化还原[8]等方法,通过产生HO·和SO4·等活性组分将抗生素分解成小分子物质.但是,对于抗生素在土壤、地下水和沉积物等厌氧环境中的迁移转化,以及抗生素对微生物的抑菌性能的演变过程方面,目前研究甚少.
地下水、土壤、沉积物等厌氧环境中,存在大量丰富的含铁矿物.这些矿物作为胞外电子受体,接受来自铁还原菌的胞外电子,供铁还原菌呼吸生长,同时矿物表面Fe(III)被异化还原成Fe(II)[9-10].这些Fe(II)离子能够吸附在矿物表面产生矿物结合Fe(II),也能够与其他元素相互作用产生新的次生矿物,如磁铁矿、菱铁矿等[11].通过矿物结合Fe(II)和新形成的次生矿物的还原作用,能够降解环境中的硝基苯类化合物、氯代烷烃等有机污染物[12-13],以及转化环境中的Cr(VI)、U(VI)和Se(IV)/(VI)等重金属离子[11].因此,异化铁还原过程参与了地球上含铁矿物及其他重金属的迁移转化,影响了碳、氮、硫、氧等元素的地球化学循环.
研究表明,厌氧环境中共存的腐殖质[14-15]、金属离子[16]以及小分子有机酸[17]等组分,通过电子传递、配合等作用,影响铁还原菌/铁矿物的异化还原过程.然而,抗生素是否对铁还原菌/含铁矿物异化还原过程产生影响,异化铁还原是否同时参与了抗生素的降解过程,亟待我们研究阐明.
为了更好地认识抗生素在异化铁还原体系等厌氧环境中的迁移转化,以及抗生素对异化铁还原体系的影响,本文以环境中广泛存在的针铁矿(Goethite)为模式铁矿物,脱色希瓦氏菌S12为模式铁还原菌,氯霉素(CAP)作为模式抗生素,主要考察氯霉素对S12异化还原针铁矿的影响,以及异化铁还原对氯霉素抑菌作用的影响,采用XRD、SEM-EDS分析氯霉素存在下S12/针铁矿异化还原产生次生矿物的类型,研究S12/针铁矿体系还原降解氯霉素的主要活性组分,从而阐明氯霉素对S12/针铁矿异化还原的作用机制.
1 实验
1.1 材料与试剂
所用试剂均为分析纯,氯霉素和针铁矿购自Sigma,铁还原菌为脱色希瓦氏菌(ShewanelladecolorationisS12),购自海洋微生物菌种保藏管理中心.氯化钠购自浙江中星化工试剂有限公司;蛋白胨、酵母提取物、琼脂粉购自生工生物工程(上海)股份有限公司;十二水合磷酸氢二钠、硫酸铵、无水硫酸镁、N-2-羟乙基哌嗪-N’-2-乙磺酸(HEPES)、磷酸二氢钾、DL-乳酸钠溶液购自Aladdin,所用水均为去离子水.
LB培养基和厌氧培养基配制方法如下:
LB培养基:称量蛋白胨1 g,酵母提取物0.5 g,氯化钠1 g至100 mL去离子水中,搅拌至全部溶解,用1 mol/L NaOH调pH至7.0,平均分装为4份并密封, 高温高压灭菌(121 ℃, 20 min),冷却至室温,待用.
厌氧培养基:分别称量十二水合磷酸氢二钠2 g,磷酸二氢钾0.5 g,硫酸铵1 g,无水硫酸镁0.2 g,HEPES 2.38 g至950 mL超纯水中,搅拌使全部溶解,用1 mol/L NaOH调pH至7.0,定容至1000 mL.高温高压灭菌(121 ℃,20 min),冷却至室温,待用.
1.2 微生物培养
在无菌操作台上将S12接种至无菌LB培养基中, 置控温振荡器中(150 rpm, 30 ℃)培养12 h使生长至对数期.将此生长至对数期的S12接种至无菌LB培养基中再次培养12 h后,冷冻离心(6000 rpm,10 min,4 ℃)后弃去上清液,用厌氧培养基洗涤两次,以此厌氧培养基作为空白对照,在紫外分光光度计波长λ=600 nm处调整其光吸收值(OD)为1.5,备用.
1.3 反应条件
以针铁矿+氯霉素作为对照体系,设计了以下三种反应体系:S12+氯霉素、S12/针铁矿、S12/针铁矿+氯霉素.反应总体积为100 mL,包含1 mL微量元素、10 mL乳酸钠(0.2 mol/L)、1 mL维生素溶液、5 mL S12混悬液(OD=1.5,对照体系不加)、针铁矿为0.2 g (S12/氯霉素体系不加)、 5 mL不同浓度的氯霉素溶液(2 ppm、 5 ppm、10 ppm、20 ppm,S12+针铁矿体系不加)以及厌氧培养基.具体操作如下:在一系列250 mL玻璃瓶中分别加入针铁矿、微量元素、乳酸钠(0.2 mol/L)以及厌氧培养基,密封,高温高压灭菌(121 ℃,20 min),冷却至室温,使用高纯氮气除氧30 min,此过程中分别加入维生素溶液、S12混悬液(OD=1.5)及不同浓度的氯霉素溶液,密封后放置于控温振荡器中(200 rpm,25 ℃)反应,并定期取样进行测定.
1.4 分析方法
S12生物量的检测按以下方法进行:将0.1 mL反应样品取出后逐级稀释,将稀释后的样品涂布在LB平板上,24 h后计数平板上的菌落个数.邻菲罗啉分光光度法测定反应过程中产生的游离Fe(II)和总Fe(II),其中总Fe(II)测定方法如下[18]:定期取反应混悬液于10 mL离心管中,与1M无氧盐酸1∶1(V/V)避光浸泡12 h. 随后在一系列10 mL比色管中依次加入5 mL醋酸盐缓冲液(pH 5.0)、1 mL上述反应浸泡样、1 mL 0.5%邻菲罗啉,用去离子水定容至10 mL.静置15 min后,用紫外分光光度计(λ=510 nm)测定吸光度.游离Fe(II)测定中取样用微孔滤膜(孔径为0.22 μm)过滤,其滤液与1 M无氧盐酸1∶1(V/V)避光浸泡12 h,其他方法与总Fe(II)测定相同. 采用标准曲线法计算游离Fe(II)和总Fe(II)浓度,两者相减即为矿物结合Fe(II)的浓度.氯霉素的浓度用高效液相色谱仪(HPLC)进行分析测定,所用HPLC的具体参数如下:日本岛津LC-20AT HPLC系统,使用安捷伦Eclipse Plus C18分析柱(4.6×150 mm,5 μm),紫外检测波长为277 nm,流动相为乙腈∶水=35∶65(V/V),流速为1 mL·min-1;进样量:20 μL;柱温:30 ℃.本实验条件下测定,CAP的出峰时间为3.2 min.固体样品的表面晶型通过X-射线衍射仪测定,其测定条件为Cu靶,测试电压为40 kV,测试电流为40 mA,扫描角度范围为10~70°(2θ),扫描步长为0.026°,扫描速度为100 s/step.固体形貌及元素含量采用扫描电镜(SEM, JEM-1011)-能量色散X射线光谱(EDS)测得.
2 结果与讨论
2.1 氯霉素对S12/针铁矿异化还原产生Fe(II)的影响
S12异化还原针铁矿产生Fe(II)的变化曲线如图1所示,由于我们没有检测到溶液中的游离Fe(II),测得的Fe(II)可以确定为矿物结合Fe(II). 针铁矿+氯霉素反应体系中, 几乎没有Fe(II)的生成, 说明氯霉素本身对针铁矿没有还原作用.S12/针铁矿体系中,Fe(II)的产生量随着反应进行迅速增加, 反应至第10天时,Fe(II)的生成量达到4.5 mmol/L,说明该S12对针铁矿具有很强的还原能力.S12/针铁矿+氯霉素体系中, Fe(II)的产生量大幅降低, 并随着氯霉素的加入浓度从2 ppm逐渐增加至20 ppm,Fe(II)的产生量从0.93 mmol/L明显下降至0.25 mmol/L,说明氯霉素能够显著抑制S12对针铁矿的异化还原,其抑制作用随氯霉素浓度的增加而明显增强.

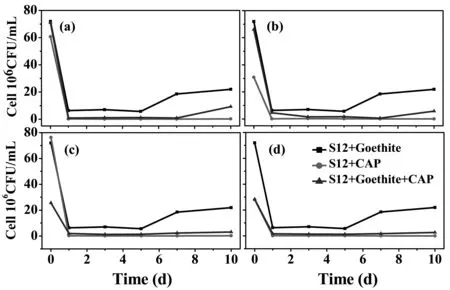
(a)2 ppm CAP; (b)5 ppm CAP; (c)10 ppm CAP; (d)20 ppm CAP
图1各反应体系产生的Fe(II)浓度变化图
为了弄清楚氯霉素是如何抑制异化铁还原,我们对各反应体系的S12生物量进行了检测,结果如图2所示.在反应初期,各反应体系的生物量都出现了下降,这主要是由于S12作为一种兼性厌氧菌,在有氧环境中的生长代谢比无氧环境要旺盛许多,从有氧环境转移到无氧环境,微生物有一个逐渐适应过程.S12/针铁矿体系中,S12的生物量在反应第5天后迅速回升,随后稳定在2.2×107CFU/mL左右,说明S12能够利用针铁矿作为末端电子受体进行呼吸生长.而在S12+氯霉素体系中,生物量出现了2~5个数量级的下降,随着氯霉素的浓度从2 ppm增加至20 ppm,生物量从1.5×105CFU/mL下降至2.0×102CFU/mL,说明氯霉素对S12具有很强的抑菌作用. S12/针铁矿+氯霉素体系中, S12的生物量也出现了下降, 但下降幅度明显缓和许多(大约1个数量级之内). 当氯霉素的初始加入浓度为20 ppm时,生物量下降至3.1×106CFU/mL左右,约为S12/针铁矿体系中生物量的1/8左右.因此,可以确定氯霉素通过抑菌作用使S12的生物量明显减少,从而抑制了S12/针铁矿的异化还原.然而,仔细比较S12/针铁矿和S12/针铁矿+氯霉素(20 ppm)体系的生物量和Fe(II)产生量,我们发现生物量的下降幅度(8倍左右)远比Fe(II)的下降幅度(20倍)要小许多,说明S12/针铁矿+氯霉素(20 ppm)体系中有部分产生的Fe(II)被消耗利用了.对比S12+氯霉素(20 ppm)和S12/针铁矿+氯霉素(20 ppm)体系的生物量变化,后者的生物量比前者高出4个数量级,说明异化铁还原过程的存在显著减轻了氯霉素对S12的抑菌作用.
2.2 S12/针铁矿异化还原过程中氯霉素的去除
我们考察了S12+氯霉素、S12/针铁矿+氯霉素等体系中氯霉素的去除情况,结果如图3所示.针铁矿+氯霉素作为对照,在该体系中氯霉素几乎没有去除,说明针铁矿对氯霉素没有吸附作用.在S12+氯霉素体系中,不同初始浓度的氯霉素均出现了一定的下降,反应10天后,初始浓度为2 ppm、5 ppm、10 ppm、20 ppm的氯霉素去除率分别为54.1%、40.9%、38%和19.5%,可见随着初始浓度的提高氯霉素的去除率明显下降.该结果说明当氯霉素初始浓度较低时,S12可以利用一部分氯霉素作为胞外电子受体,供其呼吸生长.当初始浓度较高时,氯霉素对S12的抑菌作用比较明显,导致氯霉素去除率急剧下降.在S12/针铁矿+氯霉素体系中,氯霉素的还原去除效果进一步提高, 反应10天后, 初始浓度为2 ppm的氯霉素被完全去除,5 ppm、10 ppm和20 ppm初始浓度的氯霉素也分别去除了87.5%、87.2%和77.2%.该反应体系氯霉素的去除曲线的变化趋势与S12+氯霉素体系也有明显不同, 前3天氯霉素的下降幅度明显趋缓, 第3~6天内氯霉素的去除速率明显加快,随后又趋于平缓.对照图1中Fe(II)的变化趋势,我们可以得出以下结论:S12在反应初期主要以异化还原针铁矿产生矿物结合Fe(II)为主,当该活性Fe(II)浓度达到一定水平后,对氯霉素进行快速还原去除,Fe(II)被氧化成Fe(III),导致S12/针铁矿+氯霉素体系中Fe(II) 的产生量维持在较低水平.因此,S12异化还原针铁矿产生的矿物结合Fe(II)是氯霉素降解去除的主要活性组分,与S12+氯霉素体系中S12是降解氯霉素的主要组分完全不同.S12/针铁矿+氯霉素体系中的大部分氯霉素被还原降解,使该体系中的S12受到抗生素的抑菌作用明显减轻,所以生物量比S12+氯霉素体系要高出许多.
(a)2 ppm CAP; (b)5 ppm CAP; (c)10 ppm CAP; (d)20 ppm CAP
图2各反应体系微生物生物量变化图

(a)2 ppm CAP; (b)5 ppm CAP; (c)10 ppm CAP; (d)20 ppm CAP
图3各反应体系中氯霉素浓度变化图
2.3 氯霉素对S12/针铁矿异化还原体系中矿物变化的影响
S12/针铁矿、S12/针铁矿+氯霉素体系反应10天后,将固体取出,经冷冻干燥后,样品采用XRD、SEM-EDS分析,以判断反应过程中是否发生了矿物晶型的变化.XRD分析结果如图4所示,S12/针铁矿体系出现了一组新的衍射峰,2θ角分别为11°、13°、18°、19°、21°、27°、29°、33°、34°、36°、38°和45°,这些峰的位置与标准蓝铁矿的衍射峰完全吻合.再经SEM分析,该反应体系出现了层状菱形的新矿物(图5B和5b),这与针铁矿的针状类型完全不同(图5A和5a). 对该新次生矿物进一步作EDS分析,测得矿物中Fe、O和P等元素的含量分别为51.6%、38.5%和9.9%(图6b和表1),这三种元素的含量比与蓝铁矿比较相近.根据以上XRD和SEM-EDS分析结果,可以确定针铁矿在S12的作用下发生了晶型变化,产生新的次生矿物蓝铁矿[11].
S12/针铁矿+氯霉素体系中,当氯霉素的浓度为2 ppm时,XRD图上也出现了2θ角为13°、36°和45°的新衍射峰(图4a),峰的强度比S12/针铁矿体系明显减弱.SEM图上也出现了新的矿物,但没有明显的层状菱形矿物出现(图5C和5c). 对矿物进一步作EDS分析,测得Fe、O和P等元素的含量分别为45.7%、8.4%和45.9%(图6c和表1),相比S12/针铁矿体系O元素的含量有所上升,P元素的含量有所下降.根据这一结果,可以判断该反应体系出现了微弱的蓝铁矿,其含量明显低于S12/针铁矿体系.对比其他三种S12/针铁矿+氯霉素体系(包括氯霉素浓度为5 ppm、10 ppm和20 ppm)的XRD分析结果(图4b、4c和4d),图中全部为针铁矿的特征峰,并无其他新的衍射峰出现.SEM图中也没有新的矿物出现,在低倍镜下看到的只是经冷冻干燥后针铁矿的团聚体(图5C、5c、5D、5d、5E和5e).EDS分析也没有P或其他新的元素(表1).根据以上结果,可以确定氯霉素对S12作用下针铁矿向蓝铁矿的转化具有明显的抑制作用,当氯霉素初始浓度较低时,氯霉素基本上都被矿物结合Fe(II)还原降解,抑制能力相对较弱.
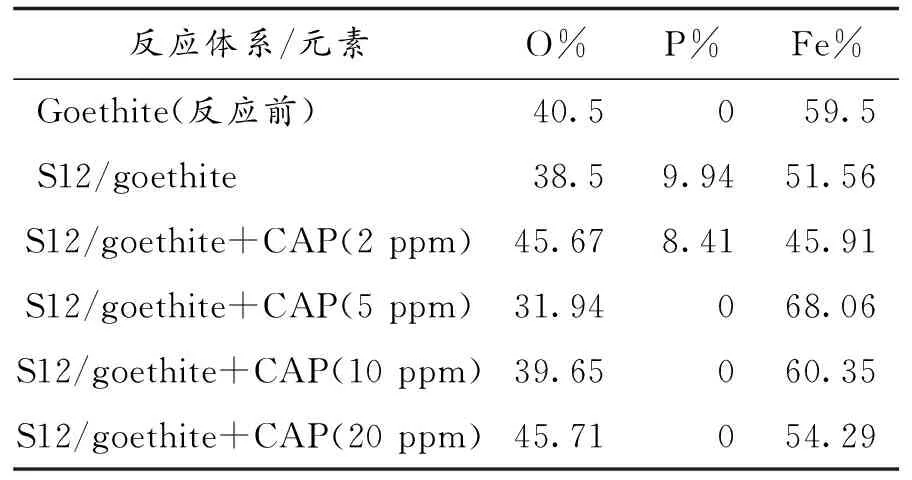
表1 各体系反应后固体样品EDS能谱图中各元素质量百分比
3 结论
氯霉素对S12具有明显的抑菌作用,从而在一定程度上抑制了S12对针铁矿的异化还原,阻碍了异化铁还原过程中针铁矿向蓝铁矿的转化.与此同时,S12异化还原针铁矿产生的矿物结合Fe(II)是氯霉素还原降解的主要活性组分,能够将初始浓度为2 ppm的氯霉素完全降解,降解速率和效率比微生物还原要高出许多,极大地缓解了氯霉素对铁还原菌的抑菌作用.通过本研究,我们首次发现了抗生素对铁还原菌/铁矿物异化还原的影响机制,以及异化铁还原产生的活性组分对抗生素的降解作用.

(a)2 ppm CAP; (b)5 ppm CAP; (c)10 ppm CAP; (d)20 ppm CAP
图4各反应体系反应后固体样品的XRD图

(A)(a)Goethite;(B)(b)S12/goethite;(C)(c)S12/goethite+CAP (2 ppm);
图5各反应体系反应后固体样品的SEM图

(a)Goethite;(b)S12/goethite;(c)S12/goethite+CAP (2 ppm);(d)S12/goethite+CAP (5 ppm);
图6各反应体系反应后固体样品的SEM-EDS图

