胃癌组织中BMAL1、GLI1的表达及意义
程 玉,刘海旺,郝美玲,薛 晶,齐洁敏
最新数据显示,2018年全球新增胃癌病例100万,死亡病例约78.3万,约12例中有1例死于胃癌[1]。胃癌是我国第二大恶性肿瘤,发病率远高于西方发达国家[2]。认识胃癌发病的分子机制有助于提高胃癌的诊疗水平。近年研究发现,破坏昼夜节律平衡会导致肿瘤的发生[3],节律因子BMAL1能够通过自身的表达调控和形成正负反馈通路而产生昼夜节律,其作为抑癌基因与多种肿瘤的发生、发展密切相关。目前,BMAL1在胃癌中是促癌作用还是抑癌作用尚存在争议,且其调控胃癌发病的下游信号转导途径也未明确[4-6]。GLI1作为Hedgehog(HH)信号通路中重要的核内转录因子,能激活下游靶基因从而调控增殖、分化等多种生理功能。GLI1与肿瘤的发生、发展关系密切,促进多种肿瘤的进展。胃癌中BMAL1与GLI1的表达是否具有相关性值得进一步探讨。本实验采用免疫组化SP法检查胃癌中BMAL1和GLI1的表达及与临床病理特征的关系,为探索BMAL1促进胃癌发生、发展的机制提供依据。
1 材料与方法
1.1 临床资料 收集2014~2018年承德医学院附属医院病理科存档的90例石蜡标本,其中男性66例,女性24例,年龄38~81岁,中位年龄60岁,低分化52例,高中分化38例。根据2016年AJCC标准进行TNM分期,其中Ⅰ+Ⅱ期48例,Ⅲ+Ⅳ期42例。所有病例临床、病理资料均完整,并经病理检查证实,患者术前均未行放、化疗等辅助治疗,患者均知情同意。另随机抽取40例癌旁(距癌组织边缘≥5 cm)组织作为对照组。
1.2 免疫组化 免疫组化染色采用EliVision两步法。兔抗人BMAL1多克隆抗体(Ab93806,1 ∶200)及兔抗人GLI1多克隆抗体(Ab151796,1 ∶200)均购自美国Abcam公司。柠檬酸缓冲液高压修复2 min,染色步骤严格按试剂盒说明书进行,DAB显色。
1.3 结果判断 由两位高年资病理医师采用双盲法阅片,每张切片随机选取5个高倍视野,采用双评分法判断。(1)按阳性细胞所占百分比计分:阳性细胞数≤25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。(2)按阳性细胞着色强度计分:细胞无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两项得分结果相乘作为最终评分,总分范围为0~12分;以≤8分为低表达(阴性),>8分为高表达(阳性)[7]。
1.4 统计学分析 采用SPSS 20.0软件对实验数据进行统计学分析,计数资料的组间比较采用χ2检验,两指标相关性用Spearman等级相关分析。
2 结果
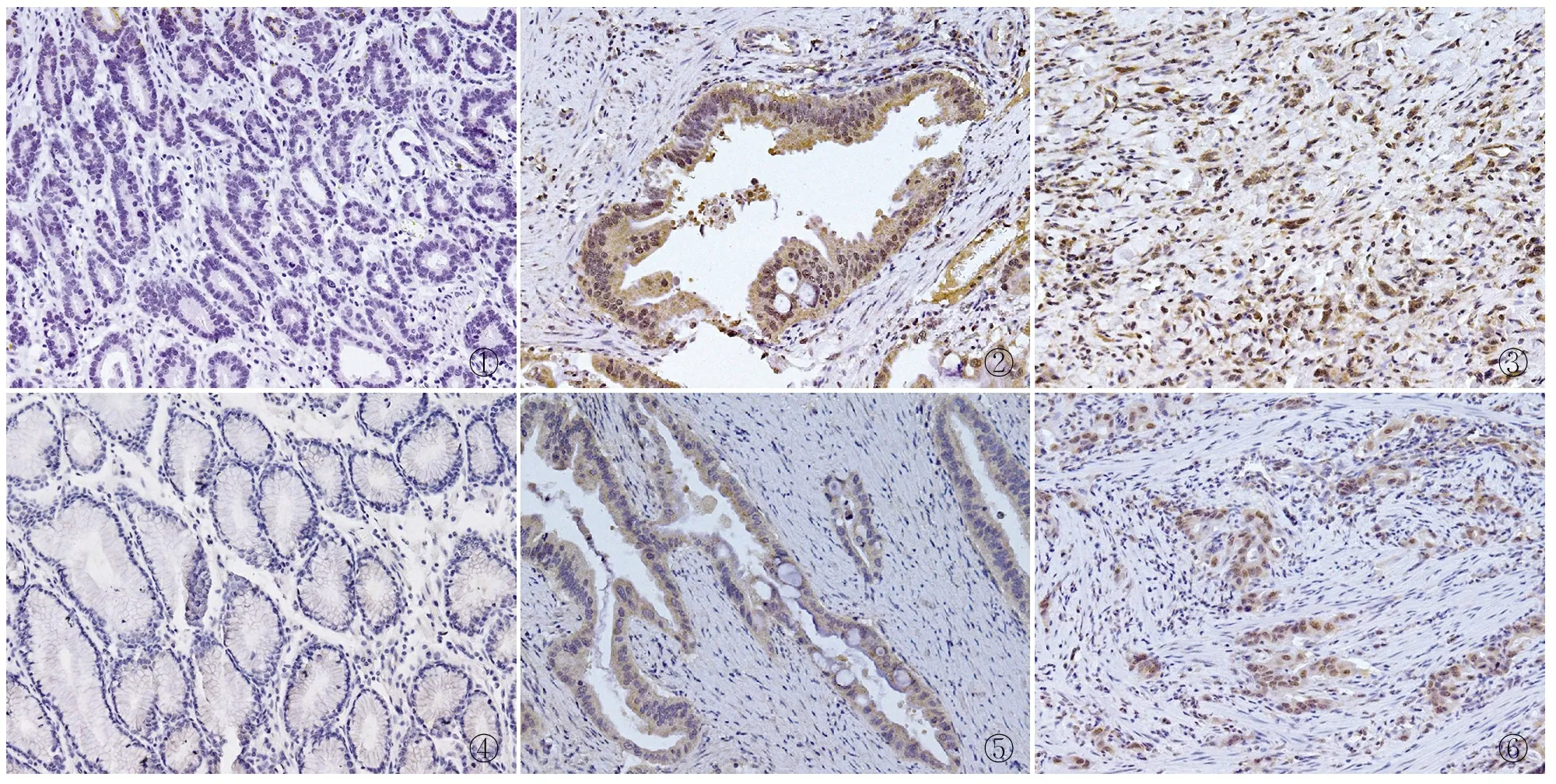
2.1 胃癌及癌旁组织中BMAL1、GLI1的表达 BMAL1和GLI1阳性定位于细胞核和细胞质。胃癌组织中BMAL1和GLI1的阳性率分别为86.7%(78/90)和83.3%(75/90),两者在癌旁组织中的阳性率分别为12.5%(5/40)和10.0%(4/40)。BMAL1和GLI1在胃癌组织中的表达显著高于癌旁组织,差异有统计学意义(P<0.01,表1,图1~6)。

表1 BMAL1和GLI1在胃癌及癌旁组织中的表达
2.2 BMAL1、GLI1表达与胃癌临床病理特征的关系 BMAL1表达与胃癌淋巴结转移及TNM分期相关(P<0.05),与患者性别、年龄、肿瘤最大直径、分化程度无关(P>0.05)。GLI1表达与胃癌浸润深度、淋巴结转移及TNM分期相关(P<0.05),与患者性别、年龄、肿瘤最大直径、分化程度无关(P>0.05,表2)。

表2 BMAL1和GLI1表达与胃癌临床病理特征的关系
2.3 胃癌组织中BMAL1与GLI1表达的相关性 本实验中BMAL1和GLI1蛋白在胃癌中表达的秩相关系数为0.526(P<0.01),即两者表达呈正相关(表3)。
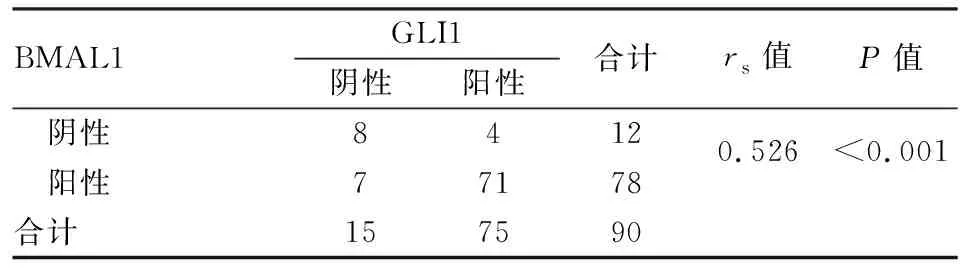
表3 胃癌组织中BMAL1和GLI1表达的相关性
3 讨论
所有生物体的生理功能和行为均保持强健的昼夜节律,生物钟基因(PER1、PER2、CRY1、CRY2、CLOCK、BMAL1)组成转录/翻译正负反馈回路(TTFLs),调控昼夜生物节律。转录因子BMAL1(又名ARNTL)位于TTFLs核心部位,在维持正常生物节律中起至关重要的作用[8-9]。越来越多的研究证实BMAL1参与肿瘤的多种生物学行为,并且其在肿瘤中的作用具有组织特异性,如BMAL1在胰腺癌、舌鳞状细胞癌等恶性肿瘤中起抑癌作用,而在头颈部肿瘤、髓细胞白血病等肿瘤中起促癌作用[10-13]。目前,关于BMAL1在胃癌中作用的研究相对较少,且研究结果不一致。Hu等[4]研究发现BMAL1在胃癌及癌旁组织中表达无差异,且与胃癌临床生物学行为无关。魏柏等[5-6]报道BMAL1在胃癌组织中呈高表达,BMAL1的表达与患者年龄、肿瘤分化程度相关,并且认为BMAL1基因诱导胃癌细胞的增殖。研究结果的不一致,可能是因为样本量不同所致。本实验中发现BMAL1在胃癌中的表达明显高于癌旁组织,提示BMAL1是胃癌组织和癌旁组织的差异蛋白,其可能在胃癌发生过程中起作用,与魏柏等研究结果一致。胃癌组织中,BMAL1在T3+T4组中的表达高于T1+T2组,淋巴结转移N2+N3组中BMAL1表达高于N0+N1组,TNM分期Ⅲ+Ⅳ组中BMAL1的表达高于Ⅰ+Ⅱ组,表明BMAL1可能在促进胃癌侵袭转移过程中发挥作用。
①②③④⑤⑥
图1 BMAL1在癌旁组织中呈阴性,EliVision两步法 图2 BMAL1在高分化胃癌组织中呈阳性,EliVision两步法 图3 BMAL1在低分化胃癌组织中呈强阳性,EliVision两步法 图4 GLI1在癌旁组织中呈阴性,EliVision两步法 图5 GLI1在高分化胃癌组织中呈阳性,EliVision两步法 图6 GLI1在低分化胃癌组织中呈强阳性,EliVision两步法
GLI1是HH信号通路中极其重要的一部分,可以激活大部分HH信号通路靶基因,该通路参与胚胎发生、组织分化、自我更新、体内平衡和成体干细胞增殖[14]。哺乳动物中HH通路的组成部分有HH配体(DHH、SHH、IHH)、膜蛋白受体复合物Patched(PTCH)和Smoothened(SMO)、核转录因子GLI家族及下游靶基因。在正常生理情况下,PTCH抑制SMO蛋白活性,从而抑制HH下游通路,当PTCH和HH结合后,解除PTCH对SMO抑制作用,SMO进入胞质中,激活转录因子GLI,最后GLI锌指转录因子(GLI1、GLI2、GLI3)移位进入细胞核,诱导调控细胞生长、存活和分化[15]。HH信号通路在胃癌的远处转移、不良预后和耐药中起关键作用[16]。近期有研究指出,GLI1在胃癌组织中的表达水平高于癌旁组织,抑制GLI1基因的表达能够抑制胃癌细胞增殖和迁移能力[17]。GLI1高表达促进胃癌细胞增殖迁移、诱导耐药[18]。本实验亦证实GLI1在胃癌组织中表达高于癌旁组织,随着分化程度的降低,浸润深度的增加,TNM分期的升高,GLI1的表达亦增高,提示GLI1在胃癌细胞的侵袭、转移中具有重要作用。
目前,BMAL1与GLI1在胃癌中的表达是否有关联尚不清楚,有文献报道HH信号通路通过转录因子GLI与肝脏脂肪代谢昼夜节律相互反馈,BMAL1能调控HH信号通路核心基因[19]。本实验分析胃癌中BMAL1和GLI1表达的相关性,结果显示BMAL1和GLI1在胃癌中表达呈正相关,提示两者可能协同促进胃癌的发生、发展,具体机制尚有待体外细胞系实验研究证实。
总之,BMAL1和GLI1在胃癌组织中高表达,两者表达与胃癌浸润深度、淋巴结转移及TNM分期密切相关,GLI1表达亦与胃癌分化程度相关。两者可能在胃癌发生、发展过程中起重要作用。BMAL1、GLI1在胃癌中的表达呈正相关,可能具有协同作用,为进一步探究BMAL1在胃癌中的作用提供线索。

