EAF2表达与前列腺癌上皮-间质转化的关系及临床意义
涂 健,洪 荫,汪 娟,崔红霞,眭怡群,冯一中,张永胜,
前列腺癌是男性最常见的恶性肿瘤之一。近年由于新的辅助治疗手段的推广和肿瘤分子分型的广泛应用,前列腺癌的发病率和病死率均有所下降,但这些新疗法所带来的毒副作用也越来越受到重视,前列腺癌仍然是男性死亡的重要原因之一[1]。上皮细胞-间质转化(epithelial-mesenchymal transition, EMT)是去势抵抗性前列腺癌重要的耐药机制之一,EMT是多步骤的变化过程,最终可致前列腺癌上皮表型消失而获得间质表型,EMT可赋予肿瘤细胞转移、侵袭以及干细胞特征[2-3]。EAF2是新发现的肿瘤抑制因子,最初作为前列腺中雄激素反应基因被发现[4]。EAF2在人前列腺癌组织和细胞系中的表达下调,EAF2的过表达可以诱导转染的前列腺癌细胞凋亡并抑制肿瘤的生长[5]。但其与EMT的关系尚未见报道,本文现分析EAF2和EMT标志蛋白在前列腺癌组织中的表达,探讨EAF2和EMT之间的关系及其临床意义。
1 材料与方法
1.1 临床资料 收集苏州大学附属第二医院病理科存档的82例前列腺癌组织和46例良性前列腺组织。82例前列腺癌患者年龄55~94岁,平均72.9岁,>70岁者51例,≤70岁者31例。前列腺癌组织按照2010年AJCC分期标准分期:Ⅰ+Ⅱ期35例,Ⅲ+Ⅳ期47例;有淋巴结转移者20例;有随访资料者44例,随访时间61~96个月,平均72.8个月。所有患者均行手术切除治疗,患者术前未接受放、化疗或抗雄激素等治疗。按照2016版与前列腺癌预后相关的WHO/ISUP分级分组系统将前列腺癌分为1~5个组别[6]。
前列腺组织芯片的制作:本实验所有标本均来自苏州大学附属第二医院病理科,蜡块均保存完好,可直接进行组织芯片的制作(图1),111个样品点,合计82例前列腺癌组织及29例良性前列腺组织。
1.2 试剂 EAF2兔抗人抗体购自Abcam公司,E-cadherin兔抗人多克隆抗体购自武汉博士德生物公司;vimentin和N-cadherin兔抗人多克隆抗体均购自北京博奥森生物公司;免疫组化检测试剂盒和DAB显色剂均购自北京中杉金桥公司。
1.3 免疫组化 前列腺癌组织蜡块标本4 μm厚切片,采用免疫组化SP法染色,操作步骤严格按试剂盒说明书进行。一抗包括EAF2(1 ∶200)、E-cadherin(1 ∶300)、vimentin(1 ∶300)、N-cadherin(1 ∶300),4 ℃孵育过夜。用PBS代替一抗作为阴性对照,已知染色阳性的前列腺癌组织切片作为阳性对照。
AB
图1 前列腺癌组织芯片:A.组织蜡块;B.HE切片
结果判定:EAF2表达定位于细胞核,按染色强度和阳性细胞数占肿瘤细胞总数的百分比计分。(1)按染色强度计分:细胞未着色为0分,淡黄色为1分,棕黄色为2分,棕褐色3分;(2)按阳性细胞百分比计分:阳性细胞数占0~1%为0分,2%~24%为1分,25%~49%为2分,50~74%为3分,75~100%为4分;将两项得分结果相乘:≥3分为阳性[7]。E-cadherin主要表达于细胞膜,>50%的细胞呈棕黄色颗粒为阳性;N-cadherin表达定位于细胞膜和(或)细胞质,>10%的细胞呈棕黄色颗粒为阳性;vimentin主要表达于细胞质,>10%的细胞呈棕黄色颗粒为阳性。
1.4 统计学分析 采用SPSS 18.0软件对所有数据进行统计学分析,采用χ2检验和Pearson相关检验进行EAF2表达与EMT标志蛋白的相关性分析,采用Kaplan-Meier法进行生存分析,P<0.05为差异有统计学意义。
2 结果
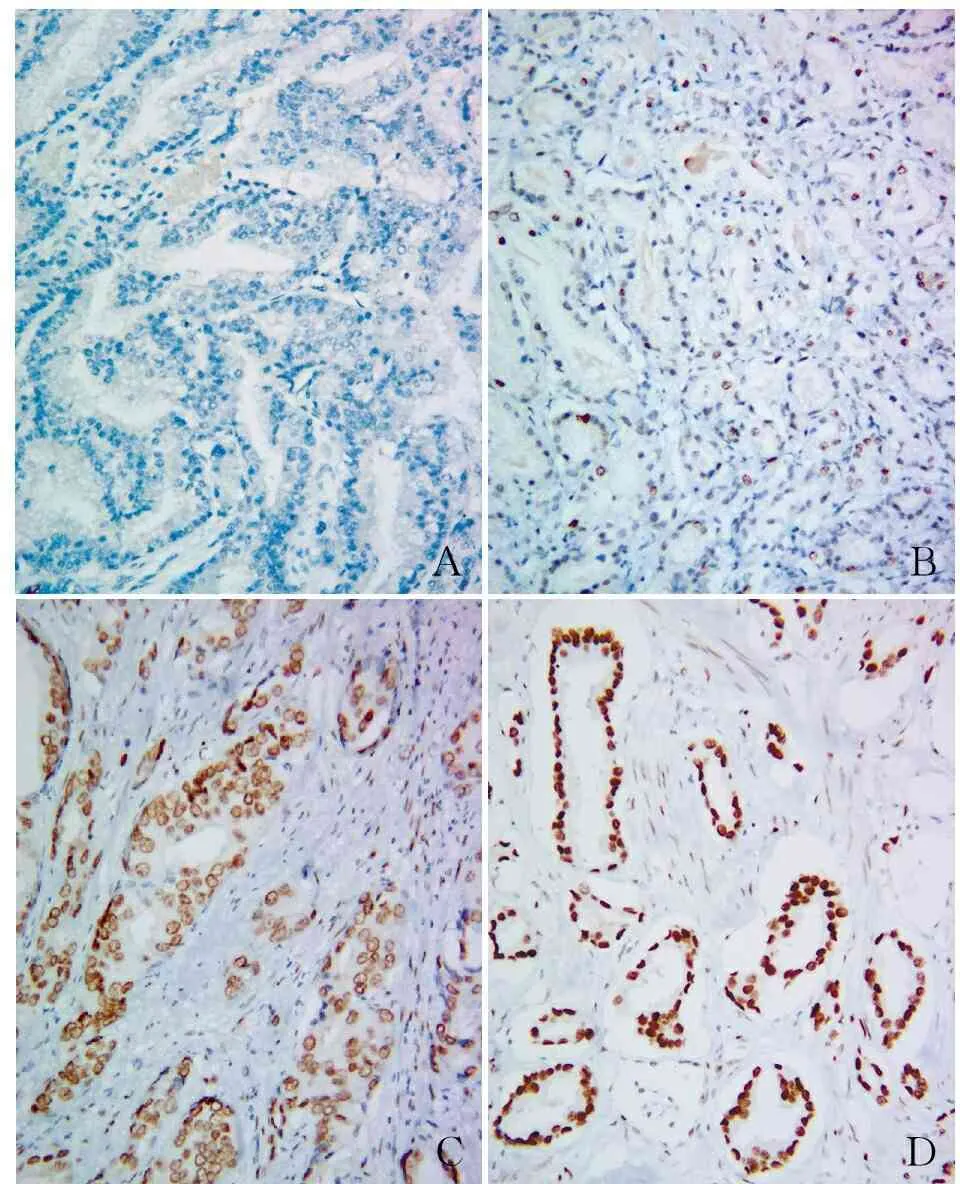
2.1 EAF2在前列腺癌组织和良性前列腺组织中的表达 EAF2染色阳性呈棕黄色或棕褐色颗粒,主要定位于细胞核(图2)。EAF2蛋白在良性前列腺组织中的阳性率为69.57%,显著高于前列腺癌组织(40.24%),差异有统计学意义(P<0.05,表1)。

表1 EAF2在前列腺癌组织和良性前列腺组织中的表达[n(%)]
ABCD
图2 EAF2在前列腺癌组织中的表达:A.阴性;B.弱阳性;C.中等阳性;D.强阳性,SP法
2.2 EMT标志物在前列腺癌组织和良性前列腺组织中的表达 免疫组化结果显示,EMT相关标志物E-cadherin和N-cadherin表达定位于细胞膜,vimentin表达定位于细胞质(图3)。前列腺癌组织中E-cadherin、vimentin和N-cadherin的阳性率分别为39.01%、21.95%和75.61%。良性前列腺组织中E-cadherin、vimentin和N-cadherin的阳性率分别为78.23%、15.74%和5.62%。
2.3 EAF2表达与前列腺癌临床病理特征及预后的关系 EAF2蛋白表达与前列腺癌临床分期(P=0.007,表2)、WHO/ISUP病理分组相关(P=0.016,表2),与患者年龄、淋巴结有无转移、脉管有无转移及神经有无侵犯等均无关(P>0.05,表2)。生存分析结果显示,前列腺癌组织中EAF2阳性患者的总生存期高于EAF2阴性患者(P=0.044,图4)。
2.4 EAF2表达与前列腺癌EMT标志蛋白表达之间的关系 Pearson相关检验分析前列腺癌组织中EAF2的表达与E-cadherin、vimentin、N-cadherin的相关性,结果显示,EAF2与E-cadherin表达呈正相关(r=0.363,P=0.001),与vimentin(r=-0.255,P=0.021)和N-cadherin表达(r=-0.271,P=0.014)呈负相关(表3)。

ABC
图3 EMT标志物在前列腺癌组织中的表达:A.vimentin;B.N-cadherin;C.E-cadherin,SP法
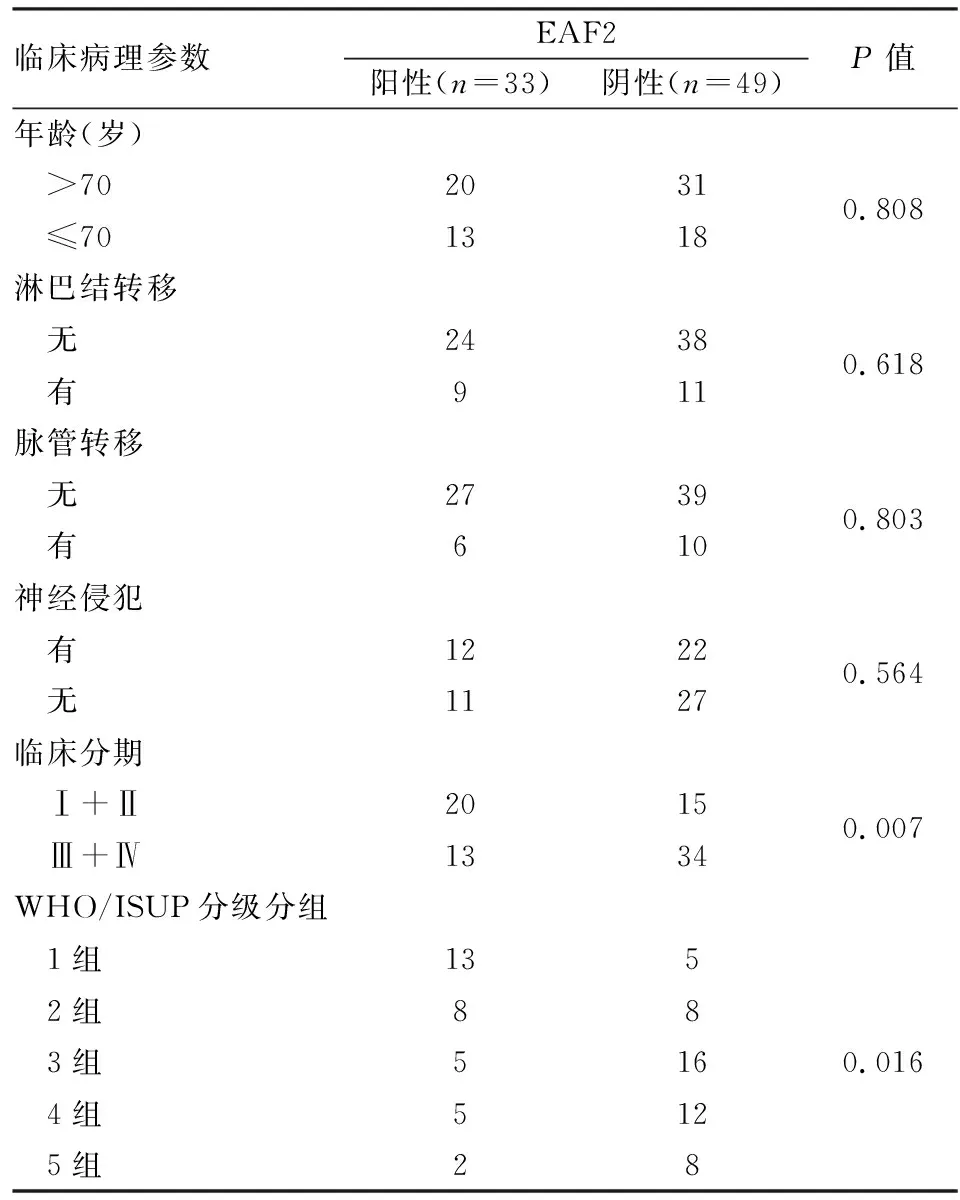
表2 EAF2表达与前列腺癌临床病理特征的相关性
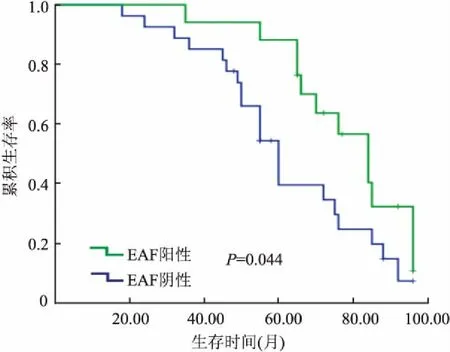
图4 Kaplan-Meier法分析EAF2表达与前列腺癌患者生存时间的关系
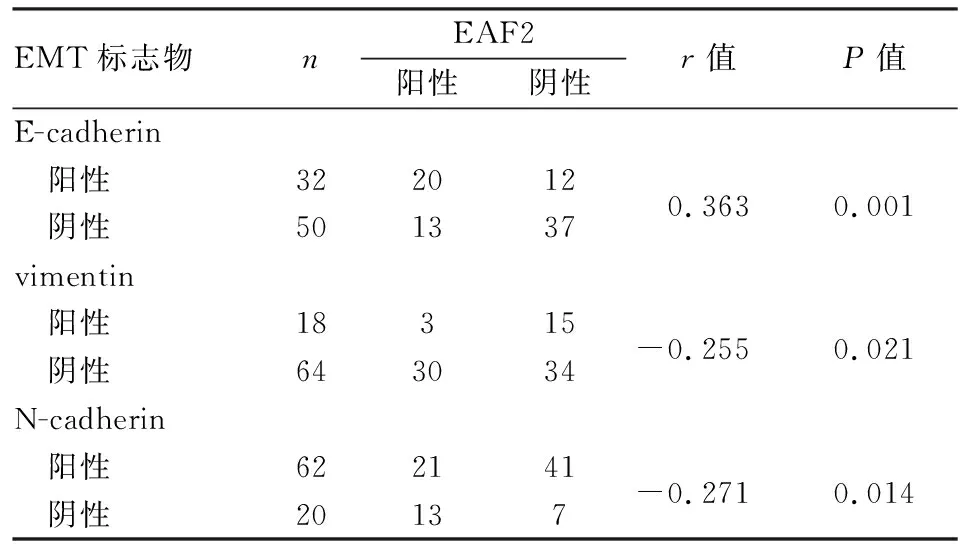
表3 EAF2表达与前列腺癌EMT标志蛋白表达的相关性
3 讨论
目前,前列腺癌的治疗以手术切除、去势治疗以及放化疗为主要治疗手段,整体预后良好,但多数患者最终会转变为去势抵抗性前列腺癌,大量研究表明去势抵抗性前列腺癌中肿瘤细胞出现了干细胞特征并表达分化特征的相关因子从而发生EMT[8-9],EMT常表现为表面标记蛋白表达的变化:E-cadherin、cytokeratin等上皮标志物减少,vimentim、N-cadherin、fibronectin等间质标志物增加。因此,可以通过检测这些标志物来鉴定EMT的发生[10]。EMT可以导致前列腺癌的治疗抵抗以及转移[11],研究表明TGF-β在EMT中扮演重要角色,通过与雄激素受体(AR)轴相互作用,促进前列腺癌转移、侵袭以及耐药性[12]。
研究表明EAF2可以通过直接结合pVHL位点来调节低氧诱导因子(HIF1-α)以及肿瘤血管生成[13]。Chen等[14]发现在低氧条件下,HIF1-α可以诱导EAF2的表达上调,而EAF2可以抑制HIF1-α的转录活性。EAF2可以和抑癌基因p53作用来调节血栓反应蛋白1(TSP-1)进一步抑制内皮细胞的增殖和迁移[15],本组实验结果表明,EAF2在良性前列腺组织中的表达高于前列腺癌组织,提示抑癌基因EAF2可能抑制前列腺癌的发生、转移。本组实验结果提示,EAF2在临床分期Ⅲ+Ⅳ期患者中的表达水平低于临床分期Ⅰ+Ⅱ期患者,提示EAF2阴性者预后更差。而WHO/ISUP分级分组结果提示,前列腺癌高分组中EAF2蛋白表达水平低于前列腺癌低分组,WHO/ISUP分级分组和前列腺癌病理学Gleason评分和预后密切相关,因此本组实验结果提示,EAF2蛋白表达和前列腺癌组织学分级以及预后具有一定相关性,生存分析结果表明,EAF2阳性前列腺癌患者的整体生存率高于EAF2阴性患者,表明其表达与患者预后有一定的相关性,其临床意义有待深入探讨。
研究表明EAF2和p53共同调节并抑制STAT3的表达和磷酸化过程,抑制了前列腺癌的生长[16],而目前已知STAT3在前列腺癌及其他多种肿瘤中促进EMT的过程[17-19],但EAF2与EMT的关系未见报道,作者在前列腺癌组织水平分析了EAF2的表达与EMT标志蛋白表达的关系,本组实验结果表明,EAF2与E-cadherin表达呈正相关,与N-cadherin和vimentin表达呈负相关;进一步的检测发现EAF2高表达的前列腺癌组织中,E-cadherin亦高表达,而vimentin和N-cadherin低表达,反之亦然,以上结果提示EAF2与前列腺癌的EMT表型有关,EAF2可能通过上调E-cadherin以及下调vimentin和N-cadherin的表达来抑制EMT的发生,从而抑制前列腺癌的侵袭、转移,而EAF2与EMT具体的关联和机制如何则有待积累大样本进行深入分析。探讨EAF2和EMT在前列腺癌中的表达水平及其相关性对揭示前列腺癌的发生、发展机制有指导意义,并为进一步的前列腺癌诊断和治疗提供理论依据。

