加速溶剂萃取同步净化-同位素内标-气相色谱-高分辨质谱测定水产品中32种多氯联苯
江 丰, 余婷婷, 李 珉, 荣 茂, 韩 莉, 宋 哲, 朱晓玲
(湖北省食品质量安全监督检验研究院, 湖北省食品质量安全检测工程技术研究中心, 湖北 武汉 430075)
多氯联苯(polychlorinated biphenyls, PCBs),是联苯的1~10位上的氢原子被氯原子取代后形成的氯代烃类化合物,其同分异构体和同系物多达209种[1],性质稳定,在自然环境中极难分解,因此具有环境持久性、远距离迁移性和生物蓄积性等特点,给人体健康和生态系统造成了潜在的威胁[2,3],是斯德哥尔摩公约中优先控制的12类持久性有机污染物之一。目前PCBs在水体、土壤、水生生物、野生动植物乃至人乳及其脂肪中都有检出[4,5]。对人类而言,除职业暴露外,食物摄入是最重要的途径,占人体接触量的90%以上,其中动物性食品是主要来源[6]。因此,研究水产品中痕量PCBs的检测方法,对了解和掌握水产品中PCBs的污染状况至关重要。
当前检测水产品中PCBs含量的技术有气相色谱配置电子捕获检测器(GC-ECD)[7,8]、气相色谱-串联质谱(GC-MS/MS)[9,10]和气相色谱-高分辨质谱(GC-HRMS)[11]。ECD对检测卤代化合物有很高的灵敏度,但是缺乏选择性;GC-MS/MS使用多反应监测模式(SRM/MRM)时在一定程度上增加了分析的敏感性和特异性,但由于水产品的基质复杂,且PCBs的含量可能在ng甚至pg水平,干扰较为严重。而GC-HRMS通过选择离子的精确质量数进行测定,其质量数可精确到小数点后四位,从而避开了其他具有相同整数离子的干扰,大大地降低了化学噪声,使其具有高灵敏度、抗干扰能力强的特点。
由于水产品中含有大量油脂,干扰组分复杂,净化不彻底会造成结果的不准确,甚至会影响分析仪器的使用寿命,因此,样品的提取、净化和测定成为目前水产品中PCBs残留分析的难点。水产品中PCBs的提取方法主要有索氏萃取、超声萃取和加速溶剂萃取(ASE)等[12]。索氏萃取过程繁琐耗时,超声萃取效率有待提高,而加速溶剂萃取具有萃取效率高、溶剂用量少、耗时短、全自动化和回收率高等优点,在水产品目标物的提取中获得越来越广泛的应用。且在线净化-ASE技术采用在萃取池中填入合适吸附剂,选择性吸附样品中的杂质,可以达到萃取净化同步完成的目的,极大地节省了操作时间和步骤,常用的吸附剂有活性炭、C18树脂、酸化硅胶、硅胶、氧化铝、弗罗里硅土,可以在线除去有机物、脂肪、色素等杂质,但目前主要应用于土壤中环境污染物的测定[13-15],而水产品中PCBs的提取和净化却鲜有报道。浓硫酸磺化法可有效地除去提取液中的脂肪、色素和杂质[16],进一步除去ASE未吸附的杂质。国标《食品安全国家标准食品中指示性多氯联苯含量的测定》[17]第二法(气相色谱法)也采用了浓硫酸净化的方式。
本工作采用ASE同步净化-同位素内标-GC-HRMS,建立了水产品中32种PCBs的测定方法。
1 实验部分
1.1 仪器、试剂与材料
气相色谱-高分辨质谱(DFS,美国ThermoFisher公司);气相色谱-串联质谱(7000D,美国Agilent公司);加速溶剂萃取仪(E-916,瑞士BUCHI公司);真空冷冻干燥机(Benchtop pro,美国Virtis公司);快速溶剂蒸发仪(Rocket,英国GeneVac公司);电子天平(AL204,瑞士Mettler Toledo公司)。
32种PCBs(PCB8、PCB28、PCB37、PCB44、PCB49、PCB52、PCB60、PCB66、PCB70、PCB74、PCB77、PCB82、PCB87、PCB99、PCB101、PCB105、PCB114、PCB118、PCB126、PCB128、PCB138、PCB153、PCB156、PCB158、PCB166、PCB169、PCB170、PCB179、PCB180、PCB183、PCB187、PCB189)混合标准溶液(10 μg/mL,美国Accustandard公司); PCBs定量内标(13C12-PCB28、13C12-PCB52、13C12-PCB118、13C12-PCB153、13C12-PCB180)标准溶液(2.0 μg/mL,加拿大Wellington Laboratries公司)、PCBs回收率内标(13C12-PCB101)标准溶液(2.0 μg/mL,加拿大Wellington Laboratories公司)。
丙酮、二氯甲烷(色谱纯,美国Fisher公司);正己烷(色谱纯,美国Merck公司)。无水硫酸钠、中性氧化铝、弗罗里硅土(分析纯,国药集团化学试剂有限公司),使用前均在550 ℃下烘烤6 h,待用。
水产品样品来自湖北省内各地集贸市场。
1.2 标准溶液的配制
PCBs混合标准中间液(100 μg/L):准确量取0.1 mL 32种PCBs混合标准溶液于10 mL容量瓶中,用正己烷定容至刻度。
PCBs混合标准系列工作溶液:分别准确量取适量PCBs混合标准中间液于不同10 mL容量瓶中,用正己烷分别定容至刻度。配制成PCBs混合标准系列工作溶液,质量浓度分别为0.1、0.5、1、2、5、10、20 μg/L。使用时,分别吸取100 μL PCBs混合标准系列工作溶液于装有0.2 mL锥形衬管的进样瓶中,再分别加入1 μL定量内标和回收率内标。
1.3 样品前处理
1.3.1 样品采集与制备
现场采集的水产品用铝箔包装,置冷冻箱中运输到实验室,于-10 ℃下低温保存。在制备时,取可食部分约200 g绞碎,然后装入塑料瓶中在真空冷冻干燥仪中冷冻干燥48 h,取出后研磨粉碎,置于-18 ℃下密封冷冻保藏待用。
1.3.2 样品前处理
准确称取1.0 g冻干样品与石英砂搅拌均匀,随后转移至已依次加入2 g无水硫酸钠、1 g弗罗里硅土、50 g中性氧化铝的100 mL不锈钢萃取池中,再加入定量内标1 μL,放置30 min后,进行加速溶剂萃取。ASE仪条件为:提取试剂二氯甲烷-正己烷(1∶1, v/v),系统压力10 Mpa,萃取温度100 ℃,加热时间300 s,萃取时间180 s,清洗体积为萃取池体积的40% ,氮气吹扫时间100 s,循环2次。
萃取液经快速溶剂蒸发仪浓缩至约近干后,将浓缩的提取液转移至15 mL试管中,用约5 mL正己烷洗涤蒸发管3~4次,洗液并入浓缩液中,用正己烷定容至刻度,并加入0.5 mL浓硫酸,振摇1 min,以 3 000 r/min 的转速离心5 min,使硫酸层和有机层分离。重复操作1次。吸取上层溶液至10 mL玻璃试管中,在氮气下浓缩至近干,加入100 μL正己烷,转移至装有0.2 mL锥形衬管的进样瓶中,加入1 μL回收率内标溶液,待上机分析。
1.4 分析条件
1.4.1 气相色谱-高分辨质谱
气相色谱 毛细管色谱柱:TRDIOXIN-5MS毛细管柱(60 m×0.25 mm×0.1 μm);进样口温度:280 ℃;传输线温度:280 ℃;升温程序:初始温度100 ℃,保持2 min,以15 ℃/min 升温速率升至180 ℃,再以3 ℃/min 升至240 ℃,再以10 ℃/min 升至300 ℃,保持10 min。进样方式:不分流进样;柱流速:1.2 mL/min,恒流模式;载气:氦气(纯度≥ 99.999% );进样量:1 μL。
高分辨质谱 电子轰击离子(EI)源,离子源电压45 eV;离子源温度260 ℃;溶剂延迟时间10 min;分辨率≥ 10 000;选择离子监测(SIM)模式(PCBs保留时间和特征碎片离子的质量数信息见表1)。

表 1 32种PCBs和6种同位素内标的保留时间和特征碎片离子的质量数Table 1 Retention times and masses of characteristic fragment ions of 32 PCBs and 6 isotopic internal standards
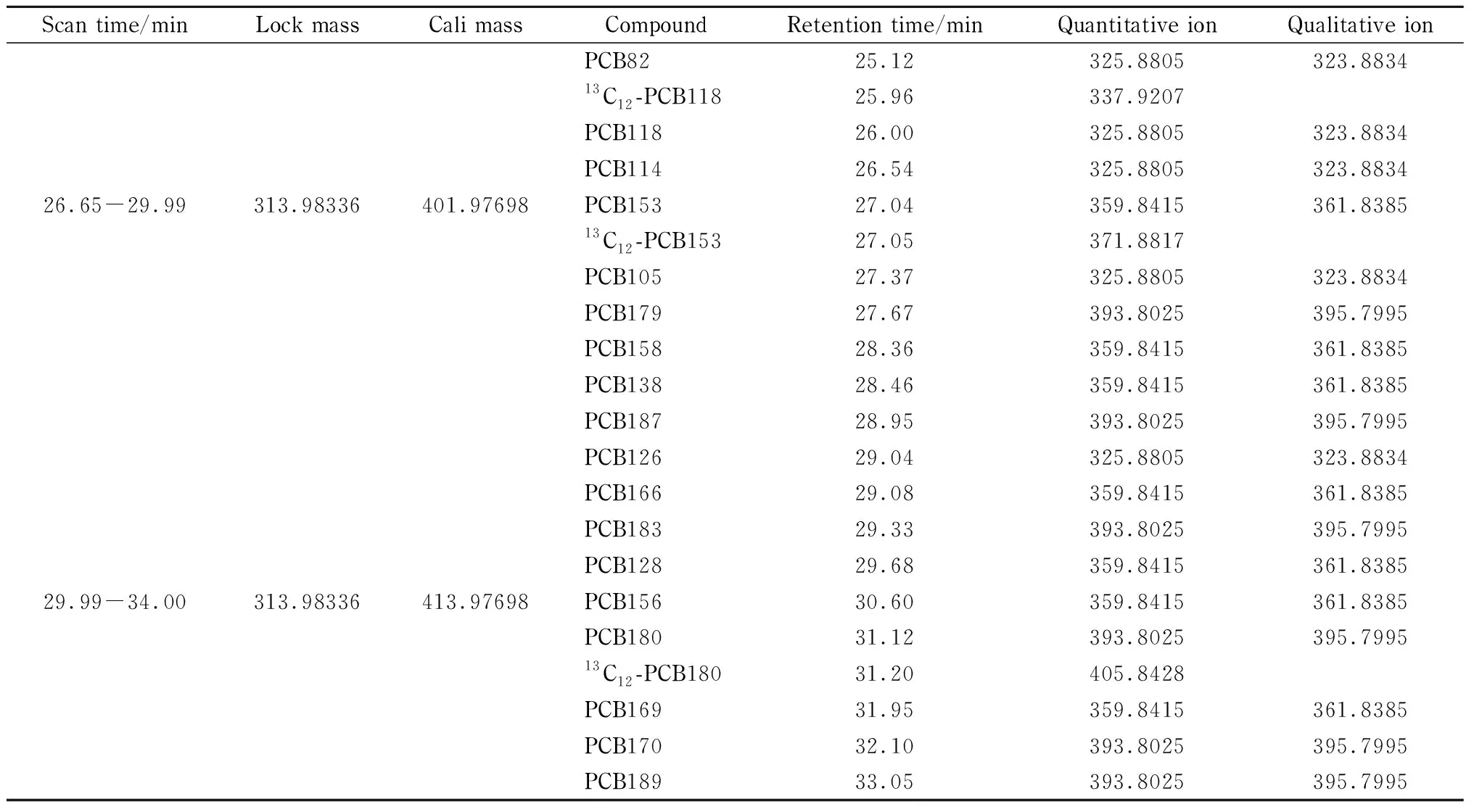
表 1 (续)Table 1 (Continued)
1.4.2 气相色谱-串联质谱
气相色谱条件:同1.4.1节。
质谱条件:电子轰击离子源(EI),离子源电压:70 eV;离子源温度:260 ℃;溶剂延迟时间:10 min;全扫描(Full-Scan)模式,扫描离子范围:m/z50~450。
1.5 计算
定量方法采用内标法,首先用回收率内标计算样品中定量内标的回收率:用13C12-PCB101作为13C12-PCB28、13C12-PCB52、13C12-PCB118、13C12-PCB153和13C12-PCB180的内标,样品中定量内标的回收率应在60% ~120%之间。样品中定量内标的回收率满足要求后,再用定量内标计算样品中每个待测PCBs的含量。每族PCBs使用一个相同氯代程度的同位素内标物作为定量内标:三氯联苯用13C12-PCB28、四氯联苯用13C12-PCB52、五氯联苯用13C12-PCB118、六氯联苯用13C12-PCB153、七氯联苯用13C12-PCB180作为内标。
2 结果与讨论
2.1 气相色谱-高分辨质谱条件的建立
32种PCBs标准溶液(20 μg/L)和6种同位素内标(20 μg/L)的总离子流色谱图见图1。表1列出了32种PCBs和6种同位素内标的保留时间。

图 1 32种多氯联苯(20 μg/L)和6种同位素内标(20 μg/L)标准溶液的总离子流色谱图Fig. 1 Total ion current chromatogram of standard solutions of 32 PCBs (20 μg/L) and 6 isotope internal standards (20 μg/L)
2.2 ASE条件的优化
2.2.1 吸附材料的选取
动物性样品经萃取后,需要把共提的脂肪杂质分离除去,然后测定。Björklund等[14]采用加速溶剂萃取法从猪油、鱼肝油等含脂肪样品中提取多氯联苯时发现:当脂肪/脂肪吸附剂质量比为1∶40时,弗罗里硅土、碱性氧化铝、中性氧化铝、酸性氧化铝和酸性硅胶这5种类型的脂肪吸附剂均能较好的吸附脂肪,因此,为省去萃取后的净化步骤,本实验针对水产品的基质特点,选用价格较为廉价的中性氧化铝作为脂肪的吸附剂。另外,选用弗罗里硅土作为色素的吸附剂,用无水硫酸钠作为水的吸附剂。本实验将吸附剂、石英砂和样品一起加入到萃取管中,并做未加吸附剂对比实验,结果表明,加入吸附剂,萃取液在浓缩后,旋蒸管中未见明显油状物,而未加吸附剂时,黄色油状物非常明显,且浓缩所需时间较长。因此,本方法可在提取PCBs时,达到同步净化的目的。

图 2 萃取溶剂对5种13C12-PCBs回收率的影响Fig. 2 Effects of extraction solvent on the recoveries of the five 13C12-PCBs
2.2.2 萃取溶剂的影响
大量研究表明,丙酮、二氯甲烷和正己烷等相互混合溶剂对PCBs的萃取效果优于单独使用正己烷等溶剂[12]。为避免样品本底值对分析结果的影响,本文以13C12-PCB28、13C12-PCB52、13C12-PCB118、13C12-PCB153和13C12-PCB180作为分析对象,以13C12-PCB101作为内标,分别对不同溶剂的萃取效率进行研究,结果见图2。由图2可看出,正己烷-丙酮(体积比1∶1)、二氯甲烷-丙酮(体积比1∶1)、二氯甲烷-正己烷(体积比1∶1)的提取效果没有明显差异,但均比单一使用二氯甲烷、丙酮和正己烷的效果要好。在净化效果的影响上,使用丙酮后,提取液浓缩后有较明显的油状物,这主要是丙酮的极性较强,降低了脂肪吸附剂吸附脂肪的能力[15],故最终选择二氯甲烷-正己烷(体积比1∶1)为提取溶剂。
2.2.3 萃取温度的影响
ASE温度一般选择在80~120 ℃之间,在其他萃取条件相同的情况下,以萃取温度为变量,分别考察80、100和120 ℃ 3个温度水平对提取效果的影响,3次平均结果见图3。由图3可知,几种同位素内标的回收率随着萃取温度的升高而呈现先升高后平缓的趋势,这主要是因为,温度的升高不仅可以提高PCBs在萃取溶剂中的溶解度,还能够降低萃取溶剂的黏度和表面张力,这样就能使溶剂快速渗透到样品基质中,加大PCBs的扩散速率,从而使提取效果变好[13]。然而,过高的温度会降低脂肪吸附剂吸附脂肪的能力[15]。综上考虑,选择100 ℃作为PCBs的萃取温度。

图 3 萃取温度对5种13C12-PCBs回收率的影响Fig. 3 Effects of extraction temperature on the recoveries of the five 13C12-PCBs

图 4 萃取循环次数对5种13C12-PCBs回收率的影响Fig. 4 Effects of extraction cycles on the recoveries of the five 13C12-PCBs
2.2.4 循环次数的影响
在其他萃取条件相同的情况下,以循环次数作为变量,分别考察1、2和3次循环对提取效果的影响,由图4可知,采用循环2次提取可使回收率提高8% ~18% ,循环3次与循环2次的提取效果差别不大,而增加1次循环会增加萃取时间约20 min、溶剂约30 mL,因此选定循环2次操作。
2.3 净化方式的优化
虽然加速溶剂萃取仪中吸附剂对样品具有较强的净化能力,但仍有微量的脂肪和少量的色素和其他杂质未除去,因此需要进一步净化。考虑到PCBs具有高度耐酸的能力[18]和浓硫酸净化的便捷性,本文采用硫酸净化法。但由于浓硫酸具有强氧化性,若浓硫酸一次性加入量过大,会使PCBs发生氧化反应,从而降低PCBs的回收率。因此本研究采用多次少量加入浓硫酸净化的方式,直至待净化层溶液没有颜色。实验中一般加入2次硫酸、每次0.5 mL可以达到净化效果。从图5可知,空白海鲈鱼样品经硫酸净化和不经硫酸净化的GC-MS总离子流图有明显的差异,硫酸净化后峰的个数和强度明显的降低,这说明硫酸对于样品中的其他杂质有较好的去除作用。采用空白海鲈鱼加标(20 ng/kg)比较采取硫酸净化和不采取硫酸净化对回收率的影响,硫酸净化前后32种PCBs回收率范围分别为85.3%~118.7%和80.5%~115.3%,表明硫酸净化对回收率的影响较小。因此,用硫酸进一步净化过程,操作简单,无需复杂的固相萃取步骤,且成本低廉、溶剂使用量少,适用于大批量样品的快速处理。

图 5 海鲈鱼样品经硫酸净化和不经硫酸净化的GC-MS总离子流图Fig. 5 GC-MS total ion chromatograms of sea bass samples after sulfuric acid purification and without sulfuric acid purification
2.4 线性范围和检出限
将PCBs系列标准溶液(0.1、0.5、1、2、5、10、20 μg/L)进样,利用同位素内标法进行定性、定量分析。试验采用同位素稀释法的相对响应因子对目标物进行定性、定量分析。通过各目标化合物及同位素内标的相对保留时间、特征离子及特征离子峰间的同位素比值进行定性分析。通过提取内标对目标物进行定量分析,计算出32种目标物和5种13C定量内标的平均相对响应因子(RRF)及其相对标准偏差(RSD),结果见表2。标准曲线的线性范围在0.1~20 μg/L 之间,RRF的RSD值均小于15% (n=7),表明各PCBs的RRF结果稳定,定量可以采用平均RRF进行计算。
采用加标回收的方法,以信噪比为3(S/N=3)确定检出限(LOD),以S/N=10确定定量限(LOQ),结果见表2。结果显示,32种PCBs的定量限为0.3~1.9 ng/kg。《食品安全国家标准食品中指示性多氯联苯含量的测定》[17]采用气相色谱-四极杆质谱法或气相色谱-离子阱质谱法测定食品中的PCBs,多氯联苯的定量限为0.5 μg/kg,本方法采用GC-HRMS的定量限比GB 5009.190-2014中的定量限降低了2~3个数量级,说明本方法具有很高的灵敏度。
2.5 回收率和精密度
在优化后的实验条件下,分别选择脂肪含量较少的草鱼(含量3.50% )和脂肪含量较多的海鲈鱼(含量18.52% )做加标回收试验,3个添加水平分别为5、20和50 ng/kg,每个水平做6个平行样,得到的回收率和精密度数据见表3。在低、中、高3个添加水平下,32种PCBs的平均回收率为71.9% ~119.0% ,RSD为3.5% ~19.6% ,表明方法的准确度和精密度均能达到满意结果。
2.6 实际样品测定
采用本文方法对湖北省常见水产品(包括草鱼、鲫鱼、武昌鱼、财鱼、黄鳝等)进行了分析测定,在所有水产品中均检出多个PCBs单体,32种PCBs的含量总和在0.51~8.9 μg/kg 之间。我国《食品安全国家标准食品中污染物限量》[19]中PCBs的限量指标以7种指示性PCBs的总和计,水产动物及其制品<0.5 mg/kg。湖北省常见水产品中PCBs的检出量均没有超出国家标准限值。
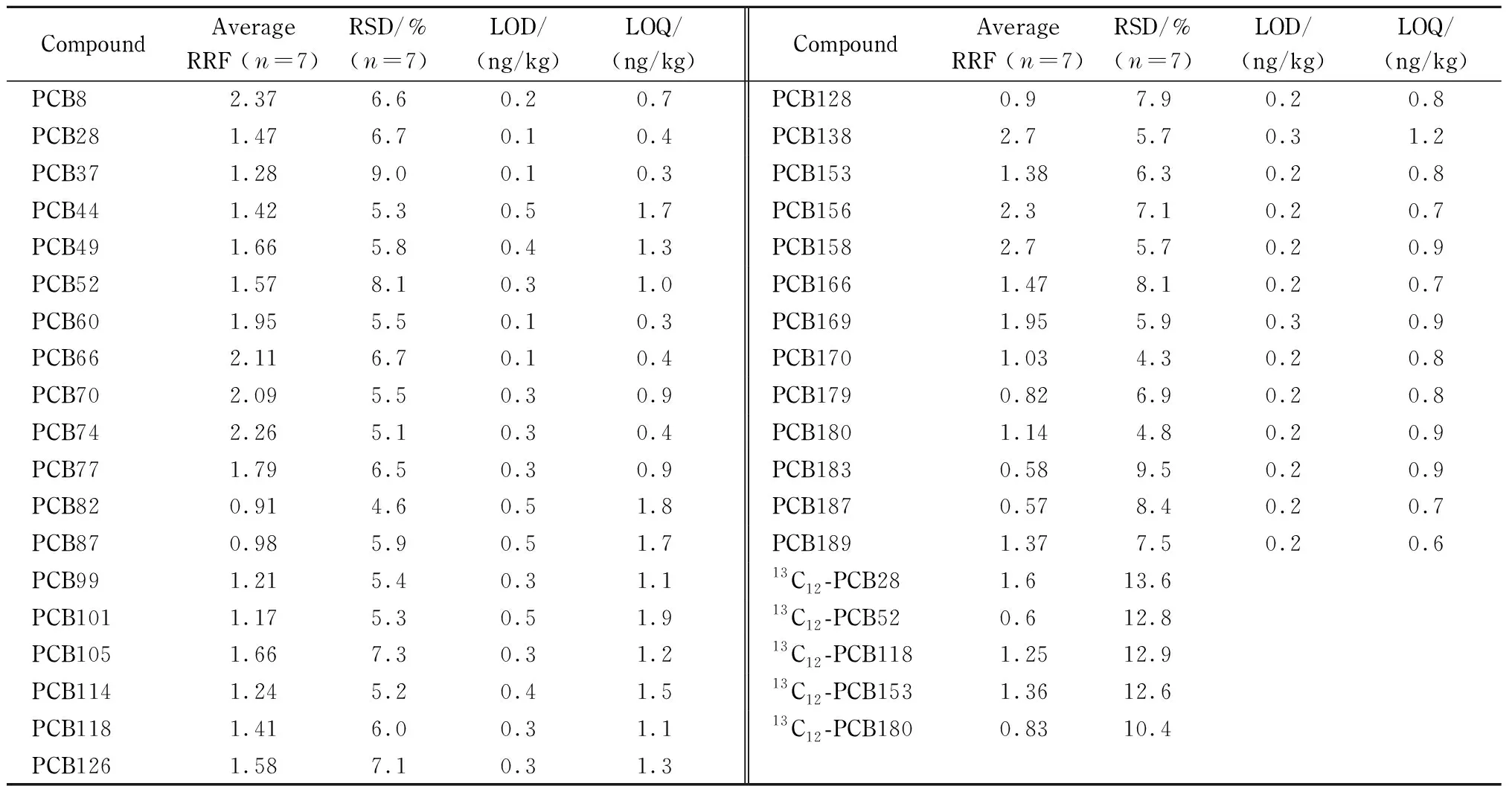
表 2 多氯联苯标准溶液的相对响应因子平均值及RSD、检出限及定量限Table 2 Average relative response factors (RRF), relative standard deviations (RSDs), limits of detection (LODs)and limits of quantitation (LOQs) for PCBs standard solution
RRF: relative response factor.
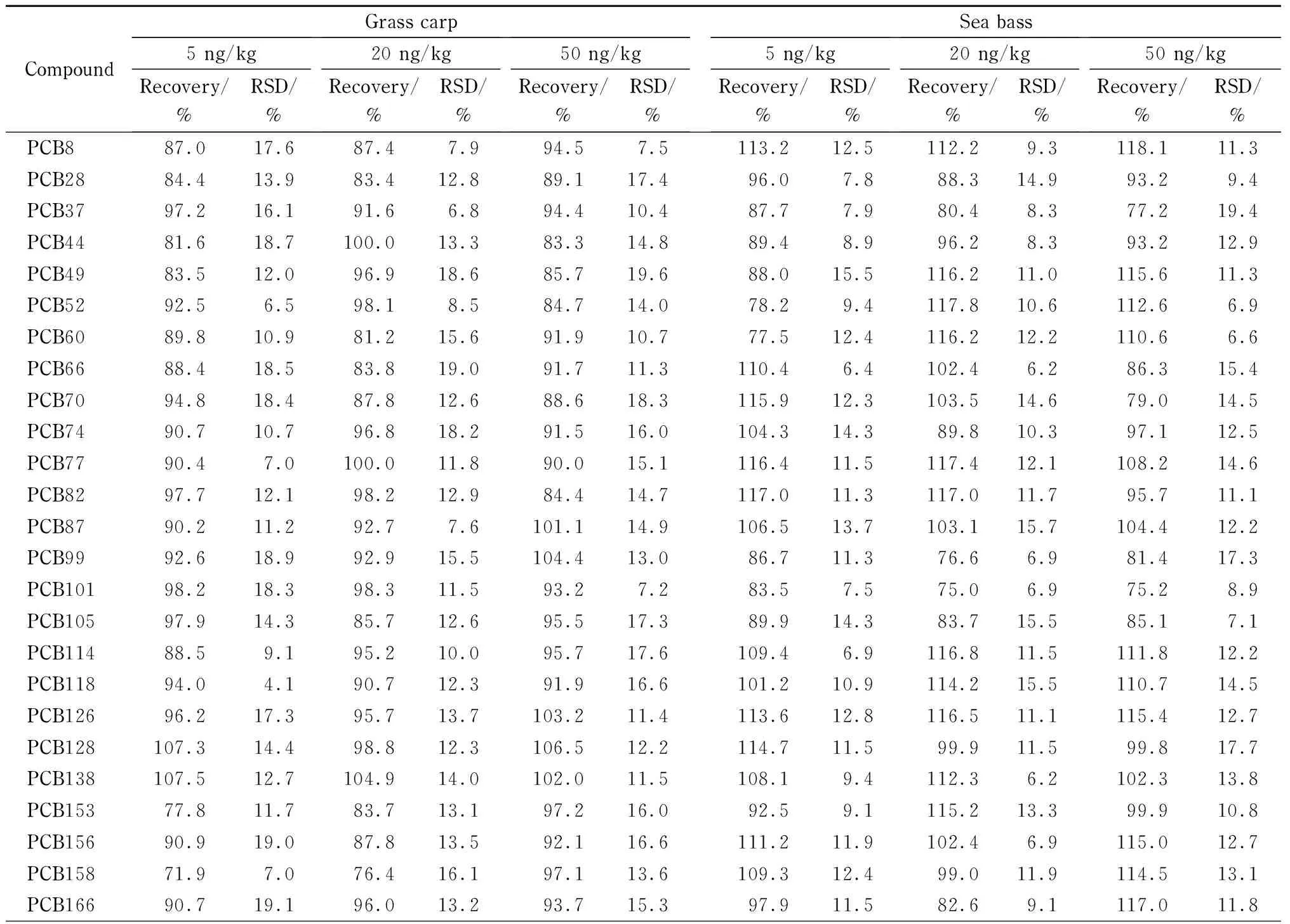
表 3 草鱼和海鲈鱼中32种多氯联苯的加标回收率和RSD(n=6)Table 3 Spiked recoveries and RSDs of the 32 PCBs in grass carp and sea bass (n=6)

表 3 (续)Table 3 (Continued)
3 结论
本工作建立了加速溶剂萃取同步净化-同位素内标-气相色谱-高分辨质谱测定水产品中32种多氯联苯的方法,将水产品中多氯联苯的萃取和净化合二为一,有效去除脂肪和提高萃取效率,且采用同位素内标法定量,显著提高了准确性;另外,利用气相色谱-高分辨质谱作为检测手段,灵敏度得到显著提高。该方法具有背景干扰低、灵敏度高、重现性好、回收率稳定等特点,能够满足国内外对水产品中PCBs的检测要求。

