杂质吸附型净化结合超高效液相色谱-串联质谱法同时测定谷物和动物饲料中37种霉菌毒素
王瑞国, 郭丽丽, 王培龙, 苏晓鸥*, 宋志超, 林 刚, 朱荣华
(1. 中国农业科学院农业质量标准与检测技术研究所, 农业部农产品质量安全研究重点实验室, 北京 100081; 2. 河南省兽药饲料监察所, 河南 郑州 450008; 3. 奥特奇生物制品(中国)有限公司, 北京 100600)
霉菌毒素(mycotoxins)由霉菌在生长或生殖过程中产生[1],种类多达数百种[2],且化学性质稳定[3],是当前全球普遍关注的一类食品危害物[4]。霉菌对农作物的污染几乎无处不在,并且在谷物田间生长和加工储存等各个环节都可能产生霉菌毒素[5]。谷物及其加工副产物是动物饲料的主要原料,由于霉菌毒素在谷物加工过程中的浓缩效应,饲料与一般谷物食品相比更容易受到霉菌毒素污染[6]。某些种类的霉菌毒素还能够通过“饲料→养殖动物→动物性食品”残留对人类健康造成威胁[7]。目前,饲料行业关注的霉菌毒素主要包括黄曲霉毒素、脱氧雪腐镰刀菌烯醇、T-2毒素和玉米赤霉烯酮等数十种,可导致动物生产性能下降、繁殖力降低、免疫力低下和呕吐、腹泻、器官坏死等慢性和急性中毒症状[8]。鉴于霉菌毒素对人类健康的风险,世界卫生组织将霉菌毒素纳入食品安全体系重点监测内容[9],我国也对食品和饲料中黄曲霉毒素、脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、T-2毒素、赭曲霉毒素A、展青霉素、伏马毒素等规定了最高限量标准[10,11]。
谷物和动物饲料中霉菌毒素检测方法可以分为快速筛查和确证检测两大类。其中,快速筛查方法包括酶联免疫试剂盒[12]、胶体金试纸条[13]、荧光定量试纸卡[14]和适配体传感器法[15]等,具有简单、快速、成本低廉等特点,但存在一定的假阳性和假阴性,难以准确定量。确证检测方法主要有高效液相色谱法和液相色谱-串联质谱法(LC-MS/MS)等,其中LC-MS/MS方法由于具有定性和定量准确、灵敏度高、多组分同步检测等优点,是当前食品和饲料中霉菌毒素确证检测的主流方法[16]。样品前处理技术是霉菌毒素LC-MS/MS检测的关键步骤,主要包括免疫亲和法[17]、固相萃取[18]、QuEChERS[19]等,这些方法虽然能够有效去除样品中的杂质干扰,但存在操作复杂、费时耗力等缺点。近年来,通过杂质吸附原理进行净化的技术逐渐兴起,以多功能柱为代表,该方法不需要柱活化、淋洗和洗脱等步骤,具有操作简单、检测通量高等显著优点[20],已经成功应用于食品[21]和饲料[22,23]样品中多种霉菌毒素的同步检测。
本研究采用一种国产新型杂质吸附型固相萃取柱MLJ-1对谷物和饲料样品进行净化,结合超高效液相色谱-串联质谱,同时测定37种霉菌毒素。传统的固相萃取或QuEChERS净化方法需要多个步骤操作,而本方法仅需要对样品提取液“一步”过滤,即可完成样品净化过程,极大地节约了样品前处理时间,提高了检测效率。同类技术[21-23]一次测定5~26种霉菌毒素,而本方法可同时测定37种毒素,扩大了检测目标物范围。同时,通过优化流动相和进样方法,保证了方法灵敏度和准确度,为谷物和饲料中多种霉菌毒素的同步测定提供了一种简单快速、准确可靠的方法。
1 实验部分
1.1 仪器、试剂与材料
XEVO TQ-S超高效液相色谱-电喷雾电离源-串联质谱仪(美国Waters公司); RVC 2-18台式离心浓缩仪(德国CHRIST公司); N-EVAP-112型氮吹仪(美国Organomation公司); 3K15高速冷冻离心机(美国Sigma公司); VX-Ⅲ多管涡旋振荡器(北京踏锦科技有限公司); Milli-Q超纯水系统(美国Millipore公司)。
37种霉菌毒素标准品见表1,纯度除伏马毒素B3(≥95% )、α-玉米赤霉醇(≥97% )、β-玉米赤霉醇(≥97% )外,其他均≥98% ;杂色曲霉素、麦角柯宁碱、蛇形菌素、新茄病镰刀菌烯醇、腾毒素、疣孢青霉原、青霉震颤素A、娄地青霉素C、黄绿青霉素等购于以色列Fermentek公司,其他购于美国Sigma公司。乙腈、甲醇、乙酸铵和甲酸(色谱纯,美国Fisher公司); MLJ-1杂质吸附型固相萃取柱(2.5 mL, 0.4 g,北京六角体公司); 0.22 μm尼龙滤膜(天津艾杰尔公司);实验用谷物和动物饲料等样品由国家饲料质量监督检验中心(北京)惠赠。
1.2 标准溶液的配制
根据限量要求和化合物在仪器上的响应情况,将37种霉菌毒素分为A、B、C 3组(分组信息见表1), A组和B组用乙腈、C组用乙腈-甲醇(1∶1, v/v,下同)将单一霉菌毒素标准品配制成质量浓度为100 mg/L 的标准储备液;再分别移取适量A组、B组和C组标准储备液用乙腈配制成质量浓度分别为0.5、5、10 mg/L 的全混合标准溶液;进一步用乙腈稀释,配制全混合标准系列工作液,待测物的质量浓度分别为:A 组为0.5、2.0、5.0、10、15和25 μg/L;B 组为5、20、50、100、150和250 μg/L;C 组为10、40、100、200、300和500 μg/L。
1.3 样品前处理
1.3.1 提取
称取粉碎并过0.42 mm分样筛的试样5 g(精确至0.01 g)于50 mL离心管中,准确加入20 mL 84%乙腈提取液(含0.1%(体积分数,下同)甲酸),涡旋混匀,振荡提取20 min,于 8 000 r/min 离心5 min,立即移取上清液,备用。
1.3.2 净化
将微孔滤膜连接到MLJ-1杂质吸附型固相萃取柱的出口端,准确移取1 mL上清液加载到萃取柱上,施加正压使过柱速度保持在约1滴/s,收集全部滤液于进样小瓶中,UPLC-MS/MS测定。
1.3.3 基质匹配混合标准系列溶液制备
选取类型相同、均匀一致且在待测物保留时间处的仪器响应值小于方法检出限30%的饲料样品作为空白样品,按1.3.1节提取步骤,得到空白基质提取溶液。准确移取1 mL全混合标准系列工作液,于60 ℃真空浓缩或氮吹至近干,加入1 mL空白样品提取溶液,涡旋使之充分溶解。再按1.3.2节净化步骤操作,得到基质匹配混合标准系列溶液。
1.3.4 标准加入法试样溶液制备
无法得到理想的空白样品时,可采用标准加入法进行定量。先从全混合标准系列工作溶液中选择两个不同的质量浓度点(约为试样中估算质量浓度的1~5倍)的溶液各1 mL,于60 ℃真空浓缩或氮吹至近干,分别加入1 mL试样提取溶液,涡旋混匀,然后另取一份1 mL试样提取溶液,再分别按1.3.2节净化步骤操作,得到3份待测试样溶液。
1.4 UPLC-MS/MS分析条件
液相色谱条件:Acquity UPLC BEH RP18色谱柱(100 mm×2.1 mm, 1.7 μm,美国Waters公司);流动相A: 0.1 mmol/L 乙酸铵溶液(含0.1%甲酸);流动相B:甲醇溶液(含0.1%甲酸);柱温40 ℃;流速0.3 mL/min;进样体积0.5 μL。梯度洗脱程序:0~2.0 min, 95%A; 2.0~4.0 min, 95%A~80%A; 4.0~12.0 min, 80%A~5%A; 12.0~12.1 min, 5%A~1%A; 12.1~13.0 min, 1%A; 13.0~13.5 min, 1%A~95%A; 13.5~15.0 min, 95% A。
质谱条件:玉米赤霉烯酮、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮、α-玉米赤霉醇和β-玉米赤霉醇为电喷雾负离子(ESI-)模式,其他目标物为电喷雾正离子(ESI+)模式;毛细管电压:ESI+, 0.6 kV, ESI-, 2.5 kV;离子源温度:150 ℃;脱溶剂温度:450 ℃;脱溶剂气和锥孔气均为N2;脱溶剂气流速:1 000 L/h;锥孔气流速:40 L/h;采用多反应监测(MRM)模式,母离子、子离子、锥孔电压(CV)、碰撞能量(CE)等参数见表1。
2 结果与讨论
2.1 质谱条件的优化
以甲醇-水(50∶50)为流动相,采用结合(combine)进样方式,应用仪器自带的Masslynx软件IntelliStart功能对目标化合物离子化方式、子离子及对应的最佳锥孔电压和碰撞能量等参数进行自动优化。其中,正电离模式下获得[M+H]+、[M+NH4]+或[M+Na]+,负电离模式下获得[M-H]-。选择响应值高、质荷比大且背景干扰低的2个子离子作为定量和定性离子。离子源温度和毛细管电压对目标物相应强度影响显著,考察目标物在不同离子源温度(350~500 ℃)和锥孔电压(±0.5~±2.5 kV)范围的响应值,发现离子源温度450 ℃, ESI+ 0.6 kV/ESI- 2.5 kV时,平均响应值最佳。此外,根据目标物色谱保留时间分段采集信号,每个化合物采集时间为RT±0.4 min,不采集时设置进样状态为“waste”,避免样品进入质谱,从而有效降低样品基质对质谱的污染。
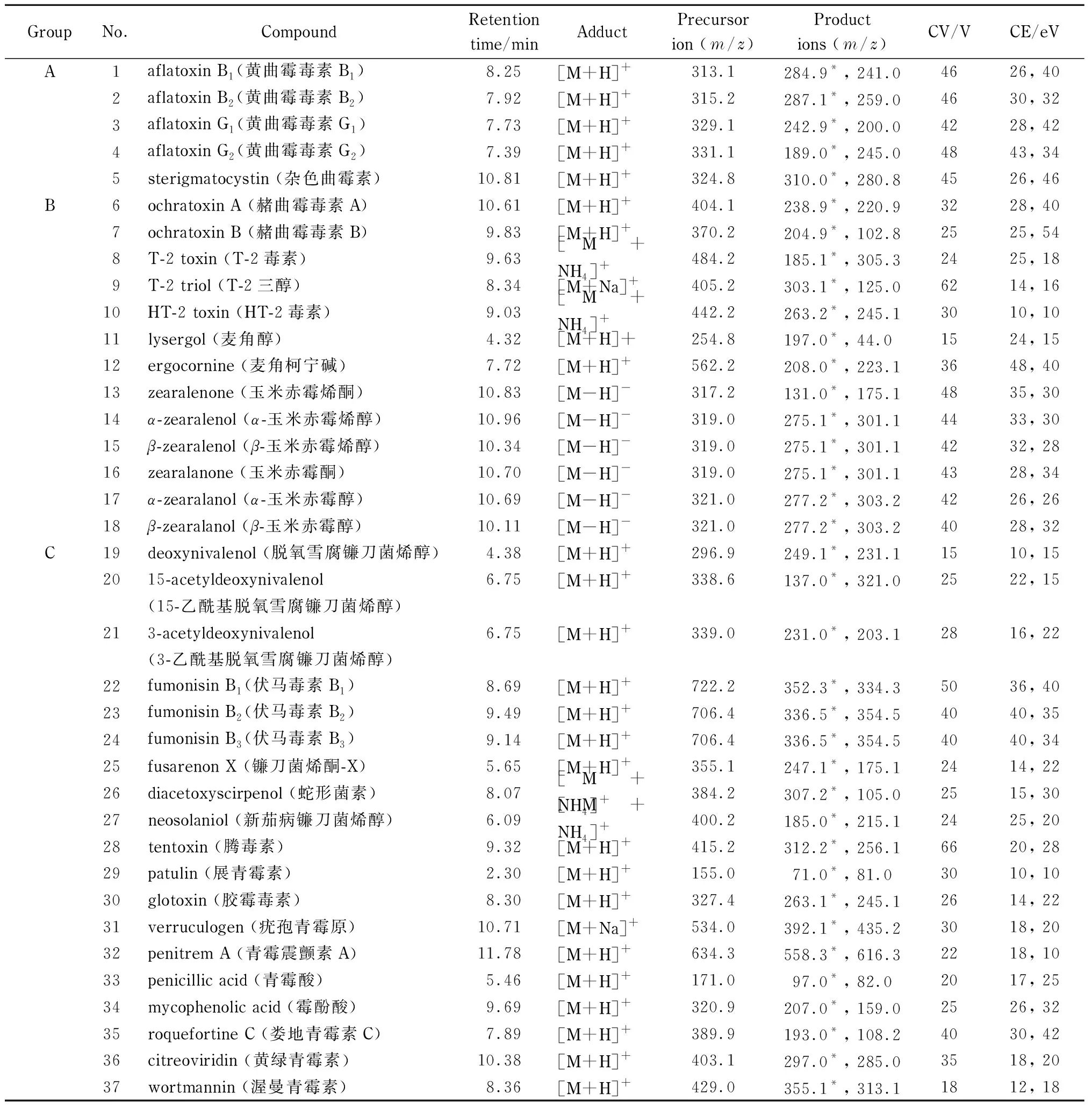
表 1 37种霉菌毒素的保留时间、加合方式、母离子、子离子、锥孔电压和碰撞能量Table 1 Retention times (RTs), adducts, precursor ions, product ions, cone voltages (CVs)and collision energies (CEs) of the 37 mycotoxins
*Quantification ion.
2.2 色谱条件的优化
本方法进样液中含有84%的乙腈,部分目标物色谱峰的溶剂效应明显,表现为峰变宽、分叉、拖尾,峰面积重复性降低。本课题组前期研究已经发现,降低进样体积可有效消除溶剂效应,优化的进样体积为0.5 μL,可同时获得良好的峰形和响应强度,具体数据可参见文献[20]。

图 1 37种霉菌毒素(50 μg/L)在两种流动相体系下的峰面积比较Fig. 1 Comparison of peak areas of the 37 mycotoxins (50 μg/L) with two different mobile phase systemsNos. are consistent with those of mycotoxins in Table 1.
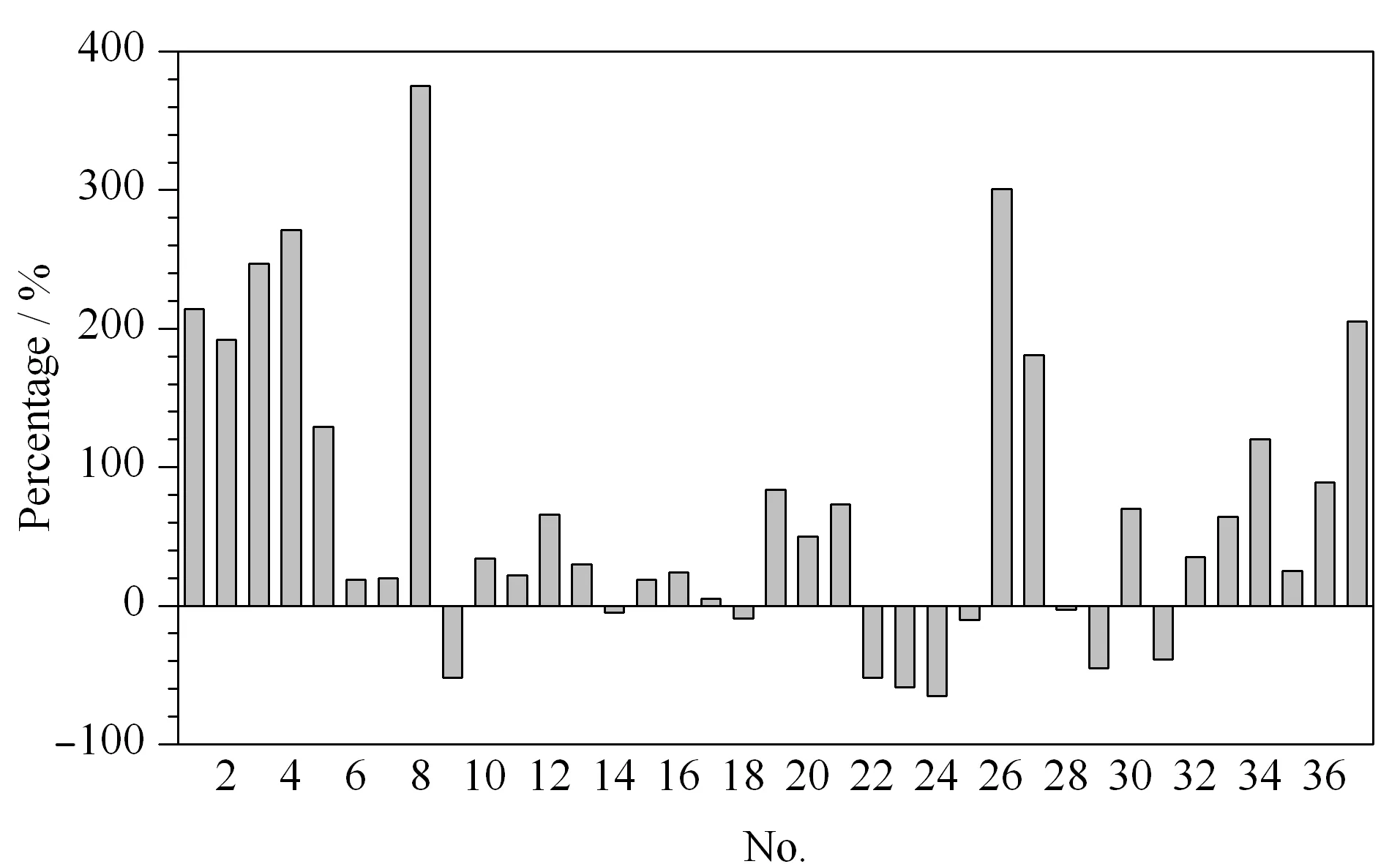
图 2 流动相中添加0.1 mmol/L 乙酸铵对37种霉菌毒素(50 μg/L)峰面积的影响Fig. 2 Effect of 0.1 mmol/L ammonium acetate in mobile phase on the peak areas of the 37 mycotoxins (50 μg/L) Percentage=(A1 -A0)/A0×100% , where A1 is the peak area of the analyte with 0.1 mmol/L ammonium acetate in mobile phase, and A0 is the peak area of the analyte without ammonium acetate in mobile phase.Nos. are consistent with those of mycotoxins in Table 1.
流动相的组成、配比和洗脱梯度不但影响目标化合物的色谱行为,还对目标化合物离子化效率和方法灵敏度有着很大影响。本研究首先考察了0.1%甲酸水/乙腈体系和0.1%甲酸水/甲醇体系对37种霉菌毒素色谱分离和相应强度的影响。结果发现,各种化合物在乙腈和甲醇体系下均能正常出峰,但响应强度存在很大差异(见图1)。乙腈作为流动相时洗脱强度大,对同分异构体及目标物与样品基质中的干扰杂质分离度较甲醇差,而且甲醇的价格较乙腈低廉。因此,本研究选用甲醇作为流动相成分。进一步研究发现,流动相中添加乙酸铵对黄曲霉毒素、T-2毒素等大部分霉菌毒素响应值具有显著增强作用,对伏马毒素等少数毒素有抑制作用,但是流动相中较高浓度的乙酸铵会导致部分目标物峰形变差。流动相中添加0、0.05、0.1、0.5、1.0 mmol/L 乙酸铵的优化结果显示,添加0.1 mmol/L 乙酸铵既能保证良好的峰形又能增强大部分目标物的响应强度(见图2)。优化条件下的37种霉菌毒素总离子流色谱图见图3。
研究过程中还发现,赭曲霉毒素A、B和伏马毒素B1、B2、B3易在仪器进样针残留,通常采用的洗针液乙腈-水(90∶10)无法有效去除,残留量可达到10% ~20% ,从而对随后的样品产生污染。比较不同溶剂和配比的洗针液,发现甲酸-甲醇-水(5∶85∶10)清洗30 s能够有效去除赭曲霉毒素和伏马毒素在进样针上的残留。

图 3 37种霉菌毒素(50 μg/L)的定量离子色谱图Fig. 3 Quantitative ion chromatograms of the 37 mycotoxins (50 μg/L)Nos. are consistent with those of mycotoxins in Table 1.
2.3 样品前处理
现有的霉菌毒素标准[24]和文献[25]中,84%乙腈水溶液常被用于多种霉菌毒素同步测定的提取溶液。提取溶液中添加有机酸可以保持稳定的pH值,有利于提高回收率。因此,本研究采用84%乙腈(含0.1%甲酸)作为样品提取溶液,对伏马毒素B1、B2、B3以外的目标物回收率能够达到60%以上,但对于谷物中伏马毒素的回收率只有40% ~60%左右,饲料特别是蛋白类饲料中伏马毒素的回收率低至10%以内。研究发现,提高提取溶液中水的比例能够显著提高伏马毒素的回收率,采用50%乙腈(含0.1%甲酸)时,谷物中伏马毒素的回收率达到90% ~110% ,饲料中伏马毒素回收率达到60%以上。但是,随着提取溶液中水的比例增加,样品基质中共提取的杂质含量也大幅度提高,增加了样品净化的难度,降低了检测灵敏度。因此,从方法实用性的角度出发,本研究仍然采用84%乙腈(含0.1%甲酸)作为样品提取溶液。

图 4 MLJ-1净化玉米提取溶液实物效果图Fig. 4 Example of extracted solution from corn sample purified by MLJ-1 cartridge
由于霉菌主要侵染在谷物和饲料的表面,相对于样品内源性成分而言,霉菌毒素属于比较容易提取的物质。实验表明,常规的提取方式如超声或振荡20 min,即可到达霉菌毒素最大回收率。进一步增加提取时间,不但不能达到提高目标物回收率的目的,相反,会导致样品内源性杂质的大量溶出,降低检测的灵敏度和准确度。因此,应严格控制样品提取时间,避免样品与提取溶液过长时间的接触。
样品净化方面,本研究采用了一种国产新型杂质吸附型固相萃取柱MLJ-1对样品提取液进行净化。实验显示,MLJ-1净化柱能够有效吸附样品溶液中的色素和脂类物质,降低基质效应,提高检测灵敏度(见图4)。MLJ-1净化柱含有复合净化材料,通过疏水作用力、离子交换等多重机制吸附样品溶液中的杂质,对检测目标物无吸附作用,不需要活化和洗脱过程,可直接过滤后上机测定,操作简单、快速。但是,这类产品对样品溶液中杂质去除的能力有限,特别是样品提取溶液中高浓度的干扰杂质可能“穿透”净化柱,从而造成较强的基质效应。为保证检测结果的稳定、一致,本研究采用1 mL样品溶液净化,均匀一致地施加正压,使溶液的过柱速度保持在约1滴/s,收集全部滤液于进样小瓶中,能够获得满意的结果。
2.4 定量方法
质谱检测时,目标物受样品基质影响从而不可避免地产生基质效应(离子抑制或离子增强),应用同位素内标或基质匹配校准曲线可以抵消或降低基质效应对检测准确度的影响。由于霉菌毒素同位素内标价格昂贵,且只有少数几种同位素内标具有成熟的商业化产品。因此,本研究采用基质匹配校准曲线进行定量。但是,在实际中很难获得未受脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、伏马毒素等污染的谷物和饲料空白样品。对于这种情况,可以采用标准加入法,即向被测样品提取溶液中添加标准品的方式进行定量。计算方法为:以加入标准溶液的质量浓度为横坐标,对应的峰面积为纵坐标,做线性回归外推至横坐标上截距的绝对值即为样品溶液中目标物的质量浓度。

表 2 37种霉菌毒素的基质效应、定量限和线性范围和Table 2 Matrix effects, limits of quantitation (LOQs), and linear ranges of the 37 mycotoxins
Nos. are consistent with those of mycotoxins in Table 1.
2.5 方法学评价
2.5.1 基质效应
本研究采用基质标准曲线斜率与溶剂标准曲线斜率的比值评价基质效应。两者比值<0.8,并且越小说明基质抑制作用越强;比值>1.2,并且越大说明基质增强效应越强;比值介于0.8~1.2之间,则说明基质效应影响不大[26]。表2显示了37种霉菌毒素在玉米、面粉、棉粕、豆粕、猪浓缩饲料、猪配合饲料和牛精料补充料样品中的基质效应。结果表明,目标物的基质效应同时受到目标物种类和样品种类的影响,黄曲霉毒素类、赭曲霉毒素类、玉米赤霉烯酮类等约半数的目标物受基质影响较小;伏马毒素类有较强的基质增强效应;麦角柯宁碱、胶霉毒素、HT-2毒素等具有较强的基质抑制效应;同一目标物在不同样品中存在基质效应差异较大的情况。为提高检测准确度和精密度,本实验采用基质匹配曲线对方法性能的各项参数进行考察。
2.5.2 定量限和线性
根据安全限量要求和目标物在质谱上的响应强度,把37种霉菌毒素分成A、B、C 3类(见表1),分别确定定量限和线性范围(见表2)。A、B、C 3类霉菌毒素的定量限分别为2、20、40 μg/kg,并用7种不同类型的谷物和饲料空白样品做定量限浓度加标回收试验,全部能够满足信噪比>10的要求。以空白样本制备6个水平的基质加标溶液,以目标化合物定量离子的峰面积为纵坐标,质量浓度为横坐,标绘制工作曲线。37种霉菌毒素在7类典型样品基质中线性关系良好,相关系数(R2)在0.981~0.999之间。
2.5.3 回收率和精密度
取玉米、面粉、棉粕、豆粕、猪浓缩饲料、配合饲料和牛精料补充料等7种典型谷物和饲料样品,做4个水平(方法定量限及其5倍、10倍和25倍)的加标回收试验,每个水平5个平行,回收率结果见图5。结果显示,绝大部分霉菌毒素在4个添加水平下的回收率介于80% ~120%之间;伏马毒素B1、B2和B3的回收率较低且差异大,在猪浓缩饲料和牛精料补充料样品中的回收率<10% ,在豆粕和棉粕样品中的回收率介于16.6% ~32.9%之间,在玉米、面粉和猪配合饲料样品中的回收率介于43.5% ~73%之间。平行测定的标准相对偏差(RSD)结果显示,除伏马毒素B1、B2和B3的RSD最高值分别为25.8% 、22.9%和22.0%外,其他目标物的RSD均<20% 。
以上结果表明,除个别霉菌毒素受样品基质类型影响外,本方法对绝大部分目标化合物的准确性和精密度较为理想,能够满足谷物和饲料样品中37种霉菌毒素的筛查和定量检测要求。

图 5 37种霉菌毒素在7种典型样品基质中回收率结果箱式图分析(n=5)Fig. 5 Box-plot analysis of recoveries of the 37 mycotoxins in seven typical sample matrices (n=5)Nos. are consistent with those of mycotoxins in Table 1.
2.6 能力验证
应用本方法参加2016年由欧盟国家参考实验室比利时联邦农业与化学研究中心(coda-cerva)组织的国际食品和饲料中多种霉菌毒素检测能力验证(本实验室编号为L4),对2个小麦粉中11种霉菌毒素进行定量测定,除伏马毒素B1和B2结果离群外,其他8种霉菌毒素(黄曲霉毒素B1、B2、G1、G2、赭曲霉毒素A、T-2、脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮)的测定结果均为满意(|z|<2);参加2018年由上海市农业科学院和比利时公共健康研究院(Sciensano)联合的举办的亚洲和太平洋地区真菌毒素检测能力验证(本实验室编号为211),对玉米粉和大麦芽粉样品中赭曲霉毒素A、脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮等3种目标物进行同步测定,结果均为满意(|z|<2)。由此可见,除伏马毒素因回收率低仅适合于筛查外,本方法具有良好的准确性和国际实验室间的可比性,并且在检测时间、成本和适用范围上更具优势,可用作谷物和饲料中多种霉菌毒素的快速筛查和定量测定。
3 结论
本研究针对谷物和饲料易受多种霉菌毒素同时污染的现状,采用新型杂质吸附型净化技术,结合UPLC-MS/MS开发了37种霉菌毒素的同步测定方法。通过优化色谱方法、进样液体积、样品提取和净化方法等,有效提高了检测灵敏度和准确度。样品提取液直接过滤净化后上机检测,前处理操作简单、快速。检测结果经过国际霉菌毒素检测能力验证,可用作谷物和饲料中多种霉菌毒素筛查和定量测定方法。

