肺结核患者合并其他病原菌肺部感染的临床特点及危险因素分析
赵婷,孙长峰,肖科,廖 芮,黄永茂
肺结核合并其他病原菌肺部感染在临床上较为常见,也是肺结核患者反复住院的原因之一,甚至延长肺结核的治疗周期,并可促进耐药结核菌的产生,给结核病的治疗带来难度,严重影响患者预后[1]。国内关于降钙素原(PCT)对肺结核合并其他病原菌肺部感染诊断价值方面的研究颇多,本研究基于患者有呼吸道感染的新发症状及体征,同时满足WBC计数、中性粒细胞比率、PCT等感染性指标异常和/或痰检病原学阳性的患者纳入肺结核合并其他病原菌肺部感染组,并对其临床特点及危险因素进行研究,从而为临床诊治提供理论基础。
1 材料与方法
1.1 诊断及入排标准
依据《肺结核诊断和治疗指南》[2],选取西南医科大学附属医院感染科2016年7月-2019年7月收治的痰结核分枝杆菌阳性的肺结核患者。重症肺结核的诊断标准参照相关文献提出的血行播散型肺结核及肺部病变累及一侧肺野或是大于3个及以上肺野出现损害的浸润性肺结核[3]。肺结核合并其他病原菌感染的诊断依据中华医学会呼吸病学分会制定的《社区获得性肺炎诊断和治疗指南》[4]和《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)》[5]。肺结核经有效化疗,不需联合使用抗生素治疗,临床症状好转,肺部病灶有所吸收,诊断为单纯肺结核[6];有以下情况者,考虑诊断为肺结核合并其他病原菌肺部感染[7],(1)至少满足以下3项中的2项:①新出现咳嗽、咯痰或慢性咳嗽、咯痰基础上出现症状加重,伴痰液性质改变,为黄白色或绿色脓痰,且痰量增多;② 发烧(腋窝温度> 38 ℃);③肺部广泛的新增干湿性啰音。(2)至少满足以下3项中的1项:①WBC>15×109/L;②WBC(10~15)×109/L且中性粒细胞比率>0.75;③WBC<10×109/L,中性粒细胞比率>0.75且PCT >0.27μg/L[8]。(3)胸部影像学检查提示新出现的斑片状浸润影、实变或磨玻璃影、空洞内伴(或不伴)液气平等。
纳入标准:满足上述条件(1)同时,至少满足以下2项中的1项,即①细菌或真菌培养结果呈阳性;②细菌培养阴性,但肺结核常规化疗后,发热、咯痰等症状及肺部体征、感染性指标仍无显著改善,联合使用其他抗菌药物后症状显著好转,或抗结核治疗前先进行抗感染治疗,2周内病情得到明显缓解。排除标准:①合并其他系统疾病所致粒细胞减少或增加者;②入院后48 h内死亡或自动出院的患者;③合并其他系统感染者。
1.2 临床资料分析
收集临床资料,包括患者年龄、性别、体质量指数(BMI)、有无慢性基础疾病(艾滋病、糖尿病等)、有无慢性肺部疾病(慢性阻塞性肺疾病、支气管扩张、尘肺、毁损肺等)、是否抽烟、是否重症肺结核、是否结核分枝杆菌耐药、结核病病程、抗菌药物使用总疗程;常规血液检查:血常规、血清白蛋白、PCT、红细胞沉降率(ESR)、C反应蛋白(CRP);患者临床表现、胸部影像学资料、感染菌株情况、住院时间、用药情况及预后。依据诊断标准将肺结核合并肺部其他病原菌感染和单纯肺结核患者分组进行病例对照研究。
1.3 统计学方法
采用SPSS 17.0统计软件分析数据,符合正态分布的计量资料表示为均值±标准差(±s),计数资料采用率(%),不符合正态分布的计量资料用中位数及四分位数 [M(P25,P75) ]表示。计数资料及单因素分析采用卡方检验,不符合正态分布的计量资料采用Mann–Whitney秩和检验,多元危险因素分析采用二元logistic回归分析,P<0.05表明差异具有统计学意义。
2 结果
2.1 肺结核合并其他病原菌肺部感染的临床特点
满足纳入标准的痰菌阳性肺结核患者共357例,191例肺结核合并肺部其他病原菌感染为合并感染组,166例单纯肺结核为对照组,具体的临床特征比较见表1。合并感染组中,医院感染34例,重症感染12例;59例有咯脓痰表现;64例体温>39 ℃;92例肺部可闻及啰音,胸部CT均提示双肺多发混合感染,11例提示真菌混合感染,其中6例提示曲霉感染征象;178例患者WBC计数和/或中性粒细胞比率升高,2例WBC计数下降;171例PCT有不同程度的升高,其中70例PCT > 0.27 μg/ L;部分低热或体温正常患者出现WBC和PCT显著升高,少数患者PCT显著升高,但WBC计数正常或仅中性粒细胞比率升高。
2.1.1 病原菌分布及药敏结果合并感染组191例患者中,仅42.9%(82例)的患者痰培养或血培养中分离出病原菌,共91株。革兰阳性菌以葡萄球菌为主,均来自血培养,革兰阴性菌以肺炎克雷伯菌居多,真菌以白念珠菌居多,且多数为口腔或上呼吸道定植菌。见表2。20株肺炎克雷伯菌中15株对哌拉西林-他唑巴坦、头孢吡肟、阿米卡星、庆大霉素、环丙沙星、碳青霉烯类均敏感,5株(25.0%)产超广谱β内酰胺酶(ESBL),对广谱β内酰胺类、庆大霉素、四环素、左氧氟沙星、甲氧苄啶-磺胺甲唑等抗菌药物耐药。4株大肠埃希菌中有1株对四环素耐药,对广谱β内酰胺类、喹诺酮类、氨基糖苷类敏感,1株对哌拉西林-他唑巴坦、头孢吡肟、头孢西丁等部分β内酰胺类耐药,2株产ESBL,对广谱β内酰胺类、庆大霉素等药物耐药。6株葡萄球菌均对利福平、达托霉素、万古霉素、利奈唑胺等敏感,其中2株为耐甲氧西林金黄色葡萄球菌(MRSA),对阿莫西林-克拉维酸钾、氨苄西林-舒巴坦、克林霉素、红霉素、甲氧苄啶-磺胺甲唑等均耐药。
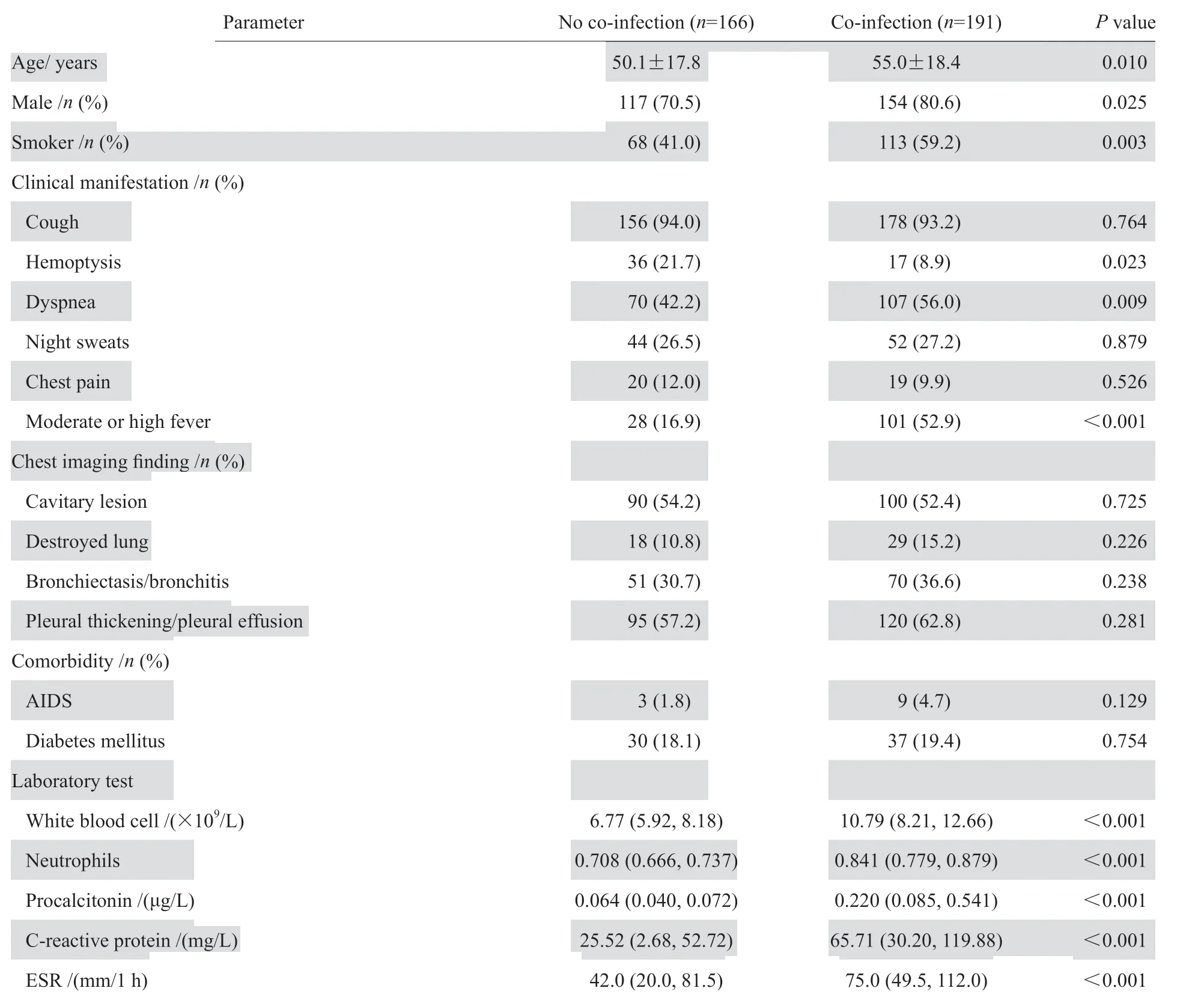
表1两组肺结核患者的临床特征比较Table 1 Clinical characteristics of pulmonary tuberculosis patients in terms of co-infection
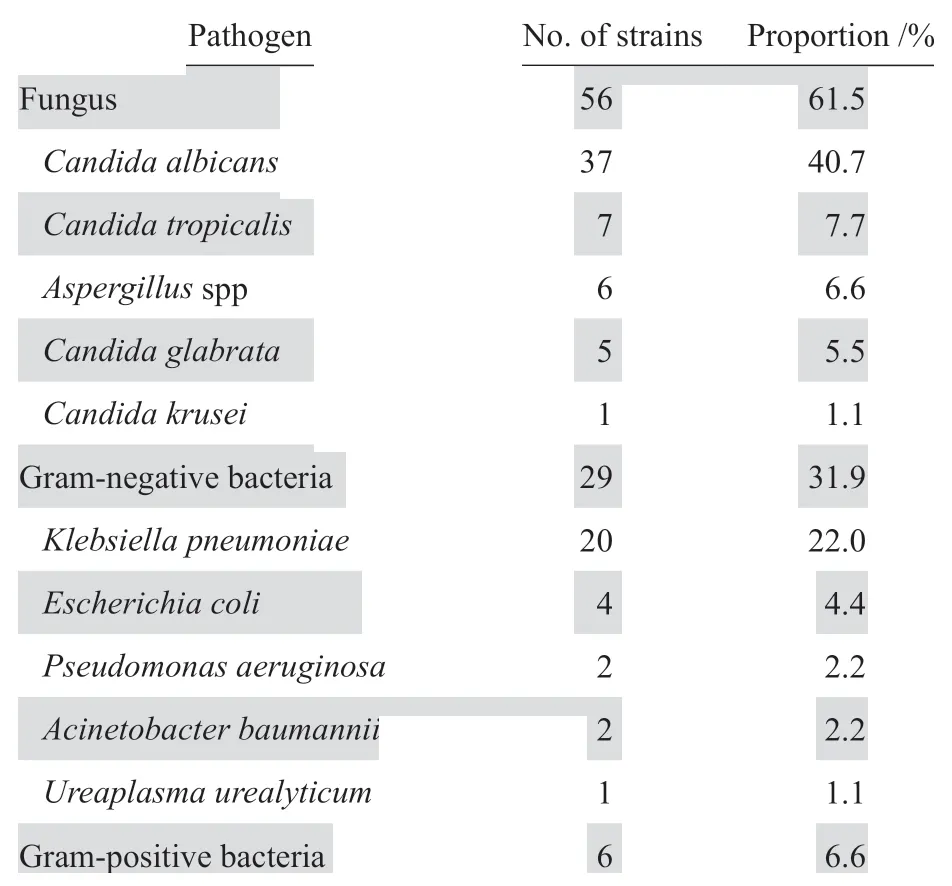
表2合并感染组病原菌种类及构成比Table 2 Pathogen distribution of coinfection in pulmonary tuberculosis patients

表2(续)Table 2(continued)
2.1.2 感染的治疗及预后抗结核治疗参照《肺结核诊断和治疗指南》[2]和《耐药结核病化学治疗指南(2015)》[9],其他病原菌抗感染治疗避免选择使用喹诺酮类、氨基糖苷类等药物。对于合并感染组患者,经验性使用覆盖革兰阴性杆菌的抗菌药物抗感染治疗,使用β内酰胺类-酶抑制剂复合制剂(如哌拉西林-他唑巴坦、头孢哌酮-舒巴坦)、第三代头孢菌素(如头孢唑肟)等,其中12例重症感染者采用碳青霉烯类(如美罗培南)治疗3~7 d后视患者病情调整抗菌药物,11例感染者考虑合并肺深部真菌感染,在上述抗感染方案基础上联合使用氟康唑或伏立康唑进行治疗。此外,合并感染组27例患者住院期间辅以激素治疗。经过广谱抗菌药物治疗1周左右,162例患者发热、咯痰症状得以控制,感染性指标显著下降,其中154例患者2周左右临床痊愈出院,5例重症肺结核合并重症肺炎患者死亡(其中4例死于严重败血症、多脏器功能衰竭,1例死于肺栓 塞)。
2.2 合并肺炎的危险因素分析
2.2.1 单因素分析单因素分析合并感染组和对照组的相关资料,表明患者年龄≥65岁、男性、吸烟、咯血、重症肺结核、使用激素、住院时间>2周、BMI<18.5 kg/m2、抗菌药物使用时间> 2周、合并慢性肺部疾病、血清白蛋白 <40 g/L在两组患者中进行单因素分析,差异有统计学意义(P<0.05)。见表1、表3。

表3肺结核合并其他病原菌肺部感染单因素分析结果Table 3 Univariate analysis of risk factors for co-infection in pulmonary tuberculosis patients
2.2.2 多因素l ogi st ic分析l ogi st ic分析显示,BMI <18.5 kg/m2、近期咯血、重症肺结核、抗菌药物使用时间>2周、血清白蛋白<40 g/L、合并慢性肺部疾病是肺结核合并其他病原菌肺部感染患者的重要危险因素。见表4。
3 讨论
肺结核抗酸杆菌阳性即开放性肺结核,老年患者多见,常伴有慢性消耗性营养不良与免疫功能下降,更容易合并肺部感染;同时,长期抗结核药物化疗与广谱抗菌药物广泛应用,易继发肺部多重耐药菌感染,影响治疗效果及预后[10]。本研究发现痰菌阳性肺结核合并其他病原菌肺部感染患者具有如下特征:①患者临床症状及影像学与单纯性肺结核相比不典型,但多数患者可有中高程度发热、咯脓痰等表现,胸部CT多数提示病灶累及3个肺野或以上的浸润性肺结核征象,部分病例感染性指标升高不一致;②合并感染组患者以社区获得性感染为主,病原菌检出率为42.9%,以肺炎克雷伯菌为主要致病菌,白念珠菌多为口腔或上呼吸道定植菌,与李晓迎等[7]、Attia等[11]研究结果一致;③检出的肺炎克雷伯菌产ESBL率为25.0%,检出的葡萄球菌普遍对利福平、达托霉素、万古霉素、利奈唑胺等敏感。有研究发现对感染性指标升高及一般基础情况差的患者,在抗结核治疗基础上短期经验性加用β内酰胺类-酶抑制剂复合制剂、第三代头孢菌素等药物,可降低肺结核合并细菌感染的院内死亡率 [12]。

表4肺结核合并其他病原菌肺部感染危险因素的logistic分析Table 4 Logistic analysis of risk factors for co-infection in pulmonary tuberculosis patients
血清白蛋白是反映机体营养状态和基础疾病严重程度的重要指标[13-14],本研究l ogi st i c多因素分析显示血清白蛋白<4 0 g/L 和消瘦(BMI <18.5 kg/ m2)是肺结核合并其他病原菌肺部感染的危险因素,这些患者感染率明显较高。重症感染患者中低白蛋白血症的发生率极高,发生机制可能与血浆白蛋白的分布异常以及分解增加相关[15]。然而,继发感染又可进一步增加机体能量消耗,加重患者营养不良,因此建议实行肠内或肠外营养支持,必要时可予以输注白蛋白以降低多重感染的发生率,或可改善合并感染患者的预后。
logistic多因素分析发现抗菌药物使用时间>2周是肺结核合并其他病原菌肺部感染的重要危险因素,首先,抗结核药物属于抗菌药物,长疗程抗结核治疗和广谱抗菌药物长期反复使用通常会引起肺部菌群失调[16],从而合并呼吸道其他病原菌感染。此外,针对合并其他病原菌肺部感染的治疗,临床上常经验性使用第三代头孢菌素、氨基糖苷类和大环内酯类等抗生素。有研究发现这些抗菌药物可导致宿主粒细胞的吞噬功能下降,导致二重感染,规律的抗结核治疗和避免长疗程抗菌药物的使用可能有助于减少肺结核合并其他病原菌感染[17]。
本研究纳入的重症肺结核多数病例为肺部病灶累及3个及以上肺野的浸润性肺结核患者,发现重症肺结核、合并慢性肺部疾病是肺结核合并其他病原菌感染的危险因素。这些患者均有肺部基础疾病,且病灶广泛,合并其他病原菌的感染进一步加剧肺部病变内的炎性环境,并可能通过多种途径限制获得性免疫反应[18],使得机体免疫功能下降,反复发生继发感染。另外,肺部合并其他病原菌感染是耐药结核形成的危险因素[19]。因此,对于慢性肺部疾病合并结核感染患者,全程督导短程化疗,避免继发肺部感染的发生,可减少耐药结核的产生。此外,既往有研究发现肺结核空洞、肺部真菌感染是大咯血的危险因素[20]。本研究同样发现咯血是肺结核合并其他病原菌感染的危险因素,这可能是由于咯血患者往往难以仅通过咳嗽反射将血完全排出体外,多积聚在肺泡内而形成“良好”的病原菌生长环境,从而引发细菌或真菌感染,因此避免慢性咯血的发生可减少肺部感染。
综上所述,肺结核合并其他病原菌肺部感染的临床表现多有中高程度发热、咯脓痰等症状,影像学表现不典型,常见致病菌以肺炎克雷伯菌为主,对于存在感染性指标升高的患者,在抗结核治疗基础上早期经验性联合使用针对革兰阴性菌的抗菌药物有利于短期内控制感染;防控结核病及肺部基础疾病的进展、合理限制抗菌药物使用疗程、加强营养支持及维持理想体重可有效减少肺结核患者合并其他病原菌肺部感染。本研究主要依据感染性指标、文献资料和回顾性治疗结果纳入缺乏病原学依据的潜在肺部感染病例,在病例选择上可能存在些许缺陷,还需进一步扩大样本量进行回顾性分析以验证以上结论的可靠性。

