白腐菌木质素降解酶高产菌株的筛选
徐安民,李 力,马 森
河南工业大学 粮油食品学院,河南 郑州 450001
小麦麸皮含有蛋白质、矿物质、维生素等多种营养物质,还富含膳食纤维,适量的小麦麸皮添加到面制品中可提高面制品的营养价值,但同时由于其口感粗糙使得面制品食用品质降低。因为小麦麸皮中,纤维素形成细胞壁的骨架,半纤维素与纤维素由氢键缔合,木质素通过醚和酯键与半纤维素相连接[1],所以对木质素的降解成为改性小麦麸皮的关键。利用微生物降解木质素是相对可行的途径,白腐菌目前是最有效、最主要的木质素降解微生物。白腐菌属于担子菌纲,腐生在木材或死树桩上,引起木质腐烂,故此得名[2]。它是整个碳素循环的中心,是已知的唯一能在纯系培养中将木质素降解成 CO2和 H2O 的一类微生物[3]。白腐菌在长期的生物进化过程中形成了一套独特的降解系统,木质素过氧化物酶(lignin peroxidase,LiP)、锰过氧化物酶(mangnase peroxidase,MnP)、漆酶(laccase,Lac)共同构成了白腐菌的木质素降解酶系[4-5]。
近年来,关于白腐菌降解木质纤维素的基础研究有很多,但主要集中在对单一菌株的产酶特性进行研究。在筛选高效降解木质素降解菌时,有些研究的筛选指标比较单一,没有较强的说服力[6],缺乏综合性。为了能全面系统地进行高效降解木质素菌株的筛选工作,笔者结合愈创木酚平板变色法、产酶比较和定量测定木质素含量的方法,从9株白腐菌中筛选出1株高效降解麦麸纤维的菌株,为筛选开发高效降解木质素工业菌株提供思路和理论基础。
1 材料与方法
1.1 试验材料
1.1.1 菌种
CICC 14121(AP1)、CICC 50017(AP2):中国工业微生物菌种保藏管理中心;CGMCC 7004(AP3)、CGMCC 7002(AP4)、CGMCC E5.95(AP5)、CGMCC E5.94(AP6):中国普通微生物菌种保藏管理中心;BNCC 336040(AP7)、BNCC 336039(AP8)、BNCC 143171(AP9):北京北纳创联生物技术研究院。
1.1.2 小麦麸皮
小麦麸皮:中鹤现代农业开发集团有限公司。小麦麸皮的前处理参照陶颜娟[7]的方法。
1.1.3 培养基
斜面固体PDA培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,pH自然,1×105Pa灭菌30 min。
种子培养基:葡萄糖20 g/L,酵母膏2 g/L,KH2PO43 g/L,MgSO4·7H2O 1.5 g/L,VB10.5 g/L,pH自然,1×105Pa灭菌30 min。
愈创木酚-PDA固体培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,KH2PO43 g/L,MgSO4·7H2O 1.5 g/L,VB10.02 g/L,愈创木酚1 g/L,pH自然,1×105Pa灭菌30 min。
液体发酵基础培养基:麦麸30 g/L,KH2PO43 g/L,MgSO4·7H2O 1.5 g/L,(NH4)2SO41.4 g,CaCl20.3 g,FeSO4·7H2O 5 mg/L,MnSO4·H2O 1.6 mg/L,VB10.02 g/L,pH自然,分装至250 mL的三角瓶中,每瓶100 mL, 1×105Pa灭菌30 min。
1.2 主要仪器与设备
TH2-D型恒温振荡器:太仓市实验设备厂;HWS 型恒温恒湿箱:宁波东南仪器有限公司;FYB101-2型电热鼓风干燥箱:上海梳理仪器有限公司;SHZ-D型循环水式真空泵:巩义市予华仪器有限责任公司;PHS-3C型精密酸度计:上海大普仪器有限公司;LS-75LJ型立式压力蒸汽灭菌锅:江阴滨江医疗有限公司;752 N型紫外可见分光光度计:上海精密科学仪器有限公司。
1.3 试验方法
1.3.1 菌种初筛
采用孙江慧[8]的方法,并略作改动。用0.1%愈创木酚加入PDA培养基中做成平板,从斜面试管培养基中挑取活化后的9株菌株,每一株菌株做2个平行,于26 ℃培养10 d。观察分析平板中菌落圈和显色圈直径的大小和菌落颜色变化。
1.3.2 粗酶液制备
用培养6 d的菌株分别定量接种,吸取摇匀的种子液10 mL加入装有100 mL液体发酵培养基的250 mL三角瓶中,每一株菌株接种2瓶,于26 ℃、160 r/min恒温摇床中培养15 d。菌种液体培养从第4天开始取样,每隔1 d取样1次,发酵液用4层纱布过滤,滤液在3 000 r/min条件下离心15 min,上清液即为粗酶液。
1.3.3 酶活的测定
漆酶酶活的测定参照Glenn 等[9]的方法。
木质素过氧化物酶酶活的测定参照Cacchio等[10]的方法。锰过氧化物酶酶活的测定参照Glenn等[11]的方法。
1.3.4 麦麸木质素降解能力的测定
分别取不同菌株的种子液10 mL,接种至含麸皮的发酵培养基中,26 ℃摇床培养15 d后,将生物预处理后的小麦麸皮过滤洗净, 60 ℃烘干至恒质量,粉碎混匀,备用。每个样品做3个平行。麦麸中木质素含量测定方法参考王玉万等[12]的检测方法。
2 结果与分析
2.1 漆酶活性的平板检验
Ander等[13]认为能在以愈创木酚为指示剂的选择培养基上产生显色圈的微生物具有降解木质素的能力,产漆酶的菌株在该培养基上长出的菌丝能产生明显的红褐色。在愈创木酚选择培养基平板上培养9株菌株10 d,每天对各平板的变色情况进行观察记录,其结果列于表1。根据菌株在平板上的生长和变色情况,可将9株菌株分为以下4种类型:(1)在平板上没有显色圈,有AP2;(2)在平板上有红褐色的显色圈,但显色圈直径与菌落圈直径比值小于1,有AP5;(3)在平板上有红褐色的显色圈,显色圈直径与菌落圈直径比值大于1,但菌株生长较稀疏,有AP1、AP4;(4)在平板上有红褐色的显色圈,显色圈直径与菌落圈直径比值大于1,菌株生长较旺盛,有AP9、AP6、AP8、AP7、AP3。图1为不同菌株在PDA显色平板上第7天时的生长情况。
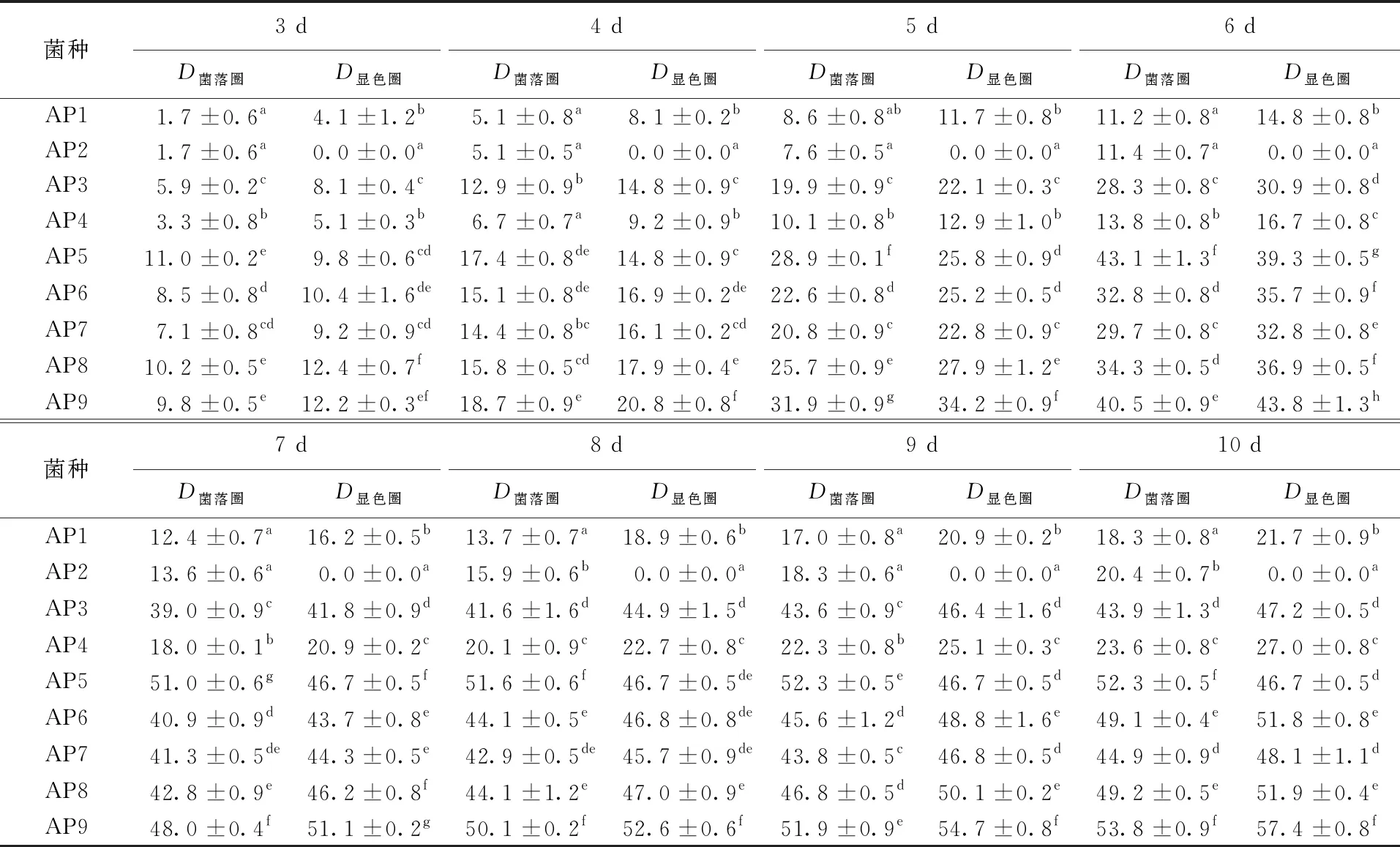
表1 不同菌株菌落圈、显色圈直径随时间的变化
注:同列不同字母表示存在显著差异(P<0.05)。
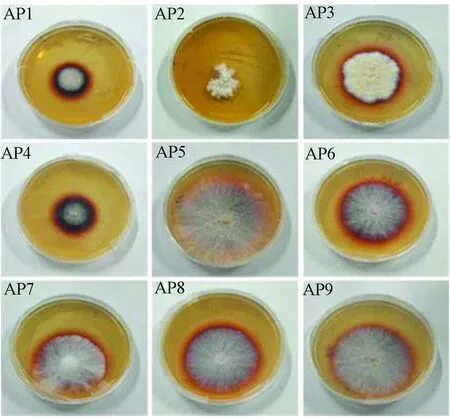
图1 不同菌株在PDA显色平板上第7天时的生长情况
Ander 等[13]认为对于白腐菌,显色圈的形成有两种:一种是显色圈在菌落的外圈形成,此时D菌落圈/D显色圈<1;另一种是显色圈在菌落的内圈形成,此时D菌落圈/D显色圈>1。Eriksson等[14]的研究表明,菌落圈与显色圈直径的比值可作为判断该菌是否能选择性降解木质素的依据,比值小于1则该菌能选择性降解木质素,比值大于1的菌则首先降解纤维素。综上所述,经过愈创木酚法定性筛选,从9株菌中共筛选出5株能产生显色圈且生长旺盛的菌株用来做后续复筛试验。
许多学者在研究木质素降解菌时仅选择一种定性筛选培养基,这样只能检测出1种或2种木质素降解酶。事实上许多研究表明,白腐真菌对木质素的降解不是依靠1种酶作用,而是几种酶共同作用的结果,主要通过木质素过氧化物酶、锰过氧化物酶和漆酶这3种酶来完成[15],而且,显色圈大小与漆酶活性的高低有必然联系但不是线性的正相关[16]。因此,本试验对木质素降解菌进行第2次筛选时,选用液体产酶试验以便综合考虑菌株产木质素降解酶的能力,获得降解木质素能力较强的白腐真菌。
2.2 木质素降解酶系酶活对比分析
2.2.1 产木质素过氧化物酶酶活的比较
用Excel对试验数据进行基本计算,Orign软件进行统计分析和作图,LSD法检验差异显著性,显著水平设置为P=0.05。由图2可知,5株白腐真菌的木质素过氧化物酶酶活曲线随时间的变化都是先升高,直到达到酶活高峰,然后开始下降。AP8、AP3 这2株菌株产木质素过氧化物酶能力最强时间都是在第7天,木质素过氧化物酶酶活分别为112.28、119.42 U/mL。AP9在第9天酶活最高,木质素过氧化物酶酶活为95.71 U/mL。AP6和AP7则是在第11天时出现酶活高峰,最高酶活分别为87.84、90.16 U/mL。5株白腐菌最高木质素过氧化物酶酶活大小顺序为AP3>AP8>AP9>AP7>AP6,5株菌株酶活最低时与酶活最高时所对应的酶活值差异显著(P<0.05)。
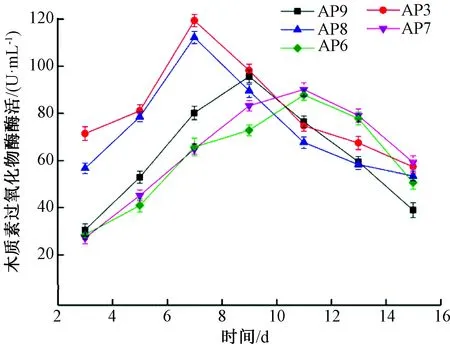
图2 菌株产木质素过氧化物酶酶活随时间的变化
2.2.2 产锰过氧化物酶酶活的比较
由图3可以看出,AP9产锰过氧化物酶出现的最高峰在第9天,锰过氧化物酶酶活为97.95 U/mL。AP8和AP3产锰过氧化物酶的最佳时间都是在第7天,最高酶活分别为116.55、124.35 U/mL。而AP6和AP7则是在第11天产酶能力最高,最高酶活分别为85.17、92.62 U/mL。5株白腐菌锰过氧化物酶最高酶活大小顺序为AP3>AP8>AP9>AP7>AP6,差异显著(P<0.05)。
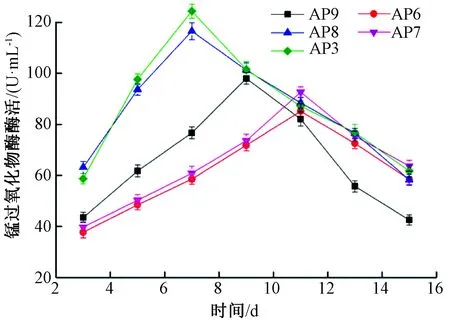
图3 菌株产锰过氧化物酶酶活随时间的变化
2.2.3 产漆酶酶活的比较
由图4可以看出,AP9、AP6、AP7产漆酶的高峰期出现在第7天,而AP8、AP3产漆酶能力最强时间出现在第9天。5株菌株产漆酶能力大小差异显著(P<0.05)。其中,AP3产漆酶能力最强,酶活为173.45 U/mL,AP6产漆酶能力最弱,酶活为141.75 U/mL。AP9和AP7产漆酶能力一般,最高酶活分别为151.67、156.95 U/mL。5株白腐菌最高漆酶酶活大小顺序为AP3>AP8>AP7>AP9>AP6。
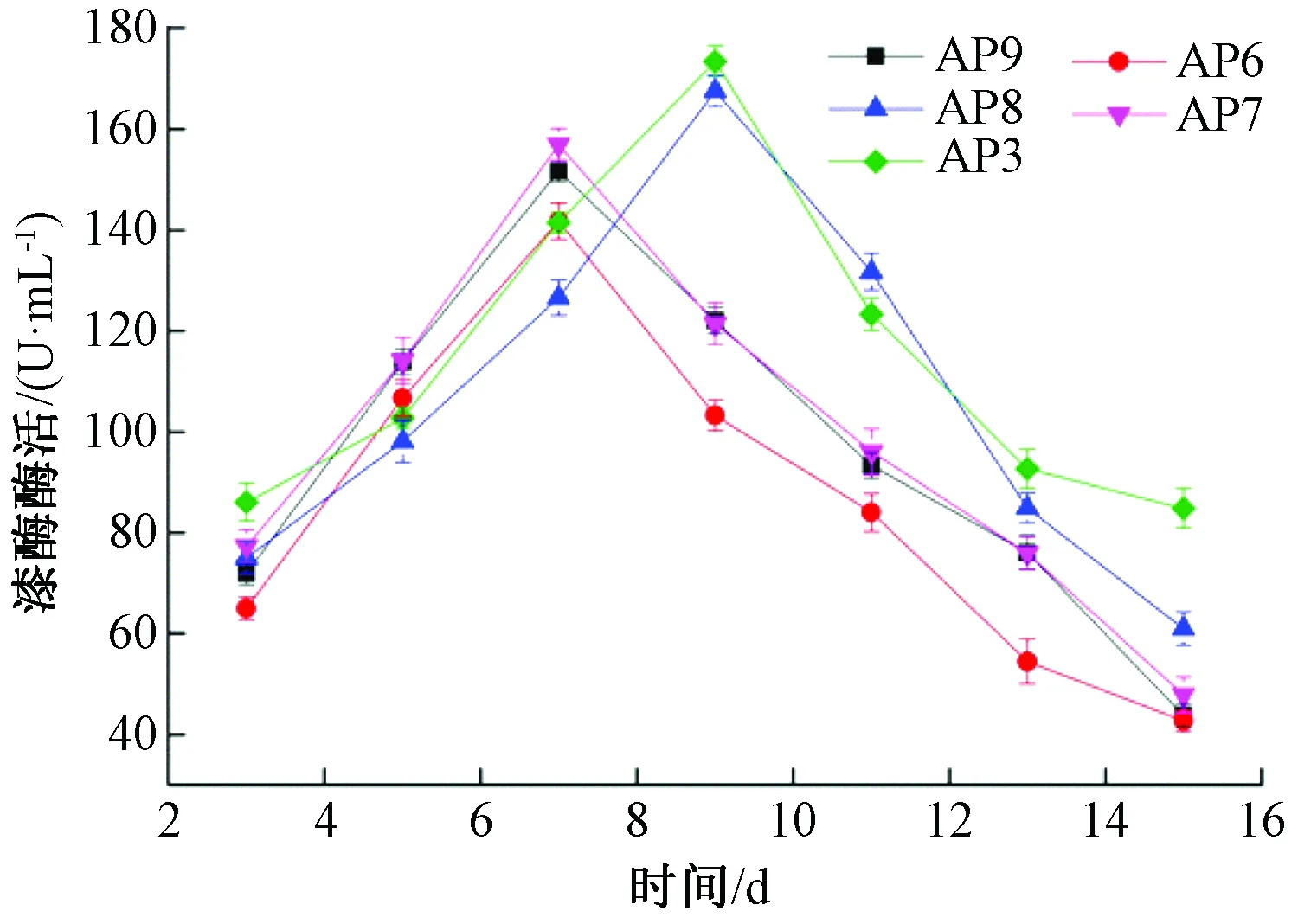
图4 菌株产漆酶酶活随时间的变化
白腐菌的生长状况与它们分泌的木质素酶系的酶活高低有一定的关系,在菌株生长的初期,菌株不断消耗培养基中的营养物质供自身生长需要,菌落逐渐增多,该阶段主要是菌株生长时期,因而菌株分泌的3种酶都较少;之后3种酶酶活逐渐增大直到达到最高峰,这是因为菌株进入了次生代谢阶段,菌株不断分泌3种酶;高峰期后酶活开始下降,这可能是因为随着培养时间的延长,培养基中营养物质不足,抑制了菌株的生长,而且培养基中菌株产生大量的代谢废物也会使其生长受到抑制,出现菌体自溶现象[17]。
对5株菌株15 d内产酶量的变化进行分析比较,可以发现AP8和AP3木质素降解酶系的多种酶酶活均显著高于其他3株菌株,且达到酶活高峰的时间要早于另外3株菌株。综合考虑,将AP8和AP3作为复筛菌株。同时由图2、图3、图4可以看出,5株菌株在液体培养基中产漆酶高,且产少量的木质素过氧化物酶和锰过氧化物酶。
2.3 麦麸木质素降解能力的比较
木质素的降解与酶活关系密切。由图2、图3、图4可以看出,AP8和AP3产酶效果都较好,但从表2可以看出,AP3对麦麸木质素的降解率明显高于AP8,这可能是因为2种菌株自身的适应能力和产酶能力不同,从而造成对木质素降解有差异[18]。AP3产酶量高且产酶速度快,对麦麸木质素降解效果最佳,因而,选取AP3作为最优菌株,对麦麸木质素进行降解。

表2 不同菌株对麦麸木质素的降解效果
3 结论
通过对木质素降解酶系多种酶酶活的比较,从9株白腐菌中筛选出1株高效降解麦麸纤维的菌株AP3。麦麸纤维经AP3液态发酵15 d后,木质素降解率达到了36.24%。此外,在菌株产酶比较分析中发现,AP3在产酶时能分泌较多的漆酶,产生较少的木质素过氧化酶和锰过氧化物酶。这可能是因为AP3在改性木质素时是以漆酶为主导的,漆酶在木质素降解过程中发挥重要作用。关于其特有的降解机制将在后期试验中进行分析探讨。
本试验是研究木质素降解菌的初期阶段,下一阶段试验是对AP3液体深层发酵麦麸的培养基成分及培养条件进行优化,从而提高漆酶的产酶量,达到对麦麸纤维良好的降解效果。
小麦麸皮是我国重要的农副产品,因此,研究木质素降解菌,从而高效改性小麦麸皮,对其开发利用具有重要意义。

