DNMTs 基因在苏博美利奴羊皮肤毛囊发育不同时期的表达分析
曾伟丹,赵冰茹,范 雪,楚高洁,徐新明,付雪峰,黄锡霞*,田可川*
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院畜牧研究所,新疆乌鲁木齐 830000;3.中国农业大学动物科学技术学院,北京 100193)
表观遗传学是指DNA 序列不发生改变,而基因表达发生可遗传变化,最终导致基因的功能或个体的表型发生变化。表观遗传修饰主要包括DNA 甲基化、组蛋白修饰、非编码RNA 的调节以及染色质重塑[1-2]。DNA 甲基化作为主要的表观遗传修饰,是由S 腺苷甲硫氨酸(SAM)在DNA 甲基转移酶(DNMT)的作用下共价连接甲基和胞嘧啶的过程[3],可介导生物过程如基因表达[4]、基因组印记[5]、细胞分化[6]和肿瘤形成[7]等,继而发挥重要作用。根据前人文献报道,已在哺乳动物中鉴定出5 种DNMT,包括DNMT1、DNMT2、DNMT3a、DNMT3b 和DNMT3L[8],它 们在2 个不同的甲基化过程中起作用,即维持和从头甲基化。DNMT1 主要参与维持甲基化,在DNA 复制后优先将甲基转移至半甲基化DNA 链。DNMT3a 和DNMT3b 参与从头甲基化活性,均在未修饰的胞嘧啶残基的甲基化中起作用。DNMTs通过调节基因的DNA甲基化水平进而影响该基因的表达,如抑制克隆胚胎中DNMT1的表达水平,可降低多能基因甲基化水平和促进该基因的表达[9]。在绒山羊毛囊发育相关研究中发现,DNMTs通过调节Hoxc13基因的甲基化状态进而调控该基因的mRNA 表达,参与山羊绒周期性生长的过程[10]。Zhang 等[11]分析发现,高繁殖力绵羊组中DNMT1和DNMT3a的表达水平显著低于低繁殖力组,表明DNMTs可能调控与绵羊繁殖力相关基因的转录。在敲除小鼠模型实验的研究发现,在小鼠胚胎期敲除任何一种DNA 甲基转移酶基因(DNMTl、DNMT3a、DNMT3b)都会导致其在胚胎或者围产期致死[12]。可见,DNMTs在动物的生长发育中起着重要作用。
苏博美利奴羊是我国主要的超细型细毛羊品种之一,该品种的羊毛细度可达17~18 μm,具有产毛量高且毛品质较好等特点[13]。毛囊作为产毛组织,其结构特征直接影响羊毛产量和毛品质[14]。因此,了解毛囊的结构特点,并进一步从分子水平解析毛囊生长发育机制具有重要意义。本实验采用实时荧光定量PCR 技术检测了DNMTs基因在苏博美利奴羊毛囊发育6 个时期的表达情况,以期为从DNA 甲基化水平解析不同时期毛囊发育调控机制提供借鉴。
1 材料与方法
1.1 实验材料 实验动物苏博美利奴羊来自新疆科创繁育中心。选取2~3 岁经产母羊,同期发情并使用同一种公羊精液进行配种,统一条件下饲养管理。采集胚胎期65 d、85 d、105 d、135 d 和出生后7 d、30 d(分别记为G1、G2、G3、G4、G5、G6)胎儿的皮肤组织,每个时期均采集3 只羔羊。样品采集处理后迅速放进冻存管中,在液氮中保存用于提取总RNA。
1.2 实验方法
1.2.1 总RNA提取和cDNA合成 使用Trizol(Invitrogen)试剂分离总RNA 并溶解于无RNase 水中,使用Nanodrop 2000 核酸检测仪进行RNA 浓度测定,经琼脂糖凝胶电泳检测后使用反转录试剂盒(TaKaRa)进行cDNA 合成,保存于-20℃冰箱内。
1.2.2 候选基因引物设计与合成 根据NCBI 提供的绵羊DNMT1、DNMT3a、DNMT3b基因序列,内参基因采用GAPDH,利用Primer Premier 5.0 软件进行定量引物设计(表1)。

表1 实时荧光定量PCR 引物
1.2.3 实时荧光定量PCR 检测 以cDNA 作为模板,进行qRT-PCR 扩增(总体系为25 μL):12.5 μL SYBR Premix Ex Taq(1×),上、下游引物(10 μmol/L)各0.5 μL,cDNA1 μL,ddH2O 10.5 μL,扩增程序为95℃ 15min,95℃ 10s,60℃ 30s,39 个循环;以0.5℃/s 的速度从65℃升高到95℃。每个样品设置3 个重复。扩增反应在Bio-Rad CFX96 荧光定量PCR 仪上完成。
1.3 统计分析 用2-△△Ct法对6 个时期目的基因相对表达量进行计算,利用SPSS19.0 软件进行单因素方差分析,采用Duncan 法进行多重比较,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 皮肤组织的总RNA 检测 用1% 琼脂糖凝胶电泳对总RNA 进行检测,28 s 和18 s 两条带清晰可见且完整性较好(图1),可用于反转录,进行后续实验。
2.2 PCR 产物检测 以反转录后的cDNA 为模板,GAPDH引物进行PCR 扩增后经2% 琼脂糖凝胶电泳检测,产物片段大小为113 bp,与预期片段大小一致(图2),说明引物特异性良好,反转录的cDNA 可以用于后续荧光定量PCR 实验操作。
2.3DNMTs在苏博美利奴羊毛囊发育不同时期皮肤中的表达分析 如表2 所示,苏博美利奴羊在6 个毛囊发育时期DNMTs在皮肤中均有表达。DNMT1基因在G1时期的相对表达量极显著高于G2、G3 时期,显著高于G4、G5、G6 时期。
DNMT3a基因表达的变化为先上升后下降,即从G1 时期开始缓慢升高,在G3 时期达到最高,随后下降;该基因的表达量在G1、G2、G3 时期极显著高于G5、G6 时期,G1、G3 时期的表达量显著高于G4 时期。
随着毛囊发育时间的增加,在皮肤组织中DNMT3b呈时序性表达模式,即逐渐下降的趋势。该基因在G1 时期的表达量显著高于G6 时期,G2、G3、G4、G5、G6 时期之间的表达量差异不显著。在相同时期的DNMT1、DNMT3a、DNMT3b3 个基因之间的相对表达量水平差异不显著。
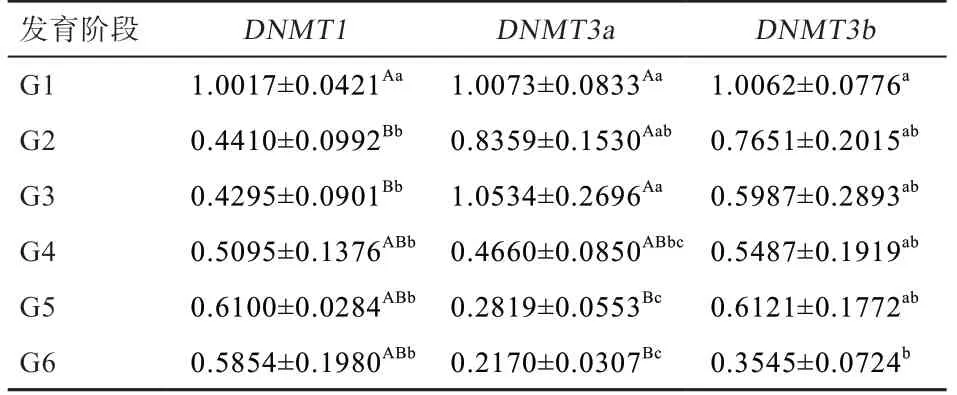
表2 苏博美利奴羊皮肤组织中DNMT1、DNMT3a、DNMT3b 基因的mRNA 相对表达水平及差异分析
3 讨 论
毛囊中大概存活着20 种细胞,是一种独特且复杂的控毛生长微型器官,这些细胞在毛囊中共同参与皮肤中毛囊形态变化和周期性生长的调节[15]。本团队前期对苏博美利奴羊毛囊的组织形态学研究发现,胚胎期65 d 时初级毛囊开始形成,胚胎期85 d 时由初级毛囊膨大部形成次级毛囊的毛芽,胚胎期105 d 时次级毛囊大量形成且分化出再分化次级毛囊,胚胎期135 d 时大多数初级毛囊和部分次级毛囊成熟[16]。
DNA 甲基化是内源性修饰之一,通常情况下,DNA 甲基化与基因表达呈负调控关系,基因的高甲基化表现出低表达水平,而低甲基化基因表现出高表达水平。在这个过程中,DNA 甲基化转移酶(DNMTs)发挥着到关键作用。DNMT1、DNMT3a、DNMT3b作为DNA 甲基化转移酶基因家族的主要基因,可以共同参与调控目的基因甲基化[17-18]。Guo 等[19]通过检测牛肌肉和肝脏中DNMT3a和DNMT3b表达水平发现,DNMT3a和DNMT3b的表达水平可能影响脂肪沉积相关基因的表达,从而影响肉牛的肉质。将DNMT1基因钝化的角质化细胞移植到免疫缺陷鼠后,造成了小鼠表皮发育不良,同时伴随增殖相关基因的表达下调[20]。吴江鸿等[21]提出控制毛发季节性生长的分子机理假说,即光照长短影响褪黑激素的分泌,而褪黑激素含量增加会导致甲基化转移酶作用减弱而降低甲基化水平,毛囊发育相关基因的表达量增加,进而调控毛发组成蛋白表达。这些研究结果均提示DNMTs可能参与调控目的基因甲基化进而影响基因的表达水平。
本研究发现,DNMT1基因在苏博美利奴羊皮肤组织G2~G6 时期呈上升趋势且在G1 时期表达量最高,可能与DNMT1在毛乳头细胞增殖过程中起着维持作用有关,参与调控初级毛囊毛芽前体形成。DNMT3a及DNMT3b在G4 时期之前均有相对较高的表达,该时期之后均呈下降趋势。G1~G3 时期是初级毛囊及部分次级毛囊发育阶段,在G4 时期初级及次级毛囊基本达到成熟状态,结合苏博美利奴羊毛囊周期性变化的形态特征[16]推测DNMTs对参与毛囊内细胞的增殖和分化具有重要作用,且主要作用于初级和次级毛囊的发育时期。
在K14 介导的DNMT1敲除小鼠的研究发现,DNMT1参与调节DNA 甲基化,维持毛囊周期的稳态[22]。DNMT1 是主要的维持甲基化状态的酶。DNMT1普遍存在于人体细胞中,在增殖细胞中表达很高,并且和DNA 的复制位点关系密切[23]。本研究中DNMT1在整个毛囊发育时期均有较高表达,表明DNMT1在毛囊发育过程发挥重要作用。DNMTs通常在胚胎发育早期有较高表达,调节DNA 甲基化状态及基因的表达来参与细胞的发育和分化过程,当胚胎发育到一定阶段时其甲基化状态也保持相对稳定,DNMTs的表达逐渐减少[23]。熊小燕[24]研究发现,在山羊妊娠早期DNMTs的相对表达较高,随着妊娠时间增加,DNMT1的表达量逐渐上升,与本研究结果相似,即在毛囊发育前3 个时期,DNMT3a和DNMT3b基因的表达量均高于后3 个时期,且DNMT3a的表达量增加,DNMT3b的表达降低,推测DNMTs之间的表达与作用可能存在互相制衡关系。本实验中DNMTs在相同时期的表达量差异不显著,这与冯帅帅[10]的研究结果一致。本研究发现在6 个时期DNMTs均有表达,说明在毛囊发育过程中可能存在一定的调控作用,而DNMTs是否参与毛囊发育过程的DNA 甲基化,有待进一步研究。
4 结 论
本研究结果表明,DNMTs基因在毛囊发育的6个时期均有表达,并且在G1 时期的表达量显著高于G6 时期,同一毛囊发育时期DNMT1、DNMT3a、DNMT3b基因的相对表达量差异不显著。

