mTOR 在不同毛色绵羊皮肤的表达与定位
渠国文,孙笑尉,庞全海
(山西农业大学动物科技学院 山西太谷 030801)
哺乳动物毛色形成是一个复杂的调控系统,其形成的每一个水平都有各个调节因子互相作用来调控。其中研究最多的具有重要调控黑色素形成作用的基因为小眼畸形相关转录因子(MIcrophthalmia-associated Transcription Factor,MITF),其作为黑色素合成主要信号通路下游关键因子,在色素细胞发育、分化和功能调节中起到关键性作用[1]。MITF 蛋白激活和调节3 种色素沉着酶基因,即酪氨酸酶(Tyr)、酪氨酸酶相关蛋白1(Tyrp1)和多巴色素-互变异构酶(Dct/ Tyrp-2)[2-3],促进真黑色素合成;MITF 蛋白含量降低时,可使黑色素细胞内合成的Tyr 活性下降,产生褐黑色素[4]。
哺乳动物雷帕霉素靶蛋白(mammalian Target of Rapamycin,mTOR)属于丝氨酸/苏氨酸蛋白激酶,是哺乳动物信号传导途径的关键组成部分,调节生物体的生长、繁殖和哺乳动物的体内稳态[5]。mTOR 通路是自噬领域的研究热点,且近年来有研究表明自噬可调控黑色素细胞生成[6-8]。推测mTOR 可能在哺乳动物毛色形成方面具有调控作用。因此,探讨mTOR 在不同毛色绵羊皮肤的表达与定位对深入了解mTOR 的生物学功能具有重要意义。本实验以白色、棕色和黑色绵羊皮肤为实验对象,采用qPCR 法检测mTOR基因的相对表达量,Western blotting 技术检测p-mTOR 蛋白的相对表达量,免疫组化技术对p-mTOR 进行定位,为进一步研究mTOR 在调控动物毛色中的作用机制提供科学依据。
1 材料与方法
1.1 实验动物及其组织 山西农业大学绵羊养殖基地随机选取健康性成熟的白色、棕色和黑色哈萨克绵羊各3只,取背部皮肤组织各3 块。其中2 块放入液氮中用于提取RNA 和蛋白,1 块直接放入4% 的组织细胞固定液中室温固定48 h 后于70%的无水乙醇中存放。
1.2 主要试剂 RNAiso Plus、PrimeScriptTMRT Master Mix(Perfect Real Time)和TB GreenTMPremix Ex TaqTMII(Tli RNaseH Plus)购自TaKaRa 公司;Anti-Phospho-MTORS2448 多克隆抗体、组织细胞裂解液、DAB 试剂盒染料、BCA 蛋白浓度测定试剂盒、ECL Plus 超敏发光液、中性树胶和4% 组织细胞固定液购自北京索莱宝生物技术有限公司;抗兔/鼠通用型免疫组化检测试剂盒、rabbit anti-β-actin 多克隆抗体和goat anti-rabbit IgG 购自北京三鹰生物技术有限公司。
1.3 实验方法
1.3.1 总RNA 提取及cDNA 的合成 使用RNAiso Plus试剂提取保存于液氮中白色、棕色和黑色绵羊皮肤组织的总RNA,用反转录试剂盒PrimeScriptTMRT Master Mix(Perfect Real Time)反转录成cDNA,于-20℃冰箱中保存。
1.3.2 引物的设计与合成 参考GenBank 上已登录的绵羊的mTOR和β-actinmRNA 序列,利用Primer Premier 6.0引物设计软件设计荧光定量PCR 扩增引物,引物由华大基因(深圳)合成,引物序列如表1。
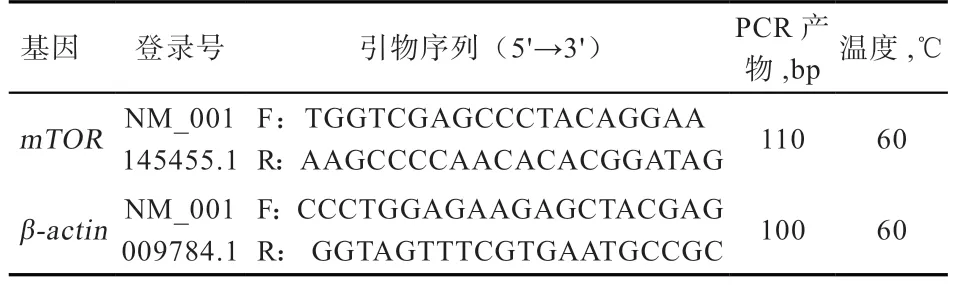
表1 引物序列及PCR 扩增条件
1.3.3 qRT-PCR 根据TB GreenTMPremix EX TagTMII 试剂盒建议反应条件构建反应体系,每个样本重复3 次,使用不添加模板的空白作阴性对照。反应体系25 μL:TB GreenTMPremix Ex TaqTMII(Tli RNaseH Plus)12.5 μL,正、反向引物(10 μmol/L)各1 μL,cDNA 模板2.0 μL和ddH2O8.5 μL。扩增条件:95℃变性30 s,95℃ 5 s,60℃ 30 s,72℃ 30 s 共40 个循环,软件自动得出扩增曲线、熔解曲线和循环阈值,分析所得结果。根据荧光曲线CT 值采用2-ΔΔCT计算定量结果。
1.3.4 Western boltting 分析 利用组织细胞蛋白提取试剂盒提取皮肤样品的总蛋白,使用BCA 蛋白浓度测定试剂盒检测其蛋白浓度。经SDS-PAGE 凝胶电泳、转膜、杂交、曝光得到蛋白印迹,使用Image-Pro Plus 6.0 蛋白分析软件,分析mTOR 和β-actin 的印迹结果。Anti-Phospho-MTOR-S2448 抗体稀释比例为1:300,rabbit anti-β-actin 抗体稀释比例为1:2 000,Goat Anti-Rabbit IgG 稀释比例为1:3 000。
1.3.5 免疫组化检测 将置于样品组织,经梯度酒精(70%、75%、80%、85%、90%、95%和100%)脱水并使用二甲苯透明后进行包埋并制作切片。二甲苯和梯度酒精(100%、95%、90%、85%、80%、75%和70%)脱蜡,使用免疫组化试剂盒对烘干的组织切片进行实验,Anti-Phospho-MTOR-S2448 抗体稀释比例为1:100,阴性对照组使用PBS 代替一抗。DAB 显色液显色,在显微镜下观察颜色变化,苏木素复染、分化、透明后中性树胶封片。使用ECLIPSE Ti-U 生物倒置显微镜对实验结果进行拍照。
1.4 统计分析 使用GraphPadPrism 6 软件对数据进行方差分析,结果用平均值±标准差表示。
2 结果
2.1mTOR在绵羊不同毛色皮肤组织中mRNA 的相对表达量 qRT-PCR 结果如图1 所示,mTORmRNA 在棕色和黑色绵羊皮肤中表达量为白色绵羊皮肤中的6.7(P<0.01)和23.8 倍(P<0.001);黑色绵羊皮肤中表达量为棕色绵羊皮肤中的3.6 倍(P<0.01)。
2.2 不同毛色绵羊皮肤组织中p-mTOR 蛋白的表达量分析 Western blotting 检测结果如图2-A 所示,在绵羊不同毛色皮肤中见分子量大小约为289 ku 的蛋白;β-actin 作为内参,其分子量约为42 ku。如图2-B 所示,p-mTOR 蛋白在白色绵羊皮肤中的相对表达量显著低于棕色和黑色绵羊皮肤中的相对表达量;黑色皮肤的表达量显著高于棕色皮肤。
2.3 不同毛色绵羊皮肤组织中p-mTOR 蛋白的表达与定位 通过免疫组织化学法对p-mTOR 蛋白在不同毛色绵羊皮肤组织中的表达进行定位,结果如图3 所示,p-mTOR 蛋白在皮肤组织的表皮、毛基质、毛乳头、根鞘部及毛干呈阳性表达,阴性对照组中未见阳性表达。
3 讨 论
自噬通过磷酯酰肌醇-3 激酶(phosphatidylinositol-3-kinase,PI3K)/ AKT/ mTOR 信号传导参与人表皮角质形成细胞中异黄体生成素诱导的黑色素降解[9]。Yu-Tzu T 等[10]研究发现用扁柏酚处理B16F10 细胞后,扁柏酚以剂量依赖性方式降低MITF 和酪氨酸酶及细胞黑色素含量。同时,微管相关蛋白1 轻链3(LC3)-II 和beclin 1(自噬标记)增加,发现扁柏酚通过AKT/ mTOR信号通路抑制黑素生成[10]。研究表明,mTOR 信号传导对于毛发(包括毛色)再生过程中毛囊干细胞的激活至关重要,其激活作用通过BMP 介导的毛发再生过程来实现[11]。本研究表明,mTOR基因在白色绵羊皮肤中的相对表达量显著低于棕色和黑色绵羊,且黑色皮肤中的表达量显著高于棕色皮肤,p-mTOR 蛋白在不同毛色绵羊皮肤中的相对表达量与mTOR基因有相同的趋势,并与白色、棕色和黑色羊毛中的真黑色素含量趋势相同[12]。
毛乳头是向毛干和表皮提供黑色素的部位也是哺乳动物被毛产生色素的唯一场所,其中含有大量有活性的黑色素细胞,含有大量的黑色素颗粒输出以供毛发生长时色素的沉积[13-14]。在不同毛色羊驼皮肤成熟黑色素细胞分布规律不同,在有色被毛皮肤组织中其主要分布在毛乳头部,表皮分布较少;在白色被毛皮肤组织中大多分布在表皮而毛乳头分布较少[15]。黑色素细胞的前体细胞即黑色素母细胞存在于毛根鞘中,成年小鼠黑色素母细胞在毛发周期中发育生成黑色素细胞。本研究利用免疫组织化学法对p-mTOR 蛋白在绵羊皮肤组织的表达进行了定位,p-mTOR 蛋白在皮肤组织的表皮、毛基质、毛乳头、根鞘部及毛干均有表达。由上可以推测mTOR参与动物毛色形成过程。
4 结 论
本实验结果表明,mTOR基因在棕色和黑色绵羊皮肤中的相对表达量显著高于白色绵羊皮肤,且在黑色绵羊皮肤中的相对表达量显著高于棕色绵羊皮肤;p-mTOR 蛋白在白色、棕色和黑色绵羊皮肤中的相对表达量趋势与mTOR基因相同;p-mTOR 蛋白在绵羊皮肤组织的表皮、毛基质、毛乳头、根鞘部及毛干表达,提示mTOR 与毛色的形成具有一定的相关性。

