Ba0.5Sr0.5Co0.8Fe0.2O3-δ催化析氧催化剂氟离子取代/化学还原双活性位点构筑
张新磊 时佳维 蔡卫卫
(中国地质大学(武汉) 材料与化学学院,湖北 武汉 430074)
0 引言
工业革命以来,人类社会发展对能源的需求在持续增长,预计在未来15年内,全球能源需求将是目前的两倍[1].但是,当前人类主要能量来源是化石燃料,包括煤炭、石油、天然气等.但是,这些化石燃料不可再生、储量有限且会产生严重威胁人类生存环境的污染气体.因此,可再生清洁能源的被认为是理想的解决人类能源危机的有效方案[2].氢能作为一种可再生的清洁二次能源,和潮汐能、太阳能、生物能、地热、核能等新能源技术不同,它不受地域限制,且来源广泛、热值较高.同时,由于氢气燃烧产物只有水,因此,氢能技术的推广不仅能解决能源问题,还能同时摆脱燃烧化石燃料所带来的温室效应等环境问题[3].在氢能技术链条中,制氢是极其重要的一环,而在其中电解水制氢可实现大规模制氢,并可以与其他新能源类型耦合.但是,电解水过程在反应动力学上需要克服一定的反应能垒,导致所需电解电压远大于水的理论分解电压(1.23 V)[4-6].尤其在阳极侧,电化学析氧反应(OER)的动力学速度慢,限制了电解水技术的大规模应用[7,8].目前,OER活性较好的是贵金属铱(Ir)、钌(Ru)以及其氧化物(IrO2、RuO2),在电化学环境中表现出了相对较低的过电位[9,10].但是,即使是贵金属(氧化物)催化剂,其催化OER的活性仍有待提高[11].
同时考虑到贵金属催化剂的高成本,高活性非贵金属OER催化剂在最近十年得到了大量研究[12,13].包括碳基催化剂、金属氧化物、金属碳化物在内的催化剂都表现出来较之IrO2、RuO2催化剂更高的OER活性[14].在这些廉价催化剂中,钙钛矿氧化物由于制备简单、热稳定性好[15-19],在OER催化领域得到了广泛关注.研究表明,钙钛矿氧化物晶格氧和表面吸附氧都会影响钙钛矿催化剂的催化活性.在温度较低时,主要是表面吸附氧起到氧化作用,而ABO3结构钙钛矿氧化物中B位金属决定了表面吸附氧的能力.在温度较高时,主要是晶格氧起作 用,然而改变 ABO3结构中的 A 和 B 位金属元素或用其他价态的金属原子代替A 和 B 原子均能调节 晶格氧,进而提高催化活性.2011年,Suntivich[20]等人科学地评价了10种钙钛矿氧化物,得出了OER催化活性同B位金属eg轨道电子数存在火山型关系的结论:BSCF的eg电子数约为1.2,最接近1,在目前所开发钙钛矿氧化物催化剂中具有最好的OER性能.为了进一步提升BSCF的OER活性,研究人员对BSCF进行了改性研究.
前期工作中,我们证实了使用少量F离子部分取代BSCF中的O离子可以增加活性氧O2-/O-数量并增加催化活性位点的数量,进而实现BSCF催化剂OER性能提升.在此基础上,本工作使用H2对F离子部分取代BSCF进行化学还原,原位析出金属纳米颗粒作为催化OER活性位点,实现BSCF催化OER活性的进一步提升.
1 实验部分
1.1 氟离子取代BSCF催化剂的制备
本工作使用溶胶-凝胶法制备氟离子取代的BSCF催化剂.首先,分别称取2.6134 g(0.01 mol)硝酸钡、2.1163 g(0.01 mol)硝酸锶、4.6565 g(0.016 mol)六水合硝酸钴以及1.6160 g(0.004 mol)九水合硝酸铁放入50 mL烧杯中,向烧杯中加入35 mL去离子水,待完全溶解后,再加入8.4056 g(0.04 mol)柠檬酸,11.6896 g(0.04 mol)乙二胺四乙酸,0.0741 g(0.002 mol)氟化铵,剧烈搅拌6 h.接着,将液体转入50 mL聚四氟乙烯高压反应釜中,在160 ℃下水热反应10 h.将所得凝胶在干燥箱内60 ℃干燥12 h.在马弗炉中以2 ℃/min 的升温速率升到1000 ℃,保温2 h,退火后即得到氟离子掺杂的BSCF催化剂,记为BSCF-2F.
1.2 化学还原BSCF-2F催化剂的制备
取少量BSCF-2F催化剂于瓷舟并置于管式炉中.H2/Ar(v/v=1:9)混合气氛中,以2 ℃/min 的升温速率升到900 ℃,保温3 h,退火后得到目标催化剂,记为BSCF-2F-H-900.重复上述步骤分别设置保温温度为800、850 ℃,得到不同还原温度的催化剂,分别记为BSCF-2F-H-800及BSCF-2F-H-850.
1.3 电化学测试
本工作所有电化学测试都是使 用传统三电极体系在Gamry电 化 学 工 作 站(Interface 1000E)平台上进行的.进行电化学测试时,使 用氧气饱和的1.0 mol/L的KOH溶液作为电解 液,1.0 mol/L KOH汞/氧化汞电极作为参比电极,高纯碳棒作为对电极,负载有催化剂的玻碳电极作为工作电极.
1.4 物理表征
为了对催化剂的结构和形貌进行系统分析,本工作还对目标催化剂开展了扫描电子显微镜(SEM)、粉末X射线衍射(XRD)及X射线光电子能谱(XPS)等物理表征.
2 结果与讨论
2.1 催化剂结构与组成分析
从BSCF-2F催化剂的SEM照片图1(a)可以看出,制备得到的BSCF-2F催化剂尺寸约1-3 μm.为了证实目标催化剂的成功合成,BSCF、BSCF-2F以及不同温度下还原得到的BSCF-2F-H催化剂的XRD表征结果在图1(b)中进行了比较.可以发现,BSCF的XRD衍射峰与BaCoO2.6(JCPDS 71-2453)标准卡片吻合,说明我们成功制备了BSCF催化剂[21, 22].此外,从图1的XRD图谱同样可以发现BSCF-2F特征峰与BSCF基本一致,说明氟离子的取代并未改变BSCF氧化物的晶体结构,只是部分取代了氧负离子[23].然而,经过氢气还原后的BSCF-2F-H催化剂中BSCF的特征峰全部消失,只在44°与52°附近处剩下两个明显的较小的钴铁合金的特征峰,说明BSCF氧化物表面晶体结构发生了显著改变.
为了证实催化剂表面结构的变化,进一步考察了BSCF-2F催化剂在H2还原处理前后的磁性变化(图2).可以发现未经过H2还原的原始BSCF-2F不具有铁磁性,如图2(a),而经过H2化学还原处理后的BSCF-2F-H-800催化剂具很强的铁磁性,能被磁铁吸引,如图2(b),BSCF-2F-H-850,BSCF-2F-H-900同样具有磁性.主要原因是,经过H2还原后BSCF-2F催化剂表面原位析出了FeCo金属纳米颗粒.而同样具有较好OER催化活性的金属纳米颗粒,通过与BSCF催化剂氧缺陷活性位点协同作用会显著提升BSCF的OER催化活性.
为了对催化剂表面电子状态和组成进行分析,我们对催化剂开展了XPS研究.图3所示是BSCF、BSCF-2F及不同温度还原的BSCF-2F-H催化剂XPS Co 2p高分辨XPS图谱.可以发现BSCF-2F催化剂特征峰位置相对于原始BSCF催化剂有明显正移,意味着催化剂中Co的价态有所降低.原因是F离子(-1价)部分取代了BSCF中的O离子(-2价),为了实现电荷平衡,BSCF中的Co阳离子的价态显著降低.当BSCF-2F催化剂再经过H2还原后,Co 2p峰位置继续正移,其中,BSCF-2F-H-850催化剂正移幅度最大,说明其中价Co阳离子态降低幅度最大.但是当还原温度继续升高至900 ℃,峰位置相对于BSCF-2F-H-850又有所负移,说明催化剂中B位的Co阳离子价态略有升高.
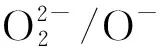
2.2 电化学测试
由BSCF-2F及在不同温度下化学还原后的三种催化剂在氧气饱和的1 mol/L的KOH电解液中的线性伏安扫描曲线(LSV)比较可知,如图5(a),BSCF-2F-H-850催化剂OER性能最好,在电流密度10 mA/cm2时其过电位仅为310 mV,表现出了比较优越的OER活性.在800 ℃下还原得到的BSCF-2F-H-800催化剂在该电流密度下过电位略高于BSCF-2F,但在高电位区表现出优于BSCF-2F的性能.因此,可以认为使用H2对BSCF-2F进行化学还原后,OER活性均有不同幅度提升,其中最佳还原温度为850 ℃.为了进一步探究不同温度下H2还原对催化剂OER效果的影响,根据得到的LSV曲线数据,处理得到了几种催化剂的Tafel曲线图,如图5(b).Tafel斜率值越小,说明OER过程中直接四电子过程的比例越高[25].通过拟合得到的Tafel斜率可以发现,BSCF-2F-H-850催化剂的Tafel斜率最小,为83.91 mV/dec,BSCF-2F-H-900次之,为85.51 mV/dec,BSCF-2F与BSCF-2F-H-800催化剂基本相等,分别为95.51和95.82 mV/dec.这一结果和图5(a)中由极化曲线所表现出的OER催化性能很好的吻合,进一步说明H2的化学还原增加了BSCF-2F催化剂的活性位点,提升了催化剂的OER性能,且最佳还原温度为850 ℃.
催化剂的双电层电容值可由循环伏安法(CV)在非法拉第区测得,其值与电化学活性面积是线性相关的,可以用于描述OER催化剂的电化学活性比表面积[26].图6(a)-(d)是不同催化剂在非法拉第区,在不同扫速(从20 mV/S-200 mV/S)的CV曲线图.根据CV曲线计算得到的双电层电容活性面积与CV扫速作图,如图6(e)为直线关系.根据直线斜率可以计算得到催化剂的面积归一化双层电容值.可以发现,BSCF-2F-H-850催化剂具有最大的面积归一化双层电容值:19.11 mF/cm2,这一结果与上述的LSV曲线结果能够较好对应.与BSCF-2F-H-850催化剂相比,BSCF-2F-H-800催化剂大的双层电容值最小,甚至比BSCF-2F催化剂还要低得多.因此也可以推测,BSCF-2F-H-800催化剂在电化学比表面积更小的前提下能够得到较BSCF-2F催化剂更好的OER催化性能的主要原因是氧缺陷和表面金属两种活性位点协同作用的结果.
图6(a)BSCF-2F-H-800;(b)BSCF-2F-H-850;
(c)BSCF-2F-H-900及(d)BSCF-2F催化剂在不
同扫速(20-200 mV/S)下非法拉第区的CV
曲线及(e) 对应的双电层电容曲线
最后,我们对几种催化剂分别进行了电化学阻抗谱(EIS)测试以进一步探讨双活性位点协同提升OER活性的原因.由BSCF-2F及在不同温度下化学还原后的三种催化剂在1 mol/L的KOH氧饱和电解液液中的EIS曲线比较可知(图7),BSCF-2F-H-850催化剂相同电流条件下EIS曲线半圆的半径最小,意味着OER过程在BSCF-2F-H-850催化剂表面的电荷转移电阻最小[27].此外,从EIS曲线对比我们也可以发现BSCF-2F-H-850催化剂表面的电荷转移电阻与BSCF-2F相比并没有明显下降.可以得出结论,通过氢气还原在BSCF-2F催化剂表面析出的金属纳米颗粒虽然具有更高的电子电导率,但是在OER过程的贡献已经可以忽略不计.BSCF-2F-H-850催化剂OER活性的提升主要原因仍是催化活性位点数量的提升及两种催化剂活性位点协同作用.
3 结论
以BSCF为例,本工作提出了一种简单的提升钙钛矿氧化物类OER催化剂性能的手段,通过F离子取代和后续氢气还原,在催化剂内构筑额外活性氧缺陷并在催化剂表面原位还原金属纳米颗粒.这两种活性位点协同可以显著提升催化剂的OER活性.XRD、XPS等物理表征证实了F离子的成功取代及B位金属在BSCF表面的原位析出.电化学测试结果表明两种活性位点协同作用可以显著提升OER活性且存在优化的氢气还原温度.850 ℃还原得到的BSCF-2F-H-850催化剂催化10 mA/cm2OER过电位310 mV,较只有F离子取代的BSCF-2F催化剂的过电位为低30 mV.综合Tafel曲线斜率比较、双层电容数值比较及EIS曲线比较,可以证实BSCF-2F-H-850催化剂中的两种活性位点可以通过协同作用高效催化OER.

