副溶血性弧菌毒性相关因子及其外分泌蛋白的研究进展
,*
(1.徐州工程学院食品(生物)工程学院,江苏徐州 221018; 2.徐州工程学院江苏省食品资源开发与质量安全重点建设实验室,江苏徐州 221018; 3.山东省枣庄市市中区环保局环境监测站,山东枣庄 277100)
副溶血性弧菌(Vibrioparahaemolyticus)隶属于γ-变形菌纲(Gammaproteobacteria),弧菌目(Vibrionales),弧菌属(Vibrio),是一种无芽孢的嗜盐嗜碱性的革兰氏阴性短杆状细菌。1950年,日本大阪发生了一起由沙丁鱼引发的爆发性食物中毒事件,造成了272人感染腹泻疾病,20人死亡,这是世界首次对V.parahaemolyticus引发的食物中毒事件的报道[1]。自此之后,该细菌引发的食物中毒事件陆续被报道,现已成为世界范围内重要的食源性致病菌。V.parahaemolyticus广泛存在于近海的海水、海底沉积物和鱼、虾、贝壳等海产品中,例如,牡蛎、鲍鱼、海鱼、海虾、海蟹、海蜇等。除海产品外,淡水鱼、咸菜、畜禽肉、蛋品等食品中均检测到V.parahaemolyticus[2]。该菌在环境中的分布与温度和盐度息息相关,夏秋季为其引发食物中毒的高发季节。生态学研究表明,V.parahaemolyticus冬季主要存在于海底沉积物中,晚春或初夏时分,当水温上升到14 ℃以上时,该菌会由沉积物释放到水体环境中[3]。低温水域新鲜捕获的海产品中,V.parahaemolyticus的密度通常低于103cfu/g,而在温度偏高的水域中,海产品中该菌的密度则高于103cfu/g,若未经冷藏,该菌在24 h内会呈现50~790倍的增长[4]。国家食源性监测网对我国食源性疾病发生情况的监测统计数据显示,每年因V.parahaemolyticus导致急性腹泻病例665.5万人,占食源性病例的68.0%,比例远高于发达国家水平且主要发生在我国东南沿海地区[5]。随着经贸及交通运输的迅速发展,V.parahaemolyticus引发的食物中毒已经由沿海地区逐渐向内地发展,已发展成为严重的食源性公共卫生问题[6-7]。
流行病学研究显示,频繁外出就餐及贝类消费是V.parahaemolyticus感染的两个危险因素[6]。生食或食用未完全煮熟的被该菌污染的海产品或盐腌渍品会引起食物中毒,一般发病潜伏期为4~96 h[8]。主要引起急性肠胃炎,其感染率及严重性取决于感染剂量和菌株毒力,通常会伴随腹泻、腹痛、恶心、呕吐、畏寒发热,大便似水样等症状。大部分病人发病后3 d左右恢复正常,少数严重病人若抢救不及时,会导致死亡[9]。部分临床病例显示,V.parahaemolyticus会引起浅表创伤感染,通常发生在有伤口的渔民身上[10]。若患有肝脏疾病,免疫疾病等自身免疫力低下的患者感染V.parahaemolyticus可导致败血症,严重威胁生命[9]。V.parahaemolyticus在环境中广泛存在,但仅有很少一部分菌株具有致病性,且其致病能力通常是与宿主细胞之间的相互作用而决定。一般认为,致病菌的毒性及抗药性主要是通过分泌系统分泌蛋白和毒素进入外界环境,或者直接作用宿主细胞的靶位点,使宿主致病,水平传播耐药基因[11]。本文从V.parahaemolyticus毒性相关因子及其分泌系统相关分泌蛋白进行概述,概括阐明近年来针对V.parahaemolyticus毒性及分泌蛋白的相关研究进展。
1 V. parahaemolyticus毒性相关因子和结构
V.parahaemolyticus在致病过程中,菌株产生毒素,直接作用于宿主表面或进入宿主细胞,对细胞造成损伤及干扰破坏正常代谢或机能。这些过程与V.parahaemolyticus毒力因子息息相关,主要包括溶血素、尿素酶、黏附因子和分泌系统等。另外,V.parahaemolyticus的鞭毛系统,生物被膜和群体感应也是其生存及侵入宿主的重要因子[10](图1)。
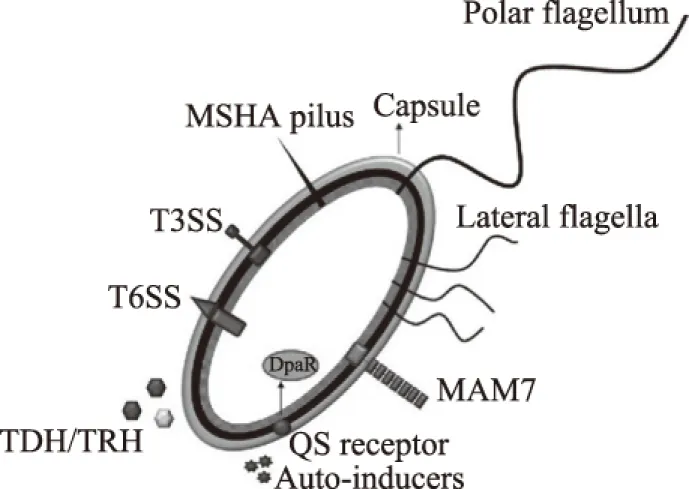
图1 V. parahaemolyticus毒力相关因子Fig.1 Virulence factors of V. parahaemolyticus
1.1 溶血素
溶血素(Hemolysin)是V.parahaemolyticus中首先被发现、鉴定的毒力相关因子,包括耐热直接溶血素(Thermostable direct hemolysin,TDH)、耐热直接相关溶血素(TDH-related hemolysin,TRH)和不耐热溶血素(Thermolabile hemolysin,TLH)。其中,与V.parahaemolyticus引起的肠胃炎直接相关的是TDH和TRH。
1950年在日本大阪肠胃炎爆发期的临床样本中分离到的V.parahaemolyticus在我萋氏平板(Wagatsuma blood agar)上会产生溶血圈,这种现象被称为神奈川现象(Kanagawa phenomenon,KP)。Sakurai等[12]首次发现溶血素直接作用于红细胞,并会导致KP现象。在100 ℃条件下加热10 min,其生物学活性不会丧失,之后将其命名为TDH。研究发现,利用TDH制备的抗血清可以有效抑制KP现象,因此,TDH可用于检测V.parahaemolyticus的致病性。除溶血活性之外,TDH作为一种成孔蛋白,可以在细胞膜上形成通道,改变细胞渗透压,进而破坏肠上皮细胞,增加细菌的侵袭能力[13]。此外,TDH还具有心脏毒性[14-15]。
1985年在马尔代夫爆发的腹泻事件中,临床分离的V.parahaemolyticus呈现KP阴性。研究发现,除TDH以外,还存在另一重要致病因子—TRH[16]。此致病因子的生物学活性与TDH相似,也具有肠毒性和细胞毒性,但其对热的耐受能力最高上限为60 ℃处理10 min[17]。流行病学研究发现,90%~99.8%的临床分离株中可检测到tdh或/和trh基因,而环境分离株中仅0.2%~10%检测为阳性。因此,tdh和trh基因成为判定V.parahaemolyticus是否具有致病性的检测依据[9]。
除了上述两种溶血素之外,V.parahaemolyticus还产生TLH,此种溶血素只在卵磷脂存在条件下才具有溶血活性,因此并不作为其主要毒力相关溶血素[18]。但是,TLH在该菌中广泛及特异性存在,其编码基因tlh制备的基因探针已用于V.parahaemolyticus菌株特异性的检测[19]。
1.2 尿素酶
尿素酶(Urease)由ure基因簇编码,其分子质量为275 kDa,等电点为5.2,在细菌感染中较为常见,是许多细菌重要的致病因子[20-21]。研究表明,V.parahaemolyticus尿素酶和TRH有着密切的关系。Suthienkul等[22]对分离自泰国腹泻患者的489株V.parahaemolyticus的研究发现,8%的菌株呈现尿素酶检测阳性(Ure+),并且这些菌株均含有trh基因,而不携带trh的菌株,其尿素酶检测均呈阴性(Ure-)。Okuda等[23]对1979至1995年美国西海岸分离得到的Ure+和Ure-的V.parahaemolyticus进行检测,结果发现Ure+菌株,分别有90%和98%携带tdh和trh基因,在Ure-菌株中,80%携带tdh而trh的检出率则为0。因此,尿素酶可作为KP检测为阴性的V.parahaemolyticus致病菌株的一个重要生物学标志。
1.3 黏附因子
病原菌与宿主细胞的接触通常是引起感染的首要条件。黏附因子分布于细胞表面或释放到胞外,为其毒性因子与宿主细胞的接触提供平台[24]。研究发现,在V.parahaemolyticus侵染过程中,荚膜多糖(Capsular polysaccharide,CPS)、甘露糖敏感血凝素(Mannose-sensitive hemagglutinin,MSHA)和多价粘附分子7(Multivalent adhesion molecule 7,MAM7)可为细菌提供对宿主细胞的黏附能力。
CPS位于细菌细胞壁外,其组成、结构、细菌的病原性和血清型相关,受LuxR-型群聚转录调控因子OpaR的调控[25]。V.parahaemolyticus的CPS在其致病性中发挥重要作用[26]。研究表明,V.parahaemolyticus存在透明和不透明两种菌落形态,OP型菌落会产生更多的CPS,对上皮细胞Int-407的黏附能力比TR型高出10倍。当TR生长转变为OP型时,其CPS生成能力及对细胞的黏附力也恢复到OP型菌落的水平[27-28]。
MSHA属于IV型菌毛超家族成员,在IV型菌毛的凝血活性中起决定作用,但受甘露糖及其水解产物1-α-D吡喃甘露糖的特异性抑制[29-30]。研究发现,缺失MASH的菌株,对Caco-2细胞的黏附能力下降,并且诱导Caco-2细胞的裂解,并且细胞圆形化和白细胞介素-8(Interleukin-8,IL-8)分泌能力随之减弱,影响菌株对宿主细胞的黏附及致病性[31]。
MAM7在革兰氏阴性菌中保守存在,含有高度保守的N-末端跨膜结构域和七个哺乳动物细胞入侵(Mammalian cell entry,mce)结构域,在细菌黏附宿主细胞的初始过程和III型分泌系统(T3SS)诱导的细胞死亡中起关键作用[32]。研究发现,在非致病性大肠杆菌(Escherichiacoli)中表达MAM7,可使其产生细胞黏附能力[32]。抑制V.parahaemolyticus中MAM7的表达,V.parahaemolyticus对宿主细胞的黏附能力和毒性均下降。在其他存在MAM7的致病性革兰氏阴性菌中也存在这一现象[33-34]。MAM7与膜磷脂酸和纤维连接蛋白相结合,在细菌与宿主细胞之间形成三分子复合物,介导细菌黏附宿主细胞的初始阶段[32,35]。与其他已知的与脂质配体(肌醇磷酸盐或溶血磷脂酸)结合的蛋白,例如,Raf-1,mTOR,SHP-1不同,MAM7与宿主细胞膜磷脂酸具有高度亲和特异性[36]。MAM7与纤维连接蛋白在黏附初始过程中起到拉伸作用,可增大黏附接触面积[10]。MAM7的生物学特性,使其为V.parahaemolyticus或其他致病菌感染疾病的治疗提供了潜在的药物靶标。
2 V. parahaemolyticus分泌系统概述
细菌的分泌系统可介导大分子转运穿过细胞膜,不同细菌所分泌的蛋白质其功能亦有差异,但研究表明,致病菌通常是通过相对较少的几种分泌机制分泌毒性蛋白或效应因子,当其进入外界环境或直接作用于宿主靶位点时即可使宿主致病,目前认为有Ⅰ-Ⅸ九型[37]。其中,较常见的为Ⅰ-Ⅶ型。Ⅰ型分泌系统(Type I secretion system,T1SS)由ATP结合转运蛋白(ABC protein)、膜融合蛋白(Membrane fusion protein,MFP)和外膜孔道构成,主要是一步分泌毒素、细胞表面蛋白、蛋白酶、脂肪酶、细菌素和血红素结合蛋白[38]。Ⅱ型分泌系统(Type II secretion system,T2SS)由12~16个蛋白构成,存在于细菌细胞膜、细胞质和细胞周质中,为两步分泌,首先内膜上的Sec和Tat系统将蛋白转运至细胞周质,之后再由T2SS外膜蛋白将其转运至胞外[39]。G-的IV型分泌系统中菌毛装配蛋白是T2SS中相应蛋白变体,有些时候两种分泌系统共用部分蛋白[40]。Ⅲ型分泌系统(Type Ⅲ secretion system,T3SS)属于一步分泌,由超过20个蛋白组装而成,大多坐落在内膜上,形成注射器状结构,可以将分泌蛋白从供体胞质直接注入到受体胞质,其中10个蛋白质基因同G+和G-中鞭毛编码基因同源[41]。Ⅳ型分泌系统(Type Ⅳ secretion system,T4SS)最初来源于F质粒的发现,是多基因编码实现单一功能的系统,与细菌接合机制有关,介导基因水平转移[42],主要用于转移DNA、DNA-蛋白复合体和一些效应蛋白[43]。根瘤农杆菌(Agrobacterium tumefaciens)的VirB/D4 系统是典型的T4SS,大部分革兰氏阴性菌中发现的T4SS与VirB/D4 T4SS相似,由12个蛋白质组成,包括VirB1-VirB11和VirD4,可以形成一条包括胞外菌毛、胞质ATP酶、核心复合物、转运通道等结构的横跨整个细菌内外膜的通道[44]。V型分泌系统(Type V secretion system,T5SS)是最为简单的分泌系统,也称为自转运系统,为两步分泌。首先经由Sec系统跨内膜转运至细胞周质,之后再由分泌蛋白自身的C末端在外膜上形成β-筒状通道转移至胞外[45]。Ⅵ型分泌系统(Type Ⅵ secretion system,T6SS)最初在霍乱弧菌(Vibriocholerae)和铜绿假单胞菌(Pseudomonasaeruginosa)中被发现,其基因簇由12~25个基因构成,大部分微生物染色体中存在1~2个拷贝,在菌株致病性传播上扮演重要角色[46-47]。Ⅶ型分泌系统(Type Ⅶ secretion system,T7SS)于2009年在结核分枝杆菌(Mycobacteriumtuberculosis)和牛结核分枝杆菌(Mycobacteriumbovis)中被鉴定,共发现5种类型(ESX1-ESX5),与基因组岛相关[48-49]。Ⅲ型分泌系统(Type Ⅲ secretion system,T3SS)和Ⅵ型分泌系统(Type Ⅵ secretion system,T6SS)在V.parahaemolyticus的毒力中起到重要作用。
2.1 Ⅲ型分泌系统
T3SS最早在致病性耶尔森氏菌(Yersiniaspp.)中发现,属于一步分泌,由超过20个蛋白组装而成,大多坐落在内膜上,形成注射器状结构,可以将分泌蛋白从供体胞质直接注入到受体胞质,其中10个蛋白质基因同革兰氏阳性和阴性菌中鞭毛编码基因同源[50-51]。Tagomori[52]于2002年完成了第一株V.parahaemolyticusRIMD2210633的全基因组测序,并且发现该菌含有两套III型分泌系统(T3SS)。测序结果显示出V.parahaemolyticus,霍乱弧菌和其他弧菌在遗传学上可能拥有共同的祖先[53]。V.parahaemolyticus中的T3SS分为两套:一套位于染色体1上,称为(T3SS1),存在于几乎所有已测序的环境或临床分离的V.parahaemolyticus中,基因序列与耶尔森氏菌(Yersiniavanloghem)的T3SS相似[52,54-55]。另一套位于染色体2的毒力岛上,称为T3SS2,只存在于神奈川现象阳性或含有编码耐热直接溶血素相关溶血素(TRH)基因trh的副溶血弧菌中,贡献V.parahaemolyticus的致病力[54-55]。侵染过程中,T3SS向宿主分泌多种毒力因子(图2),T3SS1可引发促炎性反应、裂解细胞,具有细胞毒性,T3SS2具有肠毒性[56]。研究发现,T3SS1缺失了编码内膜蛋白的vcrD1,编码外膜蛋白的vscC1或编码细胞周质蛋白的vscN1任一基因后,菌株对HeLa细胞的毒性明显降低,缺失基因互补表达后,细胞毒性恢复到原始菌株水平,但T3SS2结构蛋白编码基因缺失后,细胞毒性几乎不发生改变[57-58]。

图2 V. parahaemolyticus Ⅲ型分泌系统介导的效应蛋白Fig.2 Type Ⅲ secreted effectors of V. parahaemolyticus
2.1.1 T3SS1结构 T3SS1系统可转运的4种分泌蛋白(VopQ、VopR、VopS和VPA0450)。其中,VopQ由vp1680基因编码,可诱导PI3激酶不依赖的HeLa细胞自噬,阻止小鼠巨噬细胞(RAW264.7)对副溶血弧菌的胞吞,并且作为MAPK信号途径的激活蛋白,间接影响IL-8的分泌,是介导细胞毒性的主要毒力因子[59-61]。VopR位于细胞质膜促进细胞圆形化,并不直接导致细胞毒性,目前的作用机理还不明确[62-63]。VopS通过抑制NF-kB的活性介导Toll-样受体依赖型巨噬细胞凋亡,还能在侵染引发吞噬的早期阶段,抑制宿主细胞肌动蛋白的集聚和巨噬细胞肌动蛋白的快速重排,利于病原菌抵抗巨噬细胞的吞噬,引致细胞骨架破坏,细胞变圆后裂解[64-65]。最近的研究发现,VopQ 和VopS还会抑制炎性小体活性,有利于保护菌体免受宿主炎症反应诱发的机体对致炎因子的清除[66-67]。VPA0450是一种5′-磷脂酰肌醇磷酸酶,通过水解胞质膜上的二磷酸酯,破坏细胞支架结合位点使质膜出泡,破坏细胞膜的完整性,引起细胞裂解[68]。此外,T3SS1还介导其他的毒力相关蛋白的分泌,例如,VopD编码基因缺失突变株对兔红细胞的溶血性及细胞毒性均下降[60],Vp1659影响肌动蛋白重排同时会诱导细胞发生自噬[69]。
2.1.2 T3SS2功能 T3SS2系统转运分泌蛋白,除VopA、VopC、VopL和VopT之外(图1-2),还包括VopV、VopO和VopZ。VopA是一种乙酰转移酶,可以抑制丝裂原活化蛋白激酶的信号传递途径,抑制细胞分裂,引发生长停滞[70]。VopC是一种脱酰胺酶,可促进被感染细胞内形成肌动蛋白应力纤维,与致病性大肠杆菌的细胞毒性因子(CNF1)高度同源(38%)[71]。VopL也可促进被感染细胞内形成肌动蛋白应力纤维,拉长细胞的肌动蛋白[72]。VopT是一种核糖转移酶,可将ADP-核糖体转移到GTP酶的单体蛋白Ras上抑制其活性,对V.parahaemolyticus的侵染起了重要的作用并且贡献了V.parahaemolyticus对Caco-2的细胞毒性[73]。VopV作为纤维状肌动蛋白结合效应器,在含有T3SS2的V.parahaemolyticus中贡献肠毒性[74]。VopO作为T3SS2关键的效应蛋白,可激活RhoA-ROCK途径,促进T3SS2依赖型应力纤维的形成,同时参与到对上皮细胞的破坏[75]。VopZ通过抑制一种炎症反应相关酶TAK1引发腹泻及肠道疾病[76]。另外,V.parahaemolyticus中新发现的一种T3SS2效应蛋白VPA1380是一种需要肌醇己糖磷酸(IP6)诱导的半胱氨酸蛋白酶,在酵母中表达,对菌株产生毒性[77]。
2.2 Ⅵ型分泌系统
T6SS最初在霍乱弧菌(Vibriocholerae)和铜绿假单胞菌(Pseudomonasaeruginosa)中被发现,其基因簇由12~25个基因构成,大部分细菌染色体中存在1~2个拷贝,为倒置的T4噬菌体结构,在细菌致病性传播上扮演重要角色,介导细菌对宿主细胞的黏附作用[78-79]。T6SS在37 ℃条件下无活性,其对宿主的影响主要不是通过分泌蛋白来完成,可能还依靠于其他的毒力因子[80]。与T3SS相似,根据所处位置不同,T6SS分为T6SS1和T6SS2。T6SS1只存在临床分离的V.parahaemolyticus中,而T6SS2在环境与临床分离株中均存在[80-81]。T6SS1在温暖的海洋环境中(3% NaCl,30 ℃)较为活跃,可通过三种效应蛋白(VP1415,VP1388和VPA1263)抵抗环境中其他细菌分泌的有害物质并选择性的抑制其他细菌的生长,增强其的环境适应性[82-83]。T6SS2在低盐低温环境中(1% NaCl,23 ℃)较为活跃。研究发现,T6SS1的结构基因(icmF1)和效应蛋白(hcp1)的缺失,会降低该菌对HeLa和Caco-2细胞的黏附能力,而T6SS2相关基因缺失仅影响细菌对HeLa细胞的黏附能力[84]。
2.2.1 T6SS结构 不同细菌中T6SS结构蛋白相对比较保守,构成了分泌系统的核心组件。这些蛋白包括IcmF-和IcmH-样蛋白、脂蛋白、ClpV以及转位蛋白Hcp和VgrG[11]。位于细菌细胞膜中的T6SS的核心组件DotU和IcmF,对分泌系统的稳定至关重要[85]。目前,研究T6SS中最为关注的一个结构蛋白是IcmF,它参与Hcp导管的形成与跨膜,缺失了IcmF编码基因的细菌无法在上清中检测到Hcp蛋白[46,86-87]。
转位蛋白包括Hcp和VgrG,Hcp和VgrG分别类似噬菌体尾巴和尾穗蛋白,它们共同构成T6SS装置整个细胞外部分,形成分泌蛋白的管道,帮助分泌蛋白跨膜转运,最终到达宿主表面[88]。Hcp是一个内径为40 nm的六环形,当T6SS处于活化状态时,Hcp在细胞周质中叠成长导管,嵌合于VgrG下面,能够穿过细菌外膜;VgrG类似T4噬菌体穿刺细胞膜的针尖状结构,能够穿刺细菌细胞膜并将DNA注入到细菌的细胞质中[89]。一旦与宿主细胞接触,VgrG针尖状结构会穿透脂蛋白双分子层,将原本隐藏的效应区域暴露于宿主细胞质中,使之与宿主细胞靶分子相互作用,继而影响宿主细胞功能。当VgrG针尖状结构从T6SS脱离后,会形成没有加盖的Hcp管道,效应蛋白会通过此管道进入宿主细胞,这也阐明了T6SS和噬菌体尾部刺突在结构和进化上的关系[89]。
2.2.2 T6SS功能 目前研究T6SS的热点问题集中在其对巨噬细胞的细胞毒性上。研究发现霍乱弧菌V52感染巨噬细胞J774后,细胞形态发生明显变化,构建icmF样基因vasK突变株感染巨噬细胞后发现,细胞形态无明显变化,由此推测出T6SS介导霍乱弧菌对巨噬细胞的毒性[46]。对嗜水气单胞菌(Aeromonashydrophila)的T6SS研究发现,其对HeLa细胞也具有细胞毒性。霍乱弧菌T6SS的主要结构蛋白IcmF在体外被证实能够促进细菌对肠上皮细胞的枯附能力[89]。缺失icmF的鸡致病性大肠杆菌能够降低对上皮细胞的粘附能力。由此推测T6SS介导细菌对细胞的粘附能力。霍乱弧菌的转位蛋白VgrG1的C端含有肌动蛋白交联相关结构域(ACD domain),在体外试验中,VgrG1能与可以共价性的结合肌动蛋白,扰乱宿主细胞的肌动蛋白骨架[88]。
Parsons等[90]研究发现T6SS在鼠伤寒沙门氏菌(Salmonellatyphimurium)中能够限制细菌在巨噬细胞中的复制能力,降低毒力,从而使细菌在巨噬细胞中长期存活。Chow等[91]发现缺失了T6SS的关键蛋白后,幽门螺旋菌(Helicobacterpylori)对小昆肠道上皮细胞(IEC)的粘附和定殖能力升高,感染的免疫缺陷小鼠的炎症反应加剧,T6SS降低了肝幽门螺旋菌在宿主内的生长能力和毒力。Weber等[92]发现缺失了T6SS结构基因和转位基因的鳗弧菌(Vibrioanguillarum)在高氧化性,高酒精度以及低pH的条件下,其存活率要明显低于亲本细菌。由此可以得出T6SS具有致病力的同时也可以限制细菌的复制和致病力,并且有利于鳗弧菌适应外界环境。
3 鞭毛、生物被膜与群体感应
V.parahaemolyticus具有两种类型的鞭毛,一种为单端生鞭毛,由6种鞭毛蛋白组成,决定其游动能力,在pH8的高盐环境中,具有单端生鞭毛的菌株运动速度可达60 μm/s[58]。另一种为周生鞭毛,当V.parahaemolyticus生存于过于黏稠或离子缺乏的环境条件下,菌株游动性被抑制,此时会产生许多无鞘的周生鞭毛,引起菌株集聚,而细菌的群体感应通过自身诱导物质(Auto-inducer,AI)的信号分子,感知环境中细菌菌群的数量,继而启动菌体中相关基因的表达,产生毒素、形成生物膜来适应环境的变化[93]。鞭毛系统、生物被膜、群体感应与细胞黏附相互关联,同黏附因子相似,可为细菌与宿主细胞的接触提供平台,在细菌侵染的初始阶段起关键作用并同时参与到菌株对抗生素的耐受性,引发较为严重的临床问题[94]。
4 总结
V.parahaemolyticus是一种重要的食源性致病菌,广泛存在与海洋环境中。近年来,随着对V.parahaemolyticus分泌蛋白研究的不断深入,已能从致病性和耐药性传播方面更好的阐述其作用机制。但未来仍有很多问题需要解决,例如:宿主细胞内不同的分泌蛋白是如何发挥功能的,分泌途径是如何识别底物的,各分泌系间是否存在相互作用。另外,相对于其他分泌系统,T6SS的探索还处在初级阶段,对于上述问题的探索和理解在细菌致病机理及制定相应防控措施上具有重要意义。

