基于Label-free技术分析补骨脂二氢黄酮甲醚的肝毒性作用机制
朱 月,王 姗,徐丽娇,孙晓波,季宇彬,孙桂波*
(1.哈尔滨商业大学药学院,哈尔滨 150076;2.哈尔滨商业大学药物工程技术研究中心,哈尔滨 150076;3.中国医学科学院、北京协和医学院药用植物研究所药理毒理中心,北京 100193)
药物性肝损伤(DILI)是指在疾病治疗过程中,由于药物或其代谢产物引起的肝细胞毒性损害或肝脏对药物及代谢产物过敏所致的疾病。DILI可在无肝脏疾病的人群中发生,在已有基础肝脏疾病的患者中更易发生〔1〕。补骨脂二氢黄酮甲醚(Bavachinin,BVC)是补骨脂乙醇提取物中的一种黄酮类化合物,研究表明其具有抗炎、抗肿瘤、抗氧化、神经保护、治疗哮喘及心血管疾病等作用,在药物开发与临床应用中价值较大〔2〕。现有研究表明BVC具有明显的肝细胞毒性〔3〕,但该化合物的肝毒性靶点尚不明确,不利于其开发研究,因此明确其肝毒性靶点至关重要。
非定量法(Label-free)定量蛋白质组学技术是一种非标记的差异蛋白质组学技术,该技术不使用同位素标记物,而是直接根据质谱峰的强度来对肽段或蛋白进行相对定量〔4〕。首先,将提取所得到的蛋白质酶解产生肽段,应用液质联用技术(LC-MS/MS)对肽段进行分离,然后使用特定软件检索原始质谱数据,解析出不同样本中各个肽段的定量信息,进而获得在不同样本中蛋白质的定性和定量信息。该技术的优势有样本操作量少,检测到的低丰度蛋白较多,这些优势使Label-free定量蛋白质组学技术快速成为近年来重要的质谱定量方法。本研究利用Label-free蛋白质组学技术,Proteome Discover软件结合uniprot-homo+sapiens20180702_173026.fasta数据库,系统分析蛋白质组分差异,筛选在BVC作用前后蛋白质组分的变化趋势,为探索BVC引起肝毒性的关键蛋白,进一步研究BVC肝毒性机制提供参考依据。
1 材料与仪器
1.1细胞HepaRG细胞购自上海冠导生物工程有限公司。
1.2药物与试剂补骨脂二氢黄酮甲醚(批号:161205),纯度99.93%,购自上海融禾医药科技发展有限公司;碳酸氢铵(Sigma,批号:09830-500G);尿酸(Sigma,批号:U5378);Tris(Amresco,批号:0497);碘代乙酰胺(Vetec,批号:V900335-5g);二硫苏糖醇(Genview,批号:CD116-25g);胰蛋白酶(Promega,批号:V5113);甲酸(Sigma,批号:94318);氨水(Sigma,批号:318612);乙腈(Sigma,批号:34851);胎牛血清(Gibco,批号:42Q1627K)。
1.3仪器超净工作台(上海智成分析仪器制造有限公司,ZHJH-C1115B);二氧化碳细胞培养箱(美国Thermo Scientific,Heraeus BB15);倒置荧光显微镜(美国Life Technologies,EVOSFL Ima-ging);高速离心机(Thermo Scientific,Pico 17 Centrifuge);热干浓缩仪(Thermo Scientific,SC210A);电子天平(赛多利斯科学仪器,SQP)。
2 方法
2.1细胞的培养与蛋白质的提取取对数生长期的细胞,用新鲜的完全RPMI-1640培养基将细胞密度调整到2×105个/mL后,接种到HepaRG细胞培养瓶中,每瓶接种5 mL(含细胞1×106个),在二氧化碳培养箱中预培养24 h后,药物组加入终浓度为6.25μmol/L的BVC作用24 h,对照组加等体积的RPMI-1640培养基作用24 h。
24 h后,收集上清液于离心管中,1 500 r/min离心5 min。每个培养瓶加入1 mL胰蛋白酶,37℃消化5 min,待细胞完全消化后加入含有胎牛血清的培养基终止消化,慢慢吹打细胞至细胞全部脱离瓶壁,收集细胞悬液于离心管中,1 500 r/min离心5 min,倒掉上清液,-20℃存放。采用北京邦菲生物科技有限公司哺乳动物组织总蛋白提取试剂盒提取蛋白。
2.2蛋白酶解首先进行蛋白质定量,然后取60μg定量好的蛋白溶液于离心管中。加入5μL 1 mol/L二硫苏糖醇溶液混匀,37℃孵育1 h;加入20μL 1 mol/L碘代乙酰胺溶液,混匀后,室温避光孵育1 h;转移样品至超滤管中,离心后弃去上清;加入100μL尿酸至超滤管中,离心后弃去上清,重复2次;加入50 mmol/L碳酸氢钠100μL,离心后弃去上清,重复3次;更换新收集管,在超滤管中加入胰蛋白酶,按照蛋白和酶50:1的比例加入胰蛋白酶,37℃酶解12~16 h。
2.3质谱分析
2.3.1 毛细管高效液相色谱 每份样品采用高效液相系统进行分离。样品由自动进样器进样到质谱柱,再经分析柱分离,流速及相关液相梯度见表1。

表1 液相色谱洗脱梯度参数
2.3.2 质谱鉴定 每份样品经毛细管高效液相色谱分离后用质谱仪进行质谱分析。
2.4数据分析采用Proteome Discoverer 2.1进行数据分析,肽鉴定使用SEQUST搜索引擎与人类蛋白质组数据库。参数设定:肽质量耐受:±15 ppm;MS/MS耐受性:0;酶解方式:胰蛋白酶;固定修饰:氨基甲基;可变修饰:氧化。
2.5生物信息学分析采用PANTNER对鉴定出的差异蛋白进行生物学分析,对表达差异蛋白进行蛋白功能富集与分析。通过KEGG通路数据库对差异蛋白所在的信号通路进行分析与筛选。
3 结果
3.1蛋白浓度测定通过测定样品吸光度,利用考马斯亮蓝(Bradford)法标准曲线计算出样品蛋白浓度。见表2。
表2 样品蛋白浓度
3.2 HepaRG细胞加入BVC前后差异表达蛋白经鉴定共有差异蛋白372个,其中上升趋势蛋白有170个,下降趋势蛋白有202个。见图1。采用两组样本间的蛋白质表达差异倍数(FC)和t检验得到的P值两个因素共同绘制火山图,用于显示两组样本数据的显著性差异。

图1 差异蛋白火山图
3.3差异蛋白生物过程分析经数据库搜索共得出差异蛋白372个,蛋白生物过程表明蛋白质组分富集于RNA的加工和修饰、细胞周期调控、细胞分裂、染色体划分、细胞防御机制、信号传导机制、能源生产和转换、碳水化合物转运和代谢、脂质转运和代谢、辅酶转运和代谢、氨基酸转运和代谢、核苷酸转运和代谢等生物过程。见图2。
3.4差异表达蛋白GO分析对鉴定出的372个差异蛋白进行GO分析,结果表明:参与生物过程的蛋白分别涉及代谢过程、细胞过程等,参与细胞组成的差异表达蛋白分别位于细胞连接部、细胞外区部、膜部等,参与分子功能的蛋白分别涉及结合物受体活性、催化活性、分子功能调节剂、分子换能器活性、结构分子活性等。见图3。
3.5差异表达蛋白信号通路鉴定与分类KEGG通路分析表明,差异蛋白共涉及30条信号通路。其中代谢途径与氨基酸降解途径所涉及的差异蛋白较多。见图4。

图2 差异蛋白生物过程分析
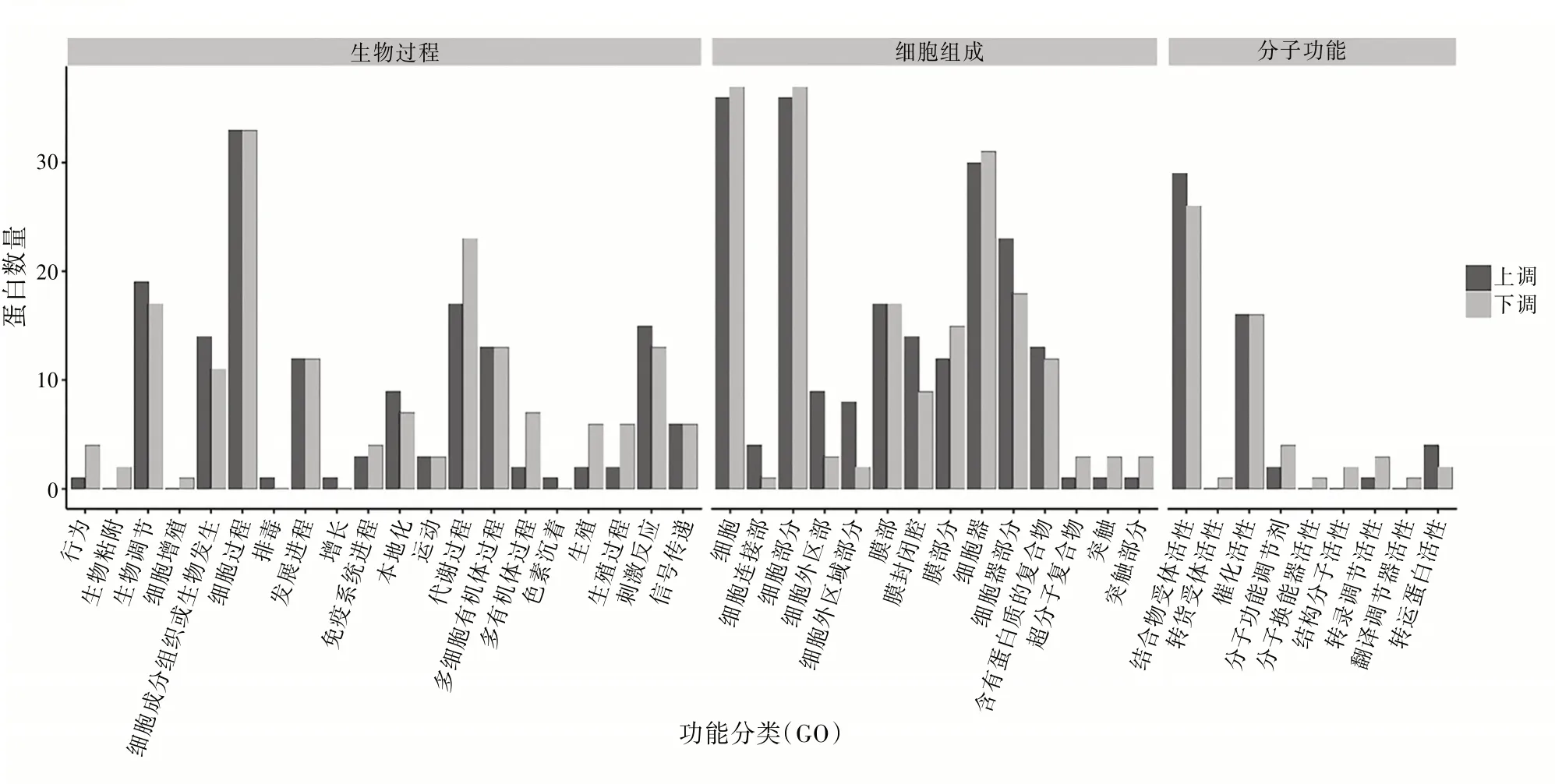
图3 差异表达蛋白GO分析
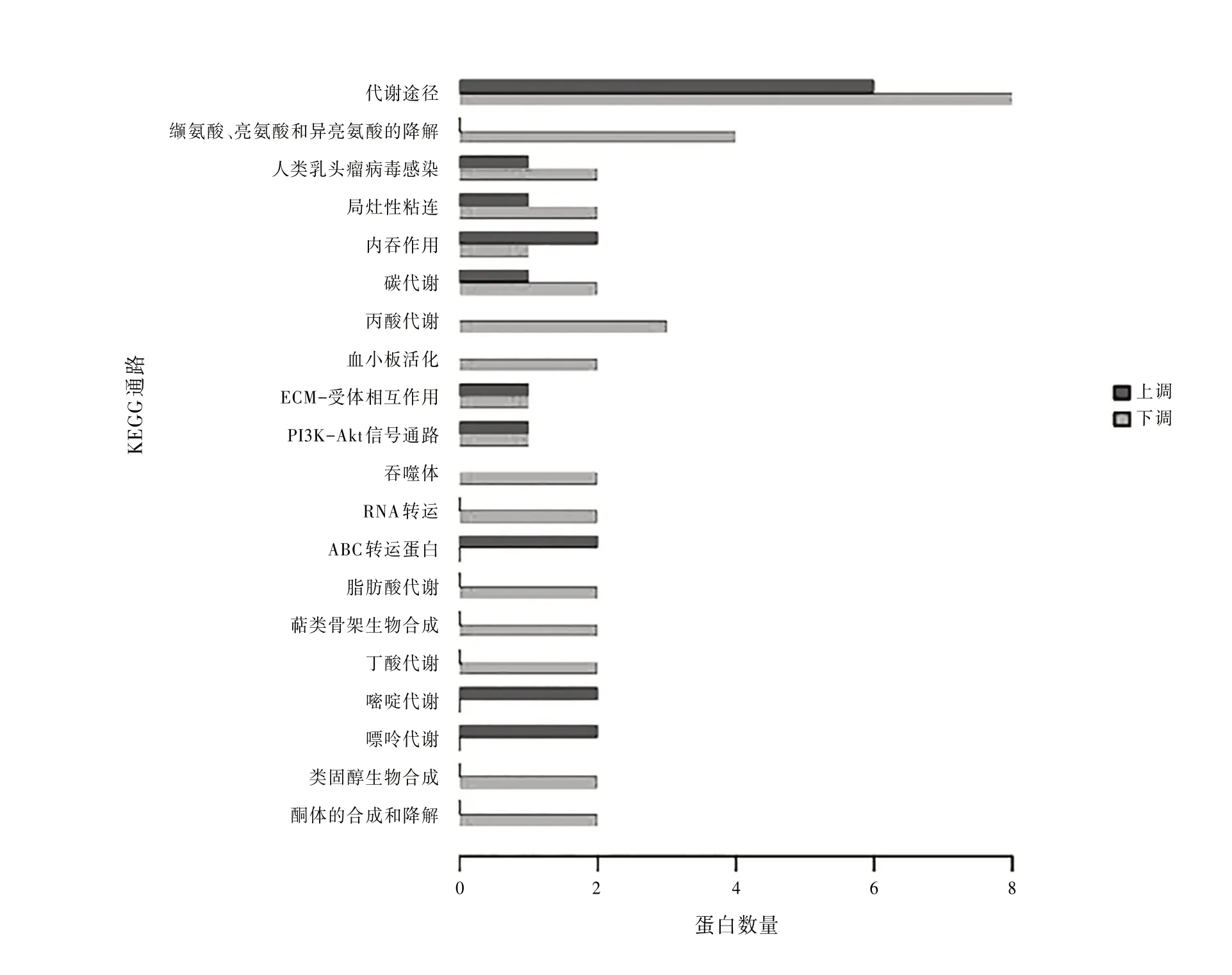
图4 KEGG通路
4 讨论
肝脏在异体生物化合物的转化和代谢中具有重要作用,异体生物化合物的转化和代谢反过来又可导致肝脏出现各种并发症〔5〕。药物引起的肝毒性是近年来的研究热点之一,在新药的研发中肝毒性的研究也十分重要。所以明确药物导致肝损伤的作用机制十分重要。
本研究应用Label-free高通量蛋白质组学分析技术,比较在HepaRG细胞经BVC处理前后蛋白质组分的差异变化。结果表明,获得的差异蛋白共有372个,其中上升趋势蛋白170个(P≤0.05,FC≥1.500),下降趋势蛋白202个(P≤0.05,FC≤0.667)。然后,在上升和下降趋势表达蛋白中筛选出变化较大的前十名蛋白进行分析。结果表明,这20种蛋白所作用的生物过程各不相同。在上升趋势蛋白中,GPC1的FC值最高,变化趋势最明显。GPC1蛋白能够与铜离子、成纤维细胞生长因子、肝素硫酸多糖以及层粘连蛋白结合。且研究发现GPC1基因可通过调节PTEN/Akt/β-Catenin通路促进食管鳞状细胞癌细胞的侵袭式增殖〔6〕。同时GPC1基因也是直肠癌、胰腺癌、食管鳞状细胞癌的特异性标志物以及治疗靶点〔7-8〕。因此,我们推测BVC可能诱导GPC1基因的高表达影响细胞中AKT、AMPK、EGFR等通路,从而影响细胞的迁移与生长而导致肝细胞毒性。下降趋势蛋白中UPF2的变化趋势较明显,UPF2蛋白与细胞核mRNA的输出有关〔9〕。mRNA又称信使RNA,是携带遗传信息在蛋白质合成时充当模板的RNA〔10〕。蛋白质是生命的物质基础,是生命活动的主要承担者,没有蛋白质就没有生命。机体中的每一个细胞和所有重要组成部分都有蛋白质参与〔11〕。而UPF2蛋白的表达下降可导致mRNA的输出降低从而影响蛋白质的合成。蛋白质的合成降低,细胞无法进行正常的生命活动从而导致肝损伤。所以我们推测BVC引起UPF2蛋白的表达下降,导致mRNA的输出降低,蛋白质合成减少,从而导致肝损伤。
在差异蛋白的生物过程分析中,我们发现其中有10种蛋白与翻译、核糖体结构与生物发生有关(Q09028、Q9Y2P8、Q08257、Q8NBN7、Q15293等),6种蛋白与RNA的加工和修饰有关,13种蛋白与翻译有关(Q8WUD1、Q02127、O95363、P53597、Q96SI9等),10种蛋白与翻译后的修饰和蛋白质的逆转有关(Q9BTZ2、Q5TDH0、Q96GQ7、Q8TDD1、O14578等),11种蛋白与脂质转运与代谢有关(P33908、Q9Y383、P11047、Q8WVC0、Q9NZL4等)。表明BVC可能通过调节RNA的加工和修饰、蛋白质的翻译与转录,以及翻译后的修饰和蛋白质的逆转从而影响脂质的转运与代谢。脂质在体内承担的主要责任是氧化供能,机体的能量仓库是脂肪组织,脂肪也能协同皮肤、骨骼、肌肉保护内脏,防止体温散发和帮助食物中脂溶性维生素的吸收。脂质代谢紊乱是指由于先天或后天因素造成的血液及其他组织器官中脂质及其代谢产物质和量的异常〔12〕。所以我们推测BVC可能通过降低脂质的转运与代谢能力,导致细胞代谢紊乱而产生肝细胞毒性。
在进行了差异蛋白的GO分析后,本研究又进行了KEGG通路分析,分析发现位于代谢通路的差异蛋白最多,其中上升趋势蛋白有17个,下降趋势蛋白有41个。代谢途径是指在生物体内由酶催化的一连串在细胞内发生的化学反应,形成使用或储存的代谢物,从而保持细胞内环境的稳态。代谢途径是维持细胞稳定良好生长非常重要的一条通路,代谢紊乱可引起身体的各种疾病,例如糖尿病由糖代谢紊乱引起,高脂血症由脂代谢紊乱引起,痛风由尿酸代谢紊乱引起等等。所以维持代谢的稳定十分重要〔13〕。而我们的研究结果表明BVC可引起代谢通路中大量基因的改变,所以我们推测BVC所诱导的肝损伤是由于代谢通路中基因的改变从而导致代谢紊乱而引起的。
BVC药理作用广泛,开发研究的价值较大,所以明确其肝毒性机制更利于其开发研究。本实验利用Label-free高通量蛋白质组学分析技术与KEGG信号通路分析技术研究推测BVC可能通过影响代谢通路中的某些基因而导致细胞代谢紊乱从而引起肝毒性。但BVC具体作用于哪些基因与通路还有待进一步验证。

