自愿转轮运动对慢性应激大鼠焦虑及抑郁样行为、前额叶皮质炎症因子及NGF/TrkA信号通路的影响
崔建梅,王卓琳,郭燕兰,李中华,于 芳,李洪涛,苏晓云
精神疾病对人类健康构成重大威胁。研究认为,抑郁障碍和焦虑障碍是高度共病的,并且应激是2 种疾病的共同危险因素[1]。多数学者研究发现,外部应激因素(如应激生活事件)和内部应激因素(如慢性炎症)可导致下丘脑-垂体-肾上腺轴(HPA)功能的应激性改变,使大脑小胶质细胞产生促炎细胞因子[2],而促炎因子可通过影响神经回路和神经递质引起抑郁样行为,包括快感缺乏、睡眠变化和社交活动减少等[3]。并且R.KRISHNADAS等[4]发现,对传统抗抑郁药不起作用的抑郁症患者可表现出一种独特的促炎倾向。前额叶皮质与思维和行为调节密切相关,H.ANISMAN等[5]报道,应激会增加前额叶皮质促炎细胞因子水平(IL-1β、IL-18、TNF-α等),导致细胞增殖减少和神经发生障碍,与抑郁及焦虑行为发生有关。神经生长因子(Nerve Growth Factor,NGF)在神经发生和突触可塑性方面发挥关键作用,并且脑内NGF 活性主要由其受体酪氨酸激酶A(TrkA)介导,对维持损伤神经元的结构,促进神经生长和修复具有重要作用[6]。通过临床及动物实验证实,NGF 与抑郁样行为有关,已经被视为抗抑郁药的作用靶点[7],但是通过NGF通路治疗抑郁症的机制尚不清楚。A.H.MILLER 等发现,促炎因子活性增加可能会通过降低NGF水平,从而改变神经发生和可塑性,最终导致抑郁[8],而给与抗抑郁药NGF可通过影响大脑细胞炎症因子活性改善抑郁症状[9]。因此可以认为,NGF/TrkA通路及神经炎症因子可能在慢性应激诱导的抑郁及焦虑样行为中发挥重要作用。
临床试验表明,体育锻炼可以产生抗抑郁和抗焦虑作用[10],同样在抑郁和焦虑样行为的动物模型中也观察到类似结果[11]。并且在临床和啮齿动物研究中均发现,运动可以通过调节某些神经递质和神经营养素的表达改善抑郁模型大鼠抑郁及焦虑样行为。有证据表明,运动诱导的NGF上调及炎症反应减弱对海马结构和功能的改变是重要的,在突触功能和学习记忆方面起重要作用[12]。但是,运动改善慢性应激大鼠焦虑及抑郁样行为是否与大脑前额叶皮质NGF通路及炎症因子改变有关,相关文献较少涉及。因此,本研究通过复制CUS抑郁模型,探讨4周自愿转轮运动对CUS大鼠焦虑及抑郁样行为的影响,及确定这些影响是否与前额叶皮质(prefrontal cortex,PFC)炎症因子(IL-6、TNF-a及抗炎因子IL-10)及NGF/TrkA通路有关。
1 材料和方法
1.1 动物及分组
44只雄性成年SD(Sprague-Dawley)大鼠(山西医科大学实验动物中心),重(200±20)g,被安置在室温(22±2)℃、湿度50%±10%、12 h昼夜循环光照的动物饲养室,大鼠可自由摄食及饮水(除禁水、禁食期间)。大鼠购回适应饲养室环境1周后,所有大鼠被随机分为4 组,即安静对照组(control group,C)、运动组(exercise group,E)、应激模型组(CUS group)和应激运动组(CUS treaded with exercise group,CUS+E)。
CUS 组及CUS+E 组大鼠单独喂养,其中,每组6 只大鼠用于前额叶皮质炎症因子含量测试,其余每组5 只大鼠用于测量前额叶皮质NGF及TrkA表达。
1.2 CUS模型建立
适应实验室环境1 周后,CUS 组及CUS+E 组大鼠根据H.ZHENG 等[13]采用的慢性不可预知应激方法制作大鼠抑郁模型。每周7 种应激刺激顺序随机安排,且每种刺激在每一轮中出现的次序不同(1 种应激/每天),连续刺激28 天,应激刺激见表1。

表1 大鼠慢性不可预知应激7种应激程序Table1 Stress Program of Chronic Unpredictable Restraint Stress
1.3 自愿转轮运动方案
(1)CUS 组大鼠从第2 周(第8 天)开始,接受为期4 周的CUS。(2)CUS+E 及 E 组大鼠在整个实验过程中从第 2 周开始接受自愿转轮运动,笼内有1 个可自由转动的跑轮(直径33 cm,宽度10 cm),动物可自由进跑轮进行锻炼,为期4 周,红外线检测装置和数据分析系统自动采集数据,同时每天接受1 次CUS 程序。非应激模型组大鼠除必要的例行鼠笼清洁,不做任何干扰。
1.4 高架迷宫实验(elevated plus maze,EPM)
第36天进行EPM实验,评估啮齿动物的焦虑水平,高架迷宫包括2 个开放臂和2 个闭合臂,中间有一平台连接开放臂和闭合臂。自愿转轮运动及应激程序结束后第2 天,所有大鼠接受EPM测试,大鼠被放置在迷宫中心平台(面对开放臂)探索迷宫5 min,迷宫软件记录并分析大鼠的焦虑样行为。
测试指标:开放臂时间(time spent in the open arm,OA),闭合臂时间(time spent in the closed arm,CA),进入开放臂次数(open arm entries,OE)及闭合臂次数(closed arm entries,CE)。统计指标:OA%=OA/(OA+CA);OE%/(OE+CE);焦虑指数:1-(OA%+OE/%),比值越大,表明大鼠的焦虑程度越严重。
1.5 开场实验
EPM 结束后24 h(第37 天),所有大鼠进行开场实验测试。开场实验箱(1 m×1 m×0.5 m),底面用黑线分成25 个方格。将大鼠放在试验箱中央,自由探索5 min,上方摄像头记录大鼠实验箱内的行为学指标:跨格次数(以3 只脚爪进入1 个新格为准,次)、中央格时间(s)和粪便颗粒(颗)。为减少人为误差,2人同时观察并记录每只大鼠实验数据,取平均值。
1.6 前额叶皮质炎症细胞因子水平测量
开场实验测试结束后,即刻将每组6只大鼠断头取脑,冰生理盐水冲洗干净后迅速分离前额叶皮质称重,并用生理盐水按(1:9)的比例制成10%前额叶皮质组织匀浆,离心(12 000 rpm/min,10 min)后取上清液,采用ELISA(双抗体夹心酶联免疫吸附)法,参照试剂盒说明进行前额叶皮质炎症因子IL-6、TNF-a水平和IL-10水平的测定。
1.7 大鼠前额叶皮质NGF及其受体TrkA免疫组化检测
开场实验测试结束后即刻对每组剩余5只大鼠经水合氯醛(10%,150 mg/kg)麻醉后,4%多聚甲醛溶液心脏灌注取脑,石蜡包埋脑组织,前额叶皮质经石蜡切片机连续冠状切片(片厚5 μm),切片依次经梯度乙醇脱蜡、脱水后滴加30%H2O2室温孵育30 min,PBS液漂洗3次后滴加兔抗大鼠NGF及TrkA单克隆抗体(1:200),4 ℃过夜,PBS液漂洗3次后滴加生物素化山羊抗小鼠NGF及TrkA二抗孵育(37 ℃、30 min),PBS液清洗后DAB室温显色10 min,苏木素复染2~3 min,梯度乙醇脱水,二甲苯透明,中性树脂封片。
根据大鼠脑立体定位图谱确定大鼠前额叶皮质位置(见图1),用数码显微镜拍片(每个切片在前额叶皮质同一区内取3个视野),应用江苏捷达形态学分析系统对大鼠前额叶皮质NGF及TrkA 阳性神经元的表达进行分析,计数NGF 及其受体TrkA免疫阳性细胞数量及面积(μm2)。

图1 大鼠脑立体定位图Figure1 Stereotactic Image of Rat Brain
1.8 统计学处理
数据统计采用SPSS18.0 软件,数据结果用M±SD表示,焦虑及抑郁样行为学指标及前额叶皮质炎症因子(TNF-a、IL-6、IL-10)和NGF及TrkA表达采用双因素方差分析,组间差异比较采用LSD post hoc法,P<0.05为显著性差异,P<0.01为极显著性差异。
2 结 果
2.1 自愿转轮运动对CUS大鼠焦虑样行为的影响
双因素方差分析显示,慢性应激显著影响大鼠高架迷宫实验中开放臂次数、时间比例及焦虑指数(F(1,43)=9.830,P=0.003;F(1,43)=6.993,P=0.012;F(1,43)=6.502,P=0.015),而运动除显著影响开放臂次数比例外(F(1,43)=5.543,P=0.024),对开放臂时间比例及焦虑指数均无显著影响(F(1,43)=2.090,P=0.156;F(1,43)=2.266,P=0.140)。并且,运动和慢性应激对开放臂时间比例均有显著交互效应(F(1,43)=5.152,P=0.029),对开放臂次数比例(F(1,43)=1.185,P=0.283)和焦虑指数(F(1,43)=0.533,P=0.470)均无显著交互效应。
与C 组比较,CUS 组大鼠高架迷宫实验中开放臂时间(P=0.042)及次数比例(P=0.005)均显著下降,焦虑指数显著增加(P=0.026);而经过4 周自愿转轮运动,CUS 运动组大鼠与CUS组大鼠比较,开放臂时间(P=0.018)及次数比例(P=0.019)均显著增加,但对焦虑指数无显著影响(P=0.122);而与C组比较,运动组大鼠开放臂时间(P=0.996)、次数比例(P=0.376)和焦虑指数(P=0.376)均无显著改变(见图2)。
2.2 自愿转轮运动对CUS大鼠抑郁样行为的影响
双因素方差分析显示,慢性应激和自愿转轮运动显著影响了大鼠跨格次数(F(1,43)=21.671,P=0.000;F(1,43)=4.201,P=0.047)和粪便颗粒(F(1,43)=33.353,P=0.000;F(1,43)=4.464,P=0.041),而只有慢性应激影响了大鼠中央格时间(F(1,43)=6.855,P=0.012);并且,运动和慢性应激对粪便颗粒(F(1,43)=3.353,P=0.075)、中央格时间(F(1,43)=0.215,P=0.645)和跨格次数(F(1,43)=1.836,P=0.183)均无显著交互效应。

图2 各组大鼠高架迷宫实验中开放臂时间比例(OA%)、开放臂次数比例(OE%)及焦虑指数结果比较。Figure2 Comparation of the OA%,OE%and Anxiety Index in EPT in Various Groups
与C 组比较,CUS 组大鼠开场实验中跨格次数显著减少(P=0.000),中央格时间和粪便颗粒显著增多(P=0.035,P=0.000)。经过4周自愿转轮运动,CUS+E组大鼠与CUS组大鼠比较,跨格次数显著增多(P=0.021),粪便颗粒减少(P=0.008),而中央格时间无显著改变(P=0.260);且与C 组比较,运动组大鼠开场实验中跨格次数、中央格时间和粪便颗粒均无显著改变(P>0.05)(见表2)。

表2 各组大鼠开场实验中跨格次数、中央格时间及粪便颗粒结果(M±SD,n=44)Table2 Results of the Number of Crossings,Time Spent in the Center and Fecal Particles in OFT Test in Various Groups
2.3 自愿转轮运动对CUS大鼠前额叶皮质IL-6、TNF-a及IL-10水平的影响
双因素方差分析显示,慢性应激显著影响大鼠前额叶皮质IL-6(F(1,23)=15.761,P=0.001)、TNF-a(F(1,23)=4.201,P=0.013)和IL-10(F(1,23)=4.201,P=0.002)水平;运动只显著影响前额叶皮质TNF-a(F(1,23)=4.201,P=0.013)水平,对 IL-6(F(1,23)=0.597,P=0.449)和IL-10均无显著影响(F(1,23)=1.976,P=0.175);运动和慢性应激对 IL-6(F1,23=0.205,P=0.655)、IL-10(F(1,23)=1.921,P=0.181)和TNF-a水平(F(1,23)=4.197,P=0.054)均无显著交互效应。
与 C 比较,CUS 组大鼠促炎因子 IL-6 和 TNF-a 水平显著增加(P=0.005,P=0.008),增加幅度分别为24.35%和20.45%;抗炎因子IL-10水平显著下降(P=0.001),下降幅度为22.69%。经过4周自愿转轮运动,CUS+E组与CUS组大鼠比较,TNF-a水平下降(P=0.024),IL-10 水平增加(P=0.022),IL-6 水平无明显变化(P=0.396);与C组比较,运动组大鼠前额叶皮质IL-6、TNF-a和IL-10水平均无显著改变(P>0.05)(见表3)。

表3 各组大鼠前额叶皮质炎症因子IL-6、TNF-a及IL-10水平结果(M±SD,n=24)Table3 Results of the Prefrontal Cortex Inflammatory Biomarkers(IL-6,TNF-a and IL-10)in Various Groups
2.4 自愿转轮运动对慢性应激大鼠前额叶皮质NGF表达的影响
双因素方差分析显示,慢性应激及自愿转轮运动显著影响前额叶皮质 NGF 个数(F(1,39)=66.128,P=0.000;F(1,39)=7.960,P=0.008)和面积(F(1,39)=100.150,P=0.000;F(1,39)=19.160,P=0.000);运动和慢性应激对前额叶皮质NGF 个数和面积均无显著交互效应(F(1,39)=0.003,P=0.956;F(1,39)=0.275,P=0.603)。
与 C 组比较,CUS 组大鼠前额叶皮质 NGF 个数(13.40±1.35)和面积[(1 274.41±114.51)μm2]均明显下降(P=0.000),下降幅度分别为35.58%和36.10%。经过4 周自愿转轮运动,与CUS 组大鼠比较,CUS 运动组大鼠前额叶皮质NGF 个数(16.00±4.54)和面积[(1 609.56±315.97)μm2]均明显增加(P=0.049,P=0.001),增加幅度为19.40%和26.29%;与C 组比较,E组大鼠前额叶皮质NGF 个数(23.30±2.21)和面积[(2 257.90±159.38)μm2]均明显增加(P=0.048,P=0.010)(见图3、图4)。

图3 各组大鼠前额叶皮质NGF及TrkA比较Figure3 Comparation of NGF and TrkA Expression in PFC Among Each Groups
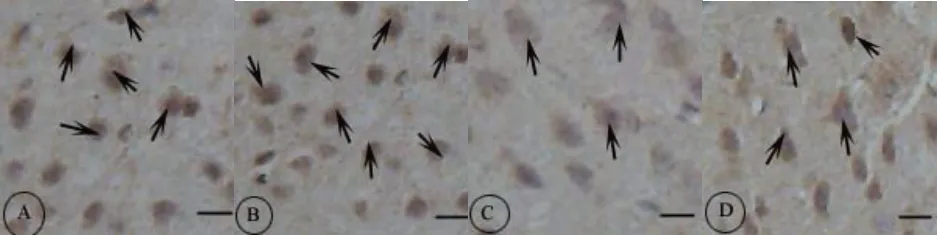
图4 前额叶皮质NGF阳性神经元分布的免疫组织化学图;Figure4 The Distribution of NGF Immunoreactive Neurons Within Prefrontal Cortex;
2.5 自愿转轮运动对慢性应激大鼠前额叶皮质TrkA表达的影响
双因素方差分析显示,慢性应激及自愿转轮运动显著影响前额叶皮质 TrkA 个数和面积(F(1,39)=72.223,P=0.000,F(1,39)=27.489,P=0.000;F(1,39)=4.514,P=0.041;F(1,39)=4.265,P=0.046),运动和慢性应激对前额叶皮质TrkA 个数和面积均无显著交互效应(F(1,39)=2.006,P=0.165;F(1,39)=0.592,P=0.447)。
与C组比较,CUS组大鼠前额叶皮质TrkA个数(3.90±0.74)和面积[(648.93±87.78)μm2]均显著下降(P=0.000),下降幅度分别为51.85%和41.76%。经过4周自愿转轮运动,与CUS组大鼠比较,CUS+E 组大鼠前额叶皮质TrkA 个数(5.40±1.35)和面积[(868.44±171.73)μm2]均显著增加(P=0.045,P=0.049),增加幅度为38.46%和33.83%;与C 组比较,运动组大鼠前额叶皮质TrkA 个数(8.40±1.17)和面积[(1 214.89±257.97)μm2]均无显著改变(P=0.048,P=0.010)(见图3、图5)。

图5 前额叶皮质TrkA阳性神经元分布的免疫组织化学图;Figure5 The Distribution of TrkA Immunoreactive neurons within prefrontal cortex;
3 讨 论
3.1 自愿转轮运动对慢性应激大鼠焦虑及抑郁样行为的影响
研究认为,生理和心理压力与许多疾病有关,如精神障碍、焦虑和抑郁。高架迷宫实验(EPM)和开场实验(OFT)被广泛用于检测动物的神经精神变化,是用来评估啮齿类动物焦虑及抑郁行为的经典模型。前期学者通过EPM及OFT实验证实,CUS可增加大鼠焦虑及抑郁样行为[14];并且对野生小鼠研究发现,注射CORT 导致的大鼠焦虑及抑郁样行为可持续5~7 天,说明慢性应激可导致行为的长期变化[15]。本研究得到相同结果,大鼠经过4 周CUS 发现,与安静对照组大鼠比较,CUS 组大鼠高架迷宫实验中开放臂时间及次数比例均显著减少,焦虑指数显著增加;开场实验中,CUS组大鼠跨格次数显著减少,中央格时间和粪便颗粒显著增多,与前期学者研究结果一致。
研究认为,对于焦虑及抑郁个体来说,体育锻炼可能是一个副作用较小、低成本、容易获得的治疗选择。R.D.GOODWIN等[16]对8 098 名成年人的研究发现,与久坐相比,规律锻炼人群被诊断为焦虑症的风险更低;W.DZIUBEK等[17]发现,肾病病人进行6 个月(每周3 次)体育锻炼可显著改善焦虑及抑郁水平,并且认为,运动可以作为重度抑郁症患者药物干预前或药物干预外心理障碍的辅助治疗措施;W.T.WATANASRIYAKUL 等[18]也证实,自愿运动可以改善社交孤立结合慢性应激雌性田鼠焦虑及抑郁样行为。本研究得到相同结果,与CUS 大鼠比较,高架迷宫实验中,CUS运动组大鼠开放臂时间和次数比例均显著增加,而焦虑指数无显著改变;开场实验中,CUS运动组大鼠跨格次数显著增多、粪便颗粒减少,而中央格时间无显著改变。以上结果说明,自愿转轮运动对CUS大鼠焦虑及抑郁样行为有一定的改善作用。据报道,HPA轴功能紊乱与CUS导致的大鼠焦虑及抑郁行为有关[19]。且本课题组前期研究发现,自愿转轮运动改善CUMS 大鼠抑郁行为可能与此运动降低慢性应激大鼠肾上腺皮质增生及血浆皮质醇含量、拮抗HPA轴功能亢进有关[20]。而 I.J.SANTOS-SOTO 等[21]发现,4 周自愿转轮运动可显著改善小鼠焦虑样行为,然而与安静对照组小鼠比较,运动组小鼠血浆皮质酮水平没有显著差异,表明自愿动物改善小鼠焦虑类行为与皮质酮水平下降无关,认为大脑中其他分子或生化变化可能与自愿转轮运动抗焦虑及抑郁作用有关。
3.2 自愿转轮运动对CUS大鼠前额叶皮质炎症因子IL-6、TNF-a和抗炎因子IL-10的影响
以往研究表明,慢性应激引起的神经炎症在慢性应激性脑损伤中起重要作用,阻断炎症因子信号通路和限制小胶质细胞活化均能改善慢性应激所致的脑功能障碍[22]。B.MISIAK 等[23]认为,血液中炎症因子浓度与抑郁症状严重程度(包括睡眠受损、认知功能障碍等)呈显著相关,并且抑郁症患者炎症标志物的增加在抗抑郁药物治疗成功后恢复到控制水平,而对抗抑郁药物治疗无效的抑郁症患者炎症标志物增加,提示炎症因子在抑郁症的发病机制中起关键作用。TNF-a是一种重要的促炎因子,并通过刺激巨噬细胞介导IL-6、IL-8和IL-1等多种细胞因子的释放,引起炎症、凋亡细胞死亡,导致神经元损伤,与抑郁及焦虑样行为有关[24]。而IL-10 被认为是一种强大的抗炎细胞因子,在限制炎症反应和防止组织损伤方面发挥着关键作用[25]。I.GOSHEN等[26]发现,慢性温和应激可增加海马促炎因子白介素IL-1β 水平,与应激导致的抑郁及焦虑样行为有关,而阻断IL-1信号通路可以防止慢性应激小鼠出现抑郁及焦虑样症状。另一项研究发现,产前应激诱导大鼠焦虑和抑郁样行为与海马炎症介质 IL-6 及 TNF-α mRNA 表达增加有关[27]。并且 C.A.BRÜNING 等[28]发现,脑室内注入TNF-α,强迫游泳实验中大鼠静止时间明显增加。本研究结果发现,与安静对照组比较,4周CUS使前额叶皮质促炎因子IL-6和TNF-α水平显著增加,抗炎因子IL-10 水平下降。认为,急性心理或生理应激可激活HPA(下丘脑-垂体-肾上腺皮质轴)活性,增加糖皮质类固醇(Gc)过度分泌,导致促炎和抗炎细胞因子平衡失调,提示肾上腺糖皮质激素在细胞因子介导的慢性应激引起的情绪障碍疾病中发挥重要作用[29]。M.KUBERA 等[30]认为,TNF-α 可通过影响垂体和下丘脑细胞,激活HPA轴,增加ACTH及糖皮质激素(GC)水平。因此,本研究CUS大鼠焦虑及抑郁样行为可能与慢性应激激活HPA 轴引起的前额叶皮质促炎和抗炎细胞因子失衡损害前额叶皮质结构和功能有关。
众所周知,体育锻炼可通过抗炎作用发挥神经保护作用[31]。M.CHENNAOUI 等[32]发现,7 周跑台运动可减少正常大鼠海马TNF-α 和IL-6 蛋白含量。但本研究发现,4 周自愿转轮运动对正常大鼠前额叶皮质促炎因子TNF-α和IL-6水平,及抗炎因子IL-10 水平均无显著影响,这种差异可能与运动时间及强度有关。S.G.WANNAMETHEE等[33]对4 252名60~79岁老年男性进行研究发现,体育锻炼与促炎因子呈显著负相关。C.LAVEBRATT等[34]对抑郁症患者进行12周中等强度有氧运动发现,运动改善抑郁症患者抑郁症状与IL-6水平下降有关。且研究已经表明,运动可抑制促炎症细胞因子IL-1β 及TNF-α 积累和增强抗炎细胞因子IL-10 水平,这可能有助于创伤性脑损伤的恢复[35]。此外,J.A.FUNK 等[36]发现,自愿转轮运动可通过下调海马TNF-α 及IL-6 水平,升高IL-1 拮抗剂水平,从而起到保护神经、促进大脑修复的作用。本研究得到相同结果,经过4周自愿转轮运动,CUS运动组大鼠前额叶皮质促炎因子TNF-α水平显著下降,抗炎因子IL-10水平增加,但对促炎因子IL-6水平无显著影响,说明此运动具有一定的抗神经炎症作用。因此可以认为,本研究4 周自愿转轮运动可通过抑制慢性应激导致的神经促炎和抗炎细胞因子平衡失调,从而改善CUS大鼠焦虑及抑郁样行为,具体机制需进一步研究。
3.3 跑台运动对慢性应激大鼠前额叶皮质NGF、TrkA表达的影响
研究认为,慢性应激可激活人体应激系统,与焦虑、抑郁等情绪障碍有关。NGF广泛分布于中枢神经系统,在神经元的发育和维持中起重要作用,并参与突触可塑性、神经元回路形成和神经元存活。抑郁症的神经营养假说认为,神经生长因子(NGF)及其受体(TrkA)在应激相关的情绪障碍发病机制中起关键作用。并且强有力的证据表明,大脑NGF在调节应激导致的焦虑及抑郁样行为中起关键作用[37],但是应激对NGF水平变化的研究存在争议。研究认为,急性及慢性应激暴露均可导致大鼠前额叶皮质NGF水平显著下降,而抗抑郁药治疗可增强前额叶皮质 NGF 蛋白表达[38]。此外 Y.DWIVEDI 等[39]发现,28 名抑郁症自杀患者海马及前额叶皮层NGFmRNA水平下降,提示NGF 可能在抑郁症自杀患者的病理生理学中发挥重要作用。然而有研究得到不同结果,P.J.FOREMAN 等[40]发现,大鼠经历一次或多次冷刺激后,海马NGF mRNA 水平升高,但在社会隔离和足部电击刺激后海马NGF mRNA 水平保持不变[41]。因此可以认为,应激导致大脑NGF表达不同可能与应激源及应激强度不同有关。前期学者研究表明,PFC在功能上与几个大脑结构相连,参与调节情绪及认知过程,并对应激高度敏感。因此本研究聚焦PFC,通过4周慢性不可预知应激,发现与正常大鼠比较,CUS 模型组大鼠前额叶皮质NGF 及TrkA 表达显著减少。因此可以认为,本实验中CUS大鼠焦虑及抑郁样行为可能与CUS抑制PFC区NGF和TrkA表达有关。
多数学者认为,运动锻炼可以改变某些神经递质及神经蛋白的表达,NGF与其受体TrkA结合,在突触可塑性及神经发生中发挥重要作用,被认为是运动干预最重要的调节因子之一[42]。前期研究表明,不同方式的运动(跑台及自愿转轮运动)均可以增加啮齿动物大脑NGF及TrkA的表达[43]。T.W.LIN等[44]发现,8周跑台运动显著增强了啮齿动物海马NGF 及其受体原肌凝蛋白受体激酶A(TrkA)的表达,NGF与TrkA结合可刺激下游转录因子CREB,诱导与细胞存活和神经可塑性相关的各种基因转录,最终增强神经可塑性。然而本研究发现,4周跑台运动显著增加了正常大鼠前额叶皮质NGF 表达,但对TrkA 表达无显著影响。王玮等[45]发现,脑卒中后抑郁大鼠前额叶皮质NGFmRNA 表达显著降低,而TrkA mRNA 蛋白表达无显著变化,认为NGF在前额叶皮质的表达存在自分泌和旁分泌2种方式,NGFmRNA 以旁分泌的形式转移至其他部位。因此,本研究自愿转轮运动对正常大鼠NGF及其受体TrkA水平表达不一致,可能与NGF及TrkA存在不同分泌方式有关,具体机制需进一步研究。
自愿转轮运动已经被证明可以改善慢性应激引起的情绪障碍及认知功能下降,而运动导致NGF的增加可以通过作用于trkA受体,促进神经元的存活和突触的形成,有助于改善应激导致的抑郁及焦虑样行为[46]。Y.P.HONG等[47]发现,规律的跑台运动可增加社交孤独大鼠海马NGF及BDNF的表达,可提高神经元的可塑性和存活,从而改善社交孤独大鼠抑郁样行为。本研究得到相同结果,与CUS 组大鼠比较,CUS 运动组大鼠PFC 区NGF及TrkA表达显著增多。NGF可以保护中枢神经元免受损伤,通过开场实验及糖水偏爱实验证实,小柴胡汤可通过增强海马NGF 及其受体TrkA 表达,改善慢性不可预知应激大鼠抑郁样行为[48]。此外,Y.ZHU等[49]发现,中药开心散可通过增强应激大鼠海马NGF 及其受体TrkA 表达,改善应激大鼠抑郁样行为,提示NGF-TrkA 信号通路对抗抑郁药物的治疗作用至关重要。因此,本实验中,自愿转轮改善CUS 大鼠焦虑样行为可能与此运动激活前额叶皮质NGF/TrkA 信号通路有关,NGF 与TrkA结合可诱导大量突触可塑性相关基因的表达,这些基因可能在结构和功能上启动突触,可调节突触稳定性,改善慢性应激大鼠焦虑及抑郁样行为。近年来研究表明,NGF 与TrkA 的结合可激活抗炎信号通路,导致炎症细胞因子的水平下调,并诱导抗炎介质IL-10 和IL-1ra 等水平升高,而阻断TrkA 可导致单核细胞IL-6 和IL-1b 的分泌增加,IL-10 分泌减少,认为TrkA表达水平的改变可能是NGF 介导生理抗炎的重要机制[50]。以上研究表明,NGF-TrkA 信号通路的抗炎作用可能在慢性应激导致的情绪障碍的病理发展中发挥重要作用。因此可以推测,本实验中自愿转轮运动改善CUS 大鼠焦虑及抑郁样行为可能与此运动增强前额叶皮质抗炎能力、激活NGF-TrkA信号通路,从而纠正CUS 诱导的前额叶皮质功能紊乱起到脑保护作用有关。但是,自愿转轮运动导致CUS大鼠前额叶皮质抗炎能力增强是否与NGF/TrkA通路的激活有关,需要进一步研究证实。
4 结 论
4 周自愿转轮运动可有效改善CUS 大鼠焦虑及抑郁样行为,前额叶皮质炎症反应减弱,NGF 及TrkA 表达增加。提示,前额叶皮质可能是自愿转轮运动改善CUS 大鼠焦虑及抑郁样行为的作用脑区之一,且这一作用可能是由前额叶皮质抗炎能力增强、NGF-TrkA信号通路上调共同介导的。

