3'-大豆苷元磺酸钠对大鼠脑缺血再灌注损伤后MMP-3、MMP-9、ZO-1及OCLN表达的影响
谢 婷,虞子宁,张慧娟,黄志华,曾 靖,江丽霞
(赣南医学院 1.2019级硕士研究生;2.第一附属医院;3.基础医学院;4.科研处,江西 赣州 341000)
脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,I/R)是指脑缺血一定时间恢复血液供应后,其脑机能功能不但未能恢复,却出现了更加严重的脑机能障碍,称之为脑缺血再灌注损伤,具有极高的致死率和致残率。脑缺血再灌注虽然可以恢复血液流动和氧气供应以及许多其他能量物质,但这一过程也可以通过不同的机制,如自由基的释放、炎症级联反应的激活、细胞凋亡增加、钙超载和兴奋性氨基酸释放,加重缺血引起的原有脑损伤,有进一步促进细胞坏死和神经损伤的风险[1]。研究表明,脑缺血再灌注损伤可导致血脑屏障(blood-brain barrier,BBB)破坏,从而导致高灌注后的水肿和出血性转化[2],是脑缺血再灌注损伤的重要原因。
紧密连接蛋白(tight junctions protein,TJPs)是构成细胞间屏障的重要组成部分,其中ZO-1及Occludin(OCLN)在维持血脑屏障中发挥着重要作用,可以减轻脑缺血再灌注损伤诱导的血脑屏障破坏。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一种蛋白水解酶,可以破坏细胞外基质,其中MMP-3和MMP-9可以促进脑缺血再灌注损伤诱导的血脑屏障破坏。因此,ZO-1、OCLN、MMP-3及MMP-9等指标在脑缺血再灌注损伤中具有重要意义。3'-大豆苷元磺酸钠(3'-daidzein sulfonate sodium,DSS)是中药葛根中主要有效成分大豆苷元进行结构修饰和改性后新合成的强水溶性物质。研究表明DSS对脑缺血再灌注损伤有较好的神经保护作用[3]。但DSS对脑缺血再灌注损伤的保护作用与基质金属蛋白酶和紧密连接蛋白的影响报道较少。为探讨DSS抗脑缺血再灌注损伤的药理机制,本文将从其对MMP-3、MMP-9及ZO-1、OCLN mRNA表达的影响,进一步了解它在脑缺血再灌注损伤中的作用及其作用机制。
1 材料与方法
1.1材料
1.1.1药物DSS(C15H9O7SNa)由沈阳药科大学天然药物化学研究室提供,纯度99%以上,实验前用双蒸馏水稀释至所需浓度。
1.1.2主要仪器与试剂Lightcycler 480 Ⅱ Real-Time PCR System(Roche);All-in-OneTMqPCR Mix:Gene Copoeia(Cat.No.AOPR-0200);All-in-OneTMqPCR Primer(Gene Copoeia)。
1.1.3实验动物SD雄性大鼠,SPF 级,体重250~280 g,购自湖南斯莱克景达实验动物有限公司。动物许可证号SCXK(湘)2011-003,合格证号:NO.4304701590。适应性饲养5天后开始进行实验。本研究经赣南医学院生物医学研究伦理委员会批准同意。
1.2实验方法
1.2.1实验分组与大鼠脑缺血/再灌注损伤模型的制备将SD大鼠随机分成3组:假手术组(Sham组)、脑缺血再灌注损伤模型组(I/R组)、DSS治疗组(I/R+DSS组),每组6只。10%水合氯醛麻醉大鼠,参照LONGA等[4]方法建立大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)脑缺血再灌注模型,缺血120 min后再灌注24 h。术中严格控制室温在23 ℃~25 ℃。药物治疗组于缺血后10 min分别从舌下静脉注射 2.0 mg·kg-1的DSS,假手术组和模型组给予同体积的生理盐水。
1.2.2RT-PCR检测MMP-3、MMP-9、ZO-1及OCLNmRNA的表达再灌注24 h后,10%水合氯醛麻醉大鼠,处死大鼠,取缺血半暗带区10~20 mg脑组织制成10%的组织匀浆,RT-PCR检测MMP-3、MMP-9、ZO-1及OCLN mRNA的表达,引物见表1。

表1 β-actin、MMP-3、MMP-9、ZO-1及OCLN的特异性引物设计
1.3统计学方法运用Prism 4.0 统计软件,对各组之间进行单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1DSS对脑缺血再灌注后脑组织中MMP-3mRNA表达的影响与假手术组相比,模型组MMP-3 mRNA表达水平明显升高;与模型组相比,DSS治疗组MMP-3 mRNA的表达水平明显降低,提示脑缺血再灌注后脑组织中MMP-3的表达水平显著升高,而DSS治疗可降低脑缺血再灌注后脑组织中MMP-3的表达水平(见图1)。
2.2DSS对脑缺血再灌注后脑组织中MMP-9mRNA表达的影响与假手术组相比,模型组MMP-9 mRNA表达水平显著升高;与模型组相比,DSS治疗组MMP-9 mRNA的表达水平显著降低,提示脑缺血再灌注后脑组织中MMP-9的表达水平显著升高,而DSS治疗可降低脑缺血再灌注后脑组织中MMP-9的表达水平(见图2)。
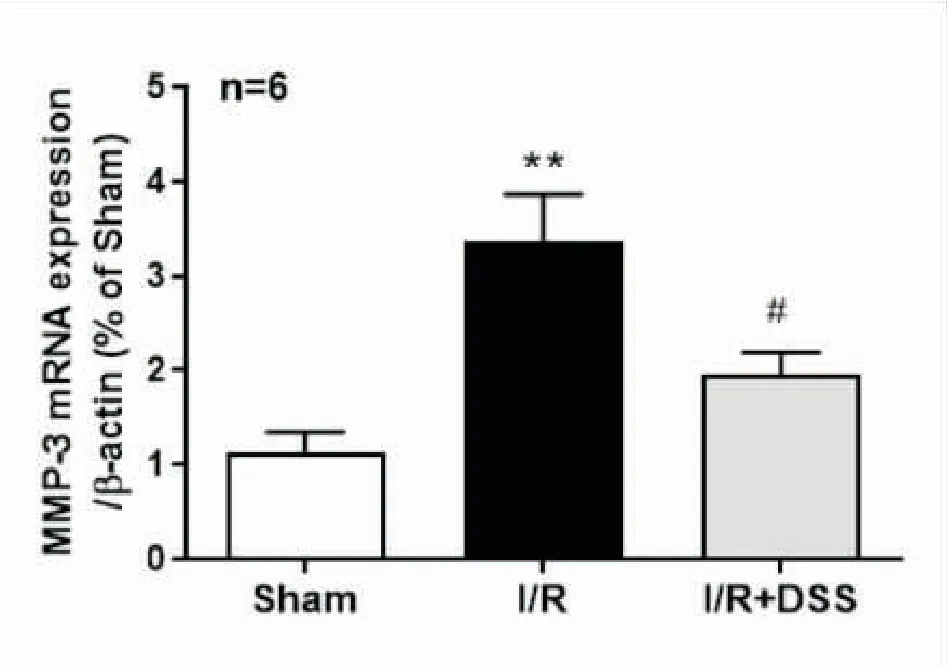
图1 DSS对脑缺血再灌注损伤后MMP-3 mRNA表达的影响
注:与Sham组相比,**P<0.01;与I/R组相比,
#P<0.05;F值为10.74。
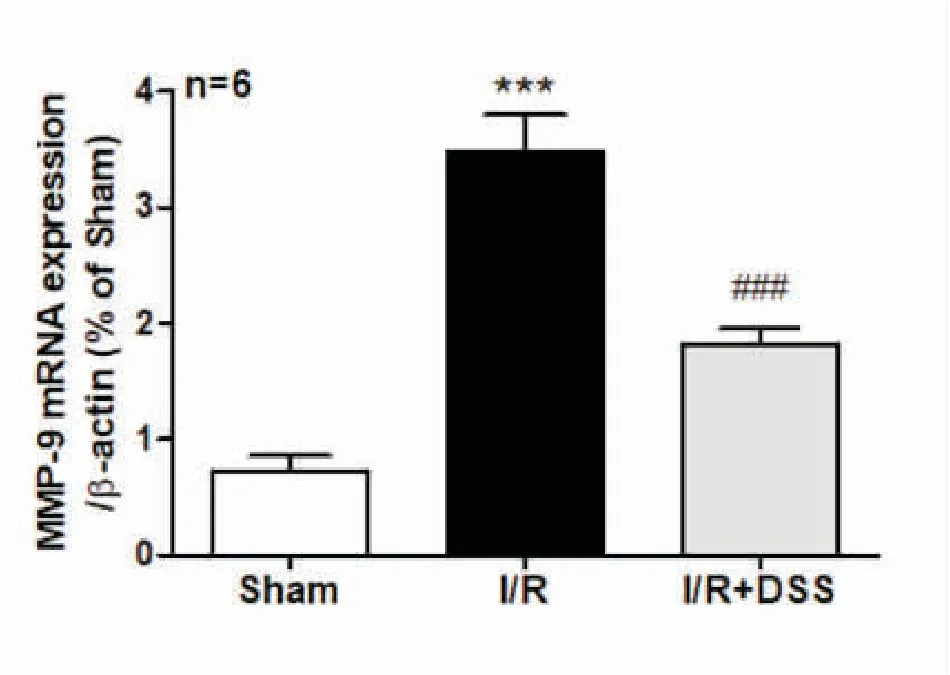
图2 DSS对脑缺血再灌注损伤后MMP-9 mRNA表达的影响
注:与Sham组相比,***P<0.001;与I/R组相比,
###P<0.001;F值为44.85。
2.3DSS对脑缺血再灌注后脑组织中ZO-1mRNA表达的影响与假手术组相比,模型组ZO-1 mRNA表达水平明显降低;与模型组相比,DSS治疗组ZO-1 mRNA的表达水平明显升高,提示脑缺血再灌注后脑组织中ZO-1的表达水平明显降低,而DSS治疗后可提高脑缺血再灌注后脑组织中ZO-1的表达水平(见图3)。
2.4DSS对脑缺血再灌注损伤后脑组织中OCLNmRNA表达的影响与假手术组相比,模型组OCLN mRNA 表达水平明显降低;与模型组相比,DSS治疗组OCLN mRNA的表达水平明显升高,提示脑缺血再灌注后脑组织中OCLN的表达水平明显降低,而DSS治疗后可提高脑缺血再灌注后脑组织中OCLN的表达水平(见图4)。
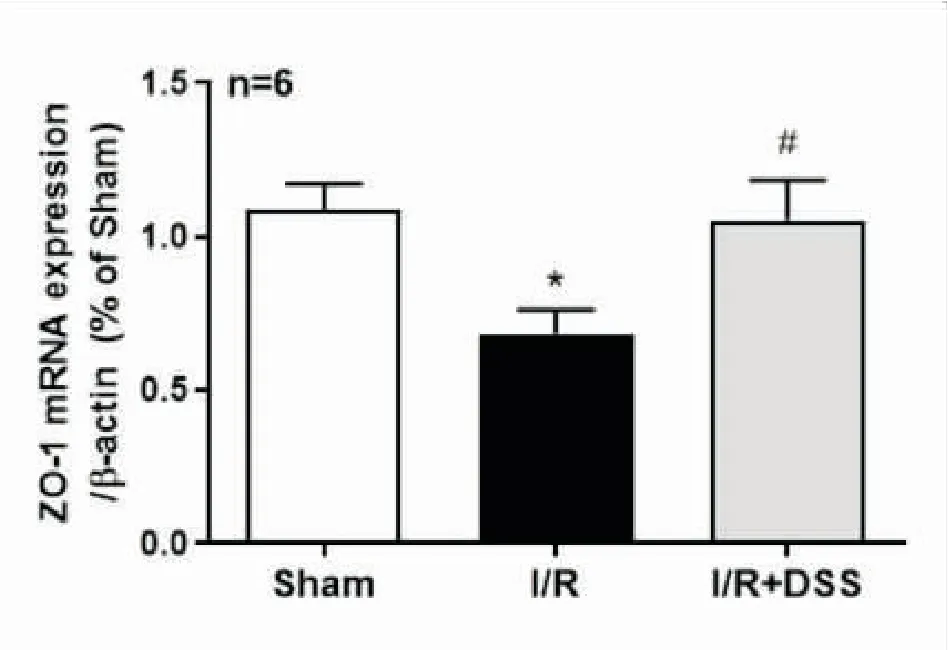
图3 DSS对脑缺血再灌注损伤后ZO-1 mRNA表达的影响
注:与Sham组相比,*P<0.05;与I/R组相比,#P<0.05;F值为4.865。
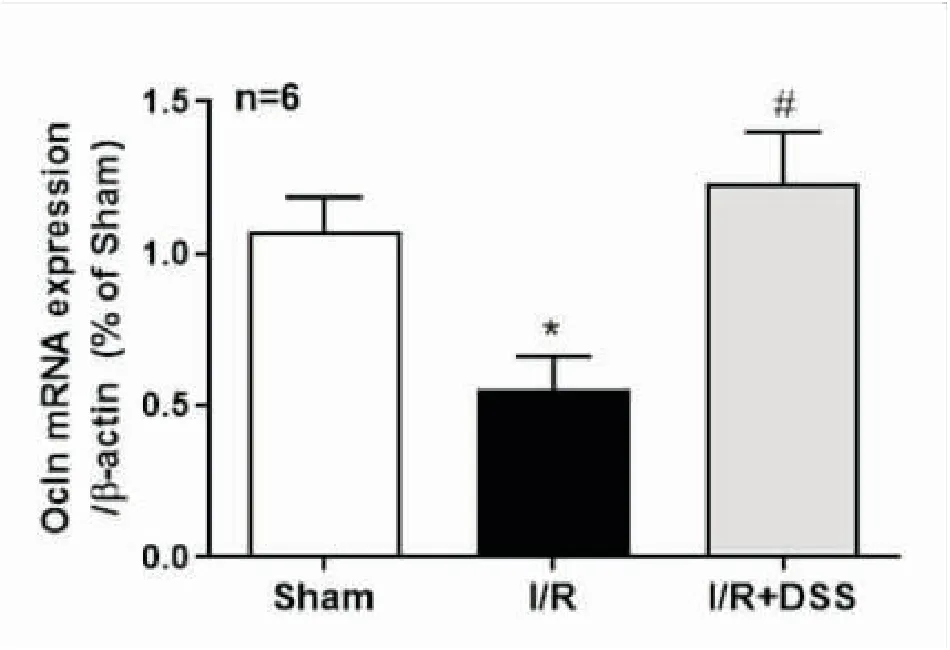
图4 DSS对脑缺血再灌注损伤后OCLN mRNA表达的影响
注:与Sham组相比,*P<0.05;与I/R组相比,#P<0.05;F值为7.744。
3 讨 论
脑缺血再灌注损伤是一个复杂的过程,涉及不同的病理生理级联反应,包括氧化应激、兴奋性氨基酸毒性、线粒体肿胀、钙超载、炎症反应以及细胞凋亡等[5],常伴随着血脑屏障的损坏,导致脑内环境稳态失衡。血脑屏障主要由内皮细胞、周细胞、神经元和星形胶质细胞末端等神经血管单位组成,是一种动态的、高度选择性的屏障,调节各种分子从血液进入脑实质,限制某些血浆成分、血细胞和白细胞进入大脑,当这些限制性物质由于神经退变过程或神经炎症而渗入脑实质时,就会产生神经毒性物质,导致神经元功能障碍和丧失,因此血脑屏障在维持严格的神经元稳态方面起着至关重要的作用[6-8]。
脑微血管内皮细胞之间的紧密连接(tight junctions,TJ)限制了亲水性分子和大分子跨血脑屏障的细胞旁流量,包括葡萄糖和氨基酸在内的营养物质通过特定的膜转运蛋白进入大脑[9]。紧密连接不仅仅是一种简单的细胞-细胞屏障,它还表现出离子和大小的选择性,因此可作为一种可调节的渗透性屏障,阻止水、溶质和免疫细胞自由通过细胞旁途径。ZO-1和OCLN是紧密连接蛋白的两个重要成分,可以维持肠道黏膜上皮屏障的完整性[10]和增加肾小管上皮细胞紧密连接的粘附强度[11],研究还发现它们在脑组织中也存在表达,并在维持和改善血脑屏障中发挥重要作用[12-13]。
基质金属蛋白酶是以酶原形式分泌的蛋白水解酶,能够破坏细胞外基质,介导缺血性脑损伤[14]。MMP-3和MMP-9是促进脑缺血再灌注损伤的两种基质金属蛋白酶,在生理和病理生理条件下参与细胞外基质的重塑,在脑缺血再灌注损伤中起着重要作用,再灌注期间,化学信号触发白细胞与内皮细胞结合,随后产生的中性粒细胞衍生的氧化剂和基质金属蛋白酶导致血脑屏障损害[15]。有研究表明,MMP-9在脑缺血后处于活化状态,并伴有明显的血脑屏障通透性改变,而使用MMP-9天然抑制剂TIMP-Ⅰ后可减轻局灶性脑缺血后血脑屏障的破坏[16]。凋亡神经元释放的MMP-3可以作用于紧密连接蛋白,降解基膜中的细胞外基质复合物,并激活小胶质细胞促进炎症反应,加速血脑屏障的破坏,而MMP-3基因的缺失会减轻血脑屏障的损害及神经元的退化[17]。
研究发现,DSS可通过改善线粒体功能[18]、减轻海马损伤和记忆障碍[19]、抑制炎症反应[20]及神经元凋亡[21]从而减轻脑缺血再灌注损伤。本文实验结果显示,脑缺血再灌注后,大鼠脑组织中MMP-3和MMP-9 mRNA的表达水平明显升高,ZO-1和OCLN mRNA的表达水平明显降低,而使用DSS治疗后,MMP-3和MMP-9 mRNA的表达水平明显降低,ZO-1和OCLN mRNA的表达水平明显增强,提示DSS可通过抑制MMP-3和MMP-9 mRNA的表达,促进ZO-1和OCLN mRNA的表达,从而降低基质金属蛋白酶对大脑细胞外基质的降解,维持神经元细胞间的紧密连接,对血脑屏障的完整性起保护作用,减轻脑缺血再灌注后的脑损伤,为DSS应用于脑缺血再灌注后的治疗提供了实验依据。

