医用CT检测模体的演进和问题分析
复旦大学 放射医学研究所,上海 200032
引言
计算机体层摄影(Computer Tomography,CT)检查的频次逐年增加,CT检查也成为最常用的放射诊断手段之一。Smith等[1]的调查指出CT检查的数量以每年14%的速度增长。王彬等[2]的研究也显示2009年上海接受CT检查的人数是1996年的4.2倍。ICRP87号报告和UNSCEAR 2008报告指出CT扫描涉及辐射暴露,在大多数情况下辐射剂量水平高于其他X射线检查[3]。故与此同时,与CT扫描相关的剂量和风险一直是医学物理学家和其他专业人士关注的问题。
在尽可能降低受检者剂量的同时保证更优质的图像质量是CT的发展方向,随之而来的是超宽探测器、自动管电流调制技术、插值迭代重建算法等新的CT软硬件技术层出不穷。而每一种新的诊断技术的出现,都意味着需要对影像质量和辐射剂量进行新的研究[4]。由于CT的影像质量和辐射剂量测试主要依赖检测物理模体,故CT的质量测量方法和检测模体也同样随着CT技术的革新而不断发展,本文全面梳理CT检测模体发展历程,并提出当前CT检测模体所面临的挑战与发展方向。
1 常规CT剂量模体
20世纪70年代,随着CT的问世,研究者们针对CT的辐射剂量表征与测量提出了多种方法,但这些方法基本都与Shope提出的CT剂量指数(CT Dose Index,CTDI)的概念相吻合[5-7]。CTDI的出现满足了量化X射线扇形束在体模内剂量分布的需求[8]。

其中,T代表标称断层厚度,N代表一次扫描断层层厚数,D(Z)代表垂直于断层的Z向剖面的剂量分布。美国医学物理师协会(American Association of Physicists in Medicine,AAPM)的第96号[9]和第111号报告[10]中对CTDI定义和CT剂量学的演进进行了较为详细的介绍。
CTDI的测量主要由CT剂量模体[11]和辐射测量系统组合。辐射测量方法主要分为两种:通过阵列探测器测量CT剂量曲线和使用电离室对平均信号积分[12-13]。传统的剂量曲线的测量方法是使用热释光剂量计[14],但现在的一些研究中也采用光释光剂量计[15]、辐射感光胶片[16]或者金属-氧化物半导体场效应晶体管剂量计[17]进行测量。目前CT剂量日常检测中最广泛使用的剂量计是100 mm长的笔型电离室,用来测量平均剂量或者积分剂量,这种剂量计的使用最早是由Suzuki等[18]提出的。
国际电工委员会(International Electrotechnical Commission,IEC)建议CTDI测量模体采用聚甲基丙烯酸甲酯(Polymethyl Methacrylate,PMMA)作为材料[19]。传统的剂量模体设计是由直径为16 cm和32 cm的PMMA圆柱构成(图1),分别代表成人的头部或躯干/腹部(直径16 cm的圆柱体也可代表儿童的躯干部)。这些模体一般配有适合于插入笔型电离室以及其他位置敏感剂量计或其他阵列式探测器的孔道。为了获得更详尽的剂量信息,从传统模体演变而来的新型模体也不断应运而生。图2和图3分别是由PMMA材料组成的儿童/成人嵌套CTDI剂量测试模体和锥形束CT头部剂量模体。图3中的Sedentex CTDI头部剂量模体由一组直径为16 cm的PMMA板堆叠,不同的板块之间可以互换,便于放置不同种类的剂量计,该模体为笔形电离室布设的孔道直径和位置与传统模体也不相同。

图1 分立式CTDI儿童、成人头部、成人体部剂量模体

图2 嵌套式CTDI儿童、成人头部、成人体部剂量模体

图3 SedentexCT DI 头部剂量模体
2 加长CT剂量模体
早期CT的扫描速度慢,阳极热容也比较低,射束的宽度比较窄,使用100 mm长的电离室测量单层轴扫的剂量曲线积分不仅足以包括照射时的散射线,还可以有效节省时间。但是随着多层CT的发展,越来越宽的Z轴射束准直和更长的扫描长度限制了CTDI100的准确性、临床实用性[20]。
CTDI100在CTDI剂量模体不同点位测量效率较低,大约为60%到90%,可能大大低估CT扫描的实际累积剂量,在中心点位置会造成30%的误差[21-22]。传统的100 mm长杆电离室已经不能满足CT质控中的剂量测量要求。许多学者开始使用更长的剂量模体来测试多层CT的剂量曲线。Mori等[23]将多个PMMA圆柱拼接在一起组成了总长为900 mm的超长圆柱模体,用以测量256层CT扫描的剂量曲线。Nakonechny等[22]尝试使用300 mm长的CIRS Model 002H5等效水体部模体估计真实患者所受纵向单层扫描剂量曲线。AAPM第111号报告中也提出可以使用直径30 cm,长度50 cm的快速注水模体来表示平均体型的成年人体部对射线的吸收和衰减[24]。
3 常规影像质量模体
自20世纪70年代EMI公司推出商用CT装置以来,这种新型成像设备的影像质量便开始受到关注。但是此前并没有规定CT成像的图像质量评估技术,因此人们提出使用几何参数来量化CT图像的主要特征[25],如低对比度和高对比度背景下的空间分辨率[26-27]、图像噪声、层厚,以及某些伪影(运动、射束硬化、均匀性)[28-30]。基于McCullough等[31-32]的研究,AAPM第1号报告发表了第一部关于CT影像质量控制和剂量学的指南[33]。
AAPM的CT测试模体(图4)曾被广泛应用于CT扫描装置的影像质量控制和验收测试,该模体包含了许多用于CT成像的图像质量性能评估模块。但是AAPM模体需要往腔内注水,使用较为不方便。因此,White等[34]在Goodenough等[35]开发出的环氧树脂组织等效材料模体的基础上不断改进,采用固体浇铸技术和模块化设计,解决了水浴模体容易吸水、漏水以及水源差异的问题。Catphan 500是目前市场上比较典型的模块化模体(图5),该模体可以提供有关图像质量参数的特定信息,如空间和对比度分辨率、光束硬化、均匀性和噪声等[36]。已有研究者就定位光精度、进床精度、机架倾斜角准确性等方面对Catphan 500 CT性能测试模体做了进一步改造和应用研究,并在AAPM模体和Catphan模体的基础上设计了一套新型CT成像性能检测模体[37-38]。

图4 CIRS Model 610模体的设计符合AAPM对CT性能的建议

图5 Catphan图像质量模体
CT系统的影像质量评估标准定义与影像测试模体的发展密切相关。2000年,欧盟拓展了CT成像模式质量标准指南的概念,建立了与患者剂量有关的质量标准和设备性能的指导方针[39-40]。美国放射学会(American College of Radiology,ACR)也推出了相关的CT认证项目。ACR CT模体(图6)由4个等效水材料模块组成。模体的直径为20 cm,每个模块的深度为4 cm。而我国也在2019年更新了《X射线计算机体层摄影装置质量控制检测规范》,该标准适用于诊断用CT的质量控制检测,包括验收检测、使用中CT的状态检测及稳定性检测。
4 自动管电流调制模体
随着多层螺旋CT技术的发展,有可能增加同一部位CT检查所致患者的受照剂量。为了解决这一问题,研究者们提出了包括增加螺距和降低管电流等各种减少辐射剂量的策略[41]。如今,几乎所有的CT系统都具备三维管电流调制技术,这一技术可以根据患者的体型和组织衰减来实时调节扫描过程中的管电流从而降低患者受照剂量。由于不同CT制造商的自动管电流调制系统的工作原理不同,这就需要借助模拟患者大小和形状的物理模体来评估管电流调制模式下的图像质量以及辐射剂量,进而对CT装置自动管电流调制的性能进行评价。
目前最常见的自动管电流调制模体主要是多个椭圆柱或圆柱材料的组合或堆叠,例如Kawashima等[42]使用了一组直径不同的圆柱来测试不同机型CT在自动管电流调制(Automatic Tube Current Modulation,ATCM)下的图像质量和剂量水平,而Sookpeng等[43]使用“婚礼蛋糕”模体与ImPACT圆锥模体进行ATCM下CT图像质量比较。Deborah等[44]开发的新型ATCM模体由三个长短轴半径比为3:2的不同大小椭圆体构成,相较于开发的CT模体,该模体缺少可以用于测量剂量的孔道结构,但由于其椭圆柱之间没有空气间隙,减小了因模体模块之间不连续造成的响应。Justin等[45]的研究更进一步,在由五个不同直径圆柱部分组成的模体中加入了器官纹理特征。
但是,这些模体大多只能进行个别图像质量参数的测量,或不能与真实人体对射线吸收和衰减建立联系,所以目前仍未有统一用于评价自动管电流调制的的标准测试方法和物理模体。
2006年,Hurwitz等[49]使用性别特异性模体对女性乳房剂量进行了研究。许多研究人员也尝试使用仿真人模体对国际辐射防护委员会出版物103中性别相关的组织加权因子进行研究[50]。
近年来,仿真人模体也常常被用于研究CT辐射输出特性的研究中。Schindera等[51]使用CIRS仿真人模体(model 702)研究ATCM下不同体型患者受照剂量。Spampinato等[52]使用PBU-X-21胸部模体探究ATCM输出剂量与图像质量的关系。我国仿真人模体的研究起步较晚,上世纪80年代初才开始仿真辐照体模及组织辐射等效材料的研究。四川大学林大全使用成都地区296名成人体型测量数据以及华西医科大学人体解剖的脏器数据,研制出中国成人男性仿真胸部体模[53],体模身高165.9 cm,体重57.5 kg。彭刚等[54-55]使用该模体对ATCM模式下不同噪声指数的胸部器官吸收剂量进行评估。
但是,由于仿真人模体结构复杂,价格昂贵,剂量测量过程繁琐,并且缺乏图像质量客观评价模块等的原因,仿真人模体并没有在临床得以广泛应用,目前主要应用于器官剂量的验证测量。
5 仿真人模体在CT检测中的应用
为了更真实地模拟人体组织的辐射吸收特性和解剖学特征,仿真人模体被引入了医学辐射防护。Alderson等[46]引入了与仿真人模体相关的等效组织材料的概念。这些剂量学模体将真实的人体骨骼嵌入了模拟软组织的材料中,有的还包含了模仿肺部形状的低密度材料[47]。其中Alderson模体还可以插入热释光剂量计或辐射感光胶片[48]。近年来,使用不同种类剂量计对仿真人模体进行剂量测量已被广泛应用于CT剂量估计。RANDO模体(图7)由一种用于模拟人体软组织的专用聚氨酯材料构成,该模体的组织等效材料模拟了人体肌肉组织、肺部组织和骨骼的有效原子序数和质量密度。

图6 Gammex公司生产的ACR/CT模体
6 讨论与展望
自第一代CT机发明以来,CT检测模体的发展便与CT机的探测器等核心部件以及成像能力的发展密不可分。最初为单层轴向扫描CT设计的CTDI头部和体部模体为医用CT的日常验收和检测带来了便利,而超宽射束CT的临床应用,使得传统模体和剂量测量方法受到了限制,研究人员通过增加模体的长度来克服这一缺陷。但是单一地增长模体并不能满足CT技术的飞速发展,自动管电流调制技术已经广泛使用于现代CT扫描,均一的模体形状不能实现调制,更多的研究开始着眼于如何使用简单的圆柱或者椭圆形状组合实现管电流调制下CT性能的检测。尽管许多研究已经可以实现部分CT性能参数的测量,但是至今仍未有统一的测量方法和物理模体可用于自动管电流调制技术的检测与评价。另一方面,仿真人模体通过模拟真实人体组织器官的有效原子序数和质量密度,较之其他物理模体可以更好地与人体吸收剂量建立联系,但却普遍存在个体笨重,测量过程操作复杂,缺乏必要的客观图像质量检测评价模块等缺陷,未能得以广泛应用。我国的医用CT检测模体研制起步较晚,目前主要处于研究阶段,一些研究者对模体的材料和结构的设计进行了尝试,但是这些研究成果并没有广泛应用于临床检测。因此,紧跟CT技术的发展,有必要开发可以用于检测与评价CT新技术的辐射剂量与图像质量模体,为CT装置持续降低受检者剂量与提高图像质量提供技术支持。
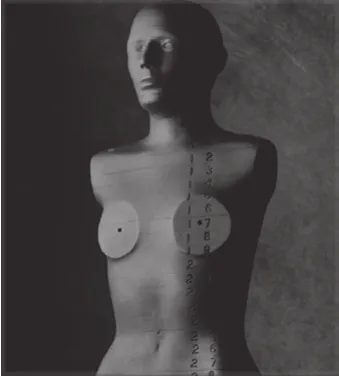
图7 RANDO仿真人模体

