呼出气一氧化氮在中央型气道疾病气管镜治疗前后的变化
陈伟伟 王洪武 周云芝 张楠
1沧州市人民医院呼吸内科061000;2应急总医院呼吸与危重症医学科,北京100028
中央型气道疾病是气管镜介入治疗中的一类常见病、多发病,临床上引起中央型气道疾病的因素主要有恶性肿瘤气道侵犯、支气管内膜结核所致气道狭窄、重症抢救气管插管及切开继发的气道狭窄等。气管镜介入治疗技术是现代介入肺脏医学的重要组成部分,近年来发展迅速,在中央型气道疾病中的应用具有极其重要的临床价值。中央型气道疾病患者由于气流受限、气管镜下介入治疗等情况多合并不同程度气道炎性病变,鉴定气道炎症及其严重程度,对临床早期诊断、疾病控制水平、指导药物调整及判断预后等均有重要价值。依靠临床症状、体格检查、肺功能等,往往很难揭示气道炎症的本质及程度,不能早期预测炎症程度并及时指导治疗,而这些结果也常常相互不一致,仅仅一部分和气道炎症相关,也受到其他病理生理机制的影响[1]。因此,寻找一种简便、有效、可重复性好的方法检测气道炎症显得尤为重要。呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)测定是现阶段最有研究前景和应用前景的一种气道炎症标志物。FeNO 测定具有简便易行、无创安全、患者易于配合等优势,在反映气道炎症方面已得到ATS和ERS联合肯定[2],其测量值大小和炎症严重程度相关[3]。现有多项研究将FeNO 应用于呼吸系统疾病,以支气管哮喘、COPD 为主,在肺结核、肺癌中也有一些研究,但在良、恶性疾病所致中央型气道病变中的应用研究较少,在气管镜介入治疗的研究较少。本研究将其应用于良、恶性中央型气道疾病及该类疾病气管镜介入治疗前后的研究,以探讨其数值变化及临床意义。
1 对象与方法
1.1 研究对象 选取2019年7月至2019年8月于应急总医院明确诊断的中央型气道疾病且需行气管镜下介入治疗患者48例作为研究对象,其中良性中央型气道病变患者18例,恶性中央型气道病变患者30 例。本研究符合 《赫尔辛基宣言》的原则。
1.2 纳入与排除标准
1.2.1 纳入标准 (1)结合临床、肺部影像学等明确诊断中央型气道疾病;(2)年龄≥18岁;(3)依从性好,能够配合完成FeNO 检测。
1.2.2 排除标准 (1)既往有慢性支气管炎、COPD、支气管哮喘、支气管扩张等慢性呼吸系统疾病;(2)合并肺部感染;(3)近1个月曾服用过激素类药物;(4)近1个月曾患过过敏性疾病,服用过抗过敏药物;(5)测量前1 h有过吸烟;(6)测量前1 h有过剧烈运动;(7)测量前1 h有过饮食;(8)测量当天有饮过酒、浓茶、咖啡等刺激性饮料。
1.3 研究方法 FeNO 检测采用Sunvou-CA2122呼出气一氧化氮分析仪,由专职医师负责测定。按照ERS推荐的操作标准,受检者在检测前1 h禁食水并保持静息状态,检测时患者取坐位,一手夹鼻,一手握住分析仪,用力呼气排空肺内气体,然后用嘴含住过滤器,缓慢吸气直至达到肺总量,通过电脑进行观察,在50 ml/s的匀速呼气下记录10 s的呼气情况,读取检测数据。
气管镜介入治疗明确诊断中央型气道疾病患者,气道狭窄、阻塞,需行呼吸内镜下介入治疗,改善气道狭窄、阻塞情况。呼吸内镜下介入治疗包括在硬质镜和/或软镜操作下行二氧化碳冷冻等冷治疗和/或激光、氩气刀、低温等离子等热治疗。
1.4 统计学分析 所有数据使用SPSS 25.0统计学软件包进行统计分析。数据符合正态分布,计量资料以±s表示,2组之间的比较采用两独立样本均数比较的t检验,多组之间比较采用完全随机设计资料方差分析,治疗前后的比较采用配对设计定量资料t检验。P<0.05为差异有统计学意义。
2 结果
2.1 良、恶性中央型气道病变患者Fe NO 水平的比较 良性中央型气道病变与恶性中央型气道病变患者FeNO 水平差异无统计学意义(t=0.344,P>0.05)。见表1。
表1 良、恶性中央型气道病变患者FeNO 水平的比较 (±s)
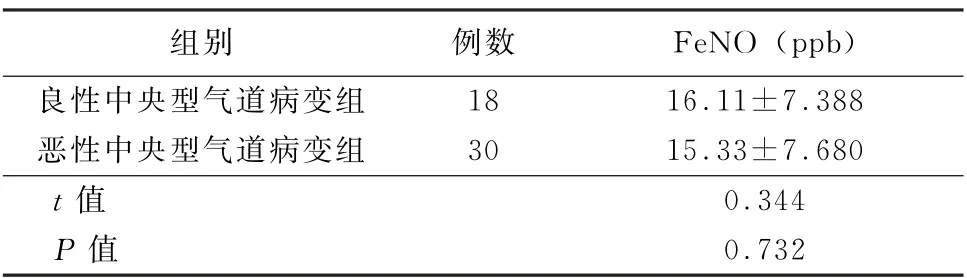
表1 良、恶性中央型气道病变患者FeNO 水平的比较 (±s)
注:FeNO 为呼出气一氧化氮
组别 例数 FeNO (ppb)良性中央型气道病变组 18 16.11±7.388恶性中央型气道病变组 30 15.33±7.680 t值 0.344 P 值 0.732
2.2 中央型气道病变受累位置不同患者FeNO 水平的比较 中央型气道病变位置不同,所测量FeNO 水平差异无统计学意义 (F=1.580,P>0.05)。见表2。
表2 中央型气道病变位置不同患者FeNO 水平的比较 (±s)
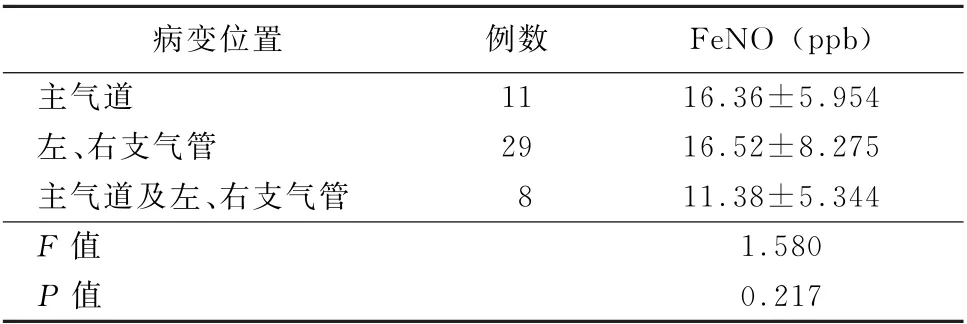
表2 中央型气道病变位置不同患者FeNO 水平的比较 (±s)
注:FeNO 为呼出气一氧化氮
病变位置 例数 FeNO (ppb)主气道 11 16.36±5.954左、右支气管 29 16.52±8.275主气道及左、右支气管 8 11.38±5.344 F 值 1.580 P 值 0.217
2.3 气管镜介入治疗前后患者Fe NO 水平的比较 气管镜介入治疗后良、恶性病变患者Fe NO较治疗前均有明显下降 (t值分别为2.701、2.895,P值均<0.05)。见表3。
表3 中央型气道病变患者气管镜下治疗前后FeNO 水平的比较 (±s)
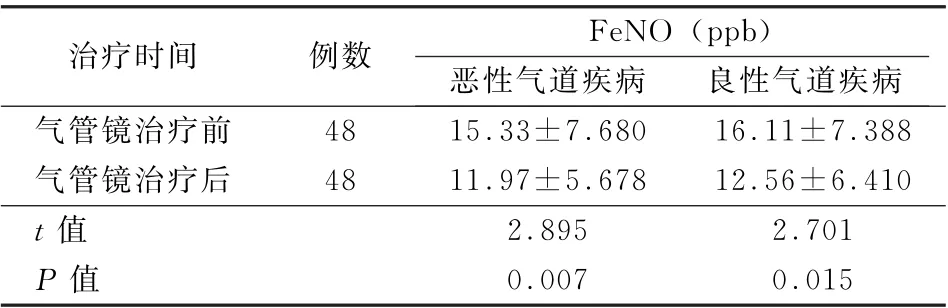
表3 中央型气道病变患者气管镜下治疗前后FeNO 水平的比较 (±s)
注:FeNO 为呼出气一氧化氮
治疗时间 例数 FeNO (ppb)恶性气道疾病 良性气道疾病气管镜治疗前 48 15.33±7.680 16.11±7.388气管镜治疗后 48 11.97±5.678 12.56±6.410 t值 2.895 2.701 P 值 0.007 0.015
3 讨论
在人肺组织中,大至中央气道,小至肺泡,如气道内皮细胞、巨噬细胞、炎性细胞等,都存在一氧化氮合酶,它能催化L-精氨酸生成一氧化氮(nitric oxide,NO)。NO 具有免疫调节功能,NO在气道疾病的生理调节中发挥作用,参与下呼吸道疾病的发病机制[4]。临床上,通过FeNO 检测下呼吸道的NO 浓度来反映气道炎症程度,NO 浓度主要来自中央型气道。目前,已有大量研究将FeNO 检测用于支气管哮喘[5]、COPD 急性发作期[6]、慢性咳嗽[7-8]、囊性纤维化[9]等呼吸系统疾病的研究,近年来也有一些学者将其应用于肺癌[10-11]、肺结核[12]等相关疾病的研究。
本研究结果发现,在无呼吸道炎性疾病情况下,恶性中央型气道病变患者FeNO 值为(15.33±7.680)ppb,这与国内外多项研究[10-11,13]肺癌患者FeNO 水平明显升高不一致。恶性中央型气道病变与良性中央型气道病变患者FeNO 差异无统计学意义,这与李杰等[14]研究结果肺癌患者的Fe NO水平显著高于肺良性占位性病变患者不一致。这可能与肿瘤细胞及正常细胞中的一氧化氮合酶并没有不同,中央型气道病变破坏气道结构,导致一氧化氮合酶有较多破坏,剩余的起作用的一氧化氮合酶较少,导致NO 生成减少相关;同时,与一氧化氮合酶需要在有氧气存在的情况下产生NO,中央型气道病变导致气道狭窄、阻塞,气流受限,导致组织缺氧,使NO 生成减少相关。
本研究结果发现,中央型气道病变处于主气道、左右支气管或主气道及左右支气管,所测量FeNO 水平差异无统计学意义,这可能与大至中央气道、小至肺泡均可产生NO,且NO 在气道管腔内存在弥散等现象相关[15]。
本研究结果发现,气管镜介入治疗前后,无论是良性中央型气道病变还是恶性中央型气道病变,患者FeNO 治疗后较治疗前均有明显下降,这与理论认为气管镜介入治疗后气道炎症增加导致FeNO 增加相悖,可能与气管镜介入下相关治疗相对无菌,可短期内造成弥漫性气道黏膜损伤,导致中央型气道内皮细胞等变性、坏死脱落,促使能够释放NO 的细胞数目明显减少相关,因此治疗后FeNO 较治疗前明显下降。
综上所述,FeNO 检测在中央型气道良、恶性病变及病变所累及位置鉴别上无指导意义,但肺恶性肿瘤侵犯中央型气道可导致患者Fe NO 测量值无明显升高;气管镜介入治疗并不会引起明显气道炎症,相反,会因为气道黏膜损伤导致Fe NO 下降,如气管镜介入治疗后FeNO 测量值显著增高,需警惕合并气道炎症。本研究中病例较少,可能会对结果有一定影响,结论需要进一步扩大样本量研究证实。
利益冲突 所有作者均声明不存在利益冲突

