PD-1抑制剂pembrolizumab停药后出现的免疫相关肺炎一例并文献复习
陈杨 方正
上海长征医院呼吸与危重症医学科200003
免疫治疗是继放化疗、靶向治疗之后,近年来晚期肿瘤治疗领域的重大突破。目前应用于临床免疫治疗的主要是免疫检查点抑制剂,它是通过抑制肿瘤细胞的免疫逃逸,增强T 细胞的免疫应答从而抑制肿瘤[1]。免疫检查点抑制剂在增强细胞免疫抗肿瘤效应的同时,也有可能增强机体正常的免疫反应,导致免疫耐受失衡,出现免疫相关性不良反应(immune-related adverse events,ir AEs)[2]。ir AEs可以累及人体的任何器官,据统计有接近2/3的患者接受免疫治疗后出现了不同程度的ir AEs[3-4],主要包括乏力 (16%~37%)[5]、皮肤毒性 (34%~45%)[6]、结肠炎 (8%~22%)[7]、肝炎(5%~10%)[8]、垂体炎(1%~18%)[9]及肺炎(2%~4%)[10]等。免疫相关肺炎总发生率不高,但对于部分严重病例却是致死性的,需要引起临床医师足够关注。现回顾性分析上海长征医院呼吸科收治的1 例晚期食管癌患者在停用pembrolizumab 4周后出现严重免疫相关肺炎的临床资料,并进行文献复习。
1 病例资料
患者男,64岁。2017年6月出现进食后哽噎,胃镜提示食管鳞状细胞癌伴坏死 (距门齿31~42 cm)。胸腹部CT 提示:食管下段占位,侵犯左下肺可能,左肺下叶感染性病变,胃小弯侧及腹膜后淋巴结肿大。于2017年9月在上海市胸科医院行“左胸食管癌根治+左肺下叶切除术”,术后病理:食管中-高分化鳞状细胞癌,大小7 cm×6 cm×3 cm,肿瘤破外膜,食管圈、胃圈及胃切端未见癌累及;胃周淋巴结1+/1 枚 (1.5 cm)见癌转移,其余淋巴结均未见癌转移;左肺下叶慢性机化性肺炎伴小脓肿形成,支气管残端慢性炎症。术后于2017年12月至2018年4月期间行4次TP方案化疗,因Ⅲ度骨髓抑制及反复房颤停止化疗。2018年4月至2018年9月期间定期随访,转移性腹腔淋巴结逐渐增大。2018年9月PET-CT 示食管癌术后腹腔淋巴结转移,淋巴结长径4.4 cm,最大标准摄取值13.29。2018年9 月至2019 年2 月期间行程序性死亡蛋白1 (programmed cell death-1,PD-1) 抑 制 剂 pembrolizumab 二 线 治 疗(Keytruda 200 mg,静脉注射,每3周1次)8个周期。治疗期间复查腹腔淋巴结转移灶逐渐缩小,至2019 年2 月复查腹腔超声,淋巴结缩小至1.7 cm。
2019年4月初患者出现活动后气急,伴咳嗽,少许咳痰,无发热、胸痛。2019年4月15日胸部CT 显示双肺多发磨玻璃影及网格状影 (图1)。4月15日出现发热,体温最高37.9 ℃,次日降至正常范围,此后未再发热。经舒普深抗感染、米乐松抗炎治疗(80 mg,1次/d,7 d),症状未改善。4月23日复查胸部CT 示实变范围扩大,弥漫性网格状影及磨玻璃影未见改善 (图2),遂转诊上海长征医院。入院后查C 反应蛋白、降钙素原,真菌D 葡聚糖试验、结核菌感染T 细胞斑点试验、真菌半乳甘露聚糖均阴性, 内毒素升高(149.5 ng/L),ESR 54 mm/1 h,自身免疫指标均阴性,痰培养提示敏感铜绿假单胞菌,考虑PD-1抑制剂Pembrolizumab 所致免疫相关肺炎合并感染,给予甲强龙(80 mg×6 d)、泰能 (0.5 g,每8小时1次)联合伏立康唑(200 mg,每12小时1次)抗感染,咳嗽、咳痰好转,但气急无好转。4月29日复查胸部CT (图3)示右下肺野实变影吸收好转,但磨玻璃影及网格状影无改善。给予甲强龙减量至40 mg×6 d (后续美卓乐40 mg 口服,每周减量1 粒,维持至8 mg),并加用吡非尼酮(起始剂量200 mg,2次/d,2周上升至400 mg,3次/d)。至6月1日停用美卓乐,7月1日停用吡非尼酮。2019 年5 月30 日 (图4)及6 月30 日(图5)复查CT 显示双肺磨玻璃影及网格状影均明显吸收,症状亦明显改善,门诊随访至今,永久停用免疫治疗。6月30日复查腹腔超声提示转移性淋巴结再次增大至2.5 cm,加用安罗替尼治疗。
2 讨论
2.1 发病率 荟萃分析结果显示,与化疗相比,PD-1/程序性死亡配体1 (programmed death ligand-1,PD-L1)抑制剂会显著提高全级肺炎的风险(nivolumab对比化疗:OR=5.49,95%CI为2.15~13.98;pembrolizumab对比化疗:OR=5.40,95%CI为2.39~12.17;nivolumab 联合ipilimumab 对 比 化 疗:OR=7.51,95%CI为2.23~25.22),其中nivolumab 联合ipilimumab方案发生3级以上肺炎的风险更高[11]。PD-1抑制剂所致的免疫相关肺炎总发生率为2.7%(95%CI:1.9%~3.6%),其中3级及以上的免疫相关肺炎发生率为0.8% (95%CI:0.4%~1.2%)[12]。不同瘤种使用免疫治疗后免疫相关肺炎的发生率也有所差异[12],肺癌患者发生免疫相关肺炎的概率高于其他瘤种,食管癌患者免疫相关肺炎的发生率尚未见报道。
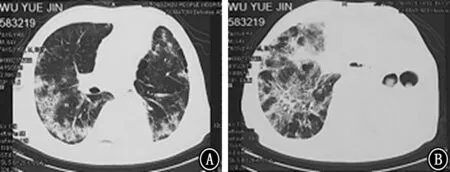
图1 2019年4月15日胸部CT 平扫 A、B:不同横断层的肺窗
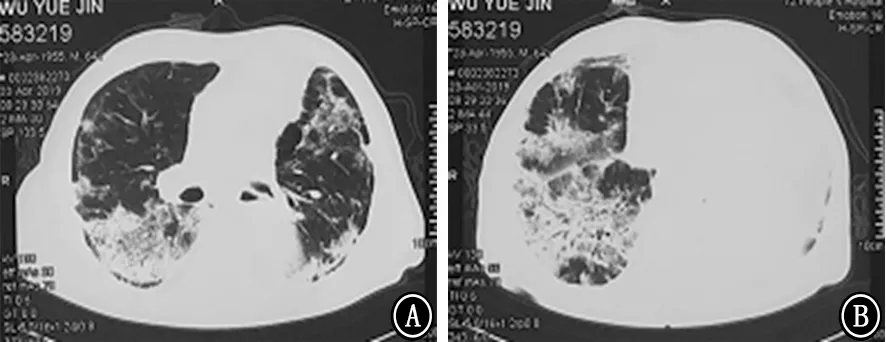
图2 2019年4月23日胸部CT 平扫 A、B:不同横断层的肺窗

图3 2019年4月29日胸部CT 平扫 A、B:不同横断层的肺窗
2.2 发病时间及发病机制 通常各系统的ir AEs都是在治疗开始后的最初几周到几个月内发生[13]。Naidoo等[14]报道包括接受抗PD-1/PD-L1单药治疗或与细胞毒性T 淋巴细胞相关蛋白4联合治疗的915 例患者,免疫治疗相关肺炎发作的时间为0.3~19.2个月不等,中位时间为2.8个月。本例患者是在治疗开始后约7个月 (停用免疫治疗4周)出现免疫相关肺炎,与文献报道的发病时间窗一致。研究显示免疫相关肺炎组织病理学多表现为淋巴细胞浸润为主的间质性肺炎[15]。免疫治疗相关肺炎患者支气管镜肺活检术结果显示肺泡腔内存在大量PD-L1 高表达的巨噬细胞[16]。Koelzer等[17]在1例尸检病例中发现,免疫相关肺炎的肺组织内存在大量CD8+T 细胞,且高表达PD-1。这些病理发现支持上述免疫相关肺炎的发生机制。de Jong等[18]报道1例晚期非小细胞肺癌患者在使用免疫治疗期间出现3级免疫相关肺炎并在停用免疫治疗后,激素减量治疗期间肺炎仍在反复发生,与本例患者有相似之处,这提示即使在停用免疫治疗后仍然存在持续的PD-1/PD-L1信号通路被阻断和效应T 细胞过度活化,其具体机制有待进一步研究证实。
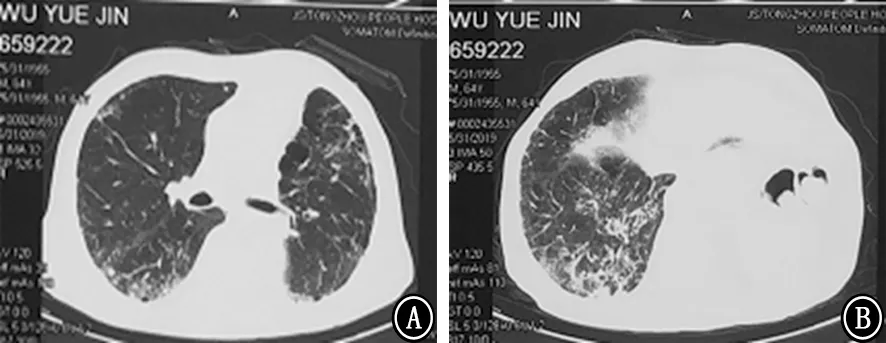
图4 2019年5月30日胸部CT 平扫 A、B:不同横断层的肺窗
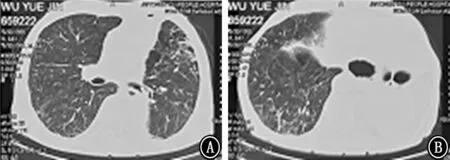
图5 2019年6月30日胸部CT 平扫 A、B:不同横断层的肺窗
2.3 高危因素 目前已有文献总结了免疫相关肺炎的高危因素,但其预测因子尚未完全明确。Sul等[19]研究显示,既往存在哮喘或COPD 基础疾病以及既往接受过胸部放疗的患者更容易发生免疫相关性肺炎。对非小细胞肺癌小样本临床研究发现,抗生素的使用和继发性肠道菌群失调与免疫治疗临床疗效以及免疫相关不良反应的发生有关[13,20]。de Jong等[18]报告晚期非小细胞肺癌在免疫治疗过程中癌胚抗原升高提示疾病进展并可能与免疫相关肺炎的发生有关,但仍需基础研究及大样本临床研究数据支持这一论点。目前尚未有不同瘤种之间在免疫治疗后发生免疫相关肺炎高危因素的比较,也尚未见食管癌患者群体发生免疫相关肺炎的高危因素报道。
2.4 诊断 免疫相关肺炎是药物所致继发性间质性肺疾病的一种类型,临床表现主要包括不同程度的气短和呼吸困难、咳嗽、发热和低氧血症,约25%的患者可无任何症状[15]。与普通感染性肺炎相比,其发热相对少见,缺氧表现更加突出,符合间质性肺炎的临床特点。影像表现多为双肺多发磨玻璃影、实变影、网格状影,多为双肺多发病灶。来自国外众多报道均显示机化性肺炎是最常见的影像学模式[21-22],其次可表现为肿瘤周围浸润,即围绕肿瘤的磨玻璃密度影[23],或者出现似于强化感染或放射性纤维化的恶化征象,尤其是在既往做过放疗并出现过放射性肺炎的患者中,要高度警惕在使用免疫治疗后导致放射性纤维化的进一步恶化。Baba等[21]研究指出影像表现为肿瘤周围浸润的患者预后较好。免疫相关肺炎病理学表现多为淋巴细胞浸润、肺泡壁增厚、纤维组织增生,可伴有肉芽肿形成[23]。由于仅少数患者可得到病理学依据,因此免疫相关肺炎需要结合病史及影像学特征进行临床综合判断。因此,遇到以下情况要考虑免疫相关肺炎: (1)有使用PD-1/PD-L1 抑制剂病史;(2)咳嗽、气短、呼吸困难伴或不伴发热;(3)影像表现为快速进展的磨玻璃影、实变影或网格影,双肺多叶受累常见;(4)抗感染治疗无效,但激素治疗有效;(5)再次使用PD-1/PD-L1抑制剂或者停用激素后疾病复发。一旦免疫相关肺炎临床诊断确立,就要对其严重程度进行分级,临床分级参考美国国立综合癌症网络指南。1级 (轻度):无症状,局限于单个肺叶或累及小于25%肺实质;2级(中度):出现新的症状/症状恶化,包括呼吸短促、咳嗽、胸痛、发热和氧气需求增加;3级 (重度):严重的症状、累及所有肺叶或>50%的肺实质、限制自我照顾性日常生活及活动;4级 (重度):危及生命的呼吸并发症。
2.5 治疗及预后 美国国立综合癌症网络指南建议当出现ir AEs时首先停用PD-1/PD-L1抑制剂,针对免疫相关肺炎,轻度 (1级)仅需要停药后临床观察;中度 (2 级)建议停药,口服泼尼松(1~2 mg·kg-1·d-1),若糖皮质激素治疗48~72 h后没有缓解,则按照3~4 级毒性反应处理;重度(3~4级)建议永久停用免疫治疗,口服泼尼松(1~2 mg·kg-1·d-1)直至症状改善、毒性反应小于1级,维持6周后激素逐渐减量,若激素使用48 h后无改善可考虑免疫抑制剂治疗英夫利昔单抗/麦考酚酸吗乙酯或静脉用丙种球蛋白[2]。1~2级ir AEs预后相对较好,可再次尝试免疫治疗,3级以上建议永久停用免疫治疗[2,13]。在此基础上,国内外学者对ir AEs的管理仍在进行不断探索。Brahmer等[24]建议3 级及以上肺炎开始服用糖皮质激素(泼尼松1 mg·kg-1·d-1),激素应在至少4 个疗程中逐渐减量 (5~10 mg/周)至6周,难治性病例需要英夫利昔单抗或其他免疫抑制剂治疗。
本病例为免疫治疗用药7 个月后 (停药4 周后)出现免疫相关肺炎,发生的时间窗符合已知文献报道。然而本病例报告指出,即使在停用免疫检查点抑制剂一段时间后仍可能发生免疫相关肺炎,仍应该定期随访胸部CT。本病例主要临床表现为气急、呼吸困难和一过性发热,单纯抗感染治疗无效,影像表现为双肺多发磨玻璃影、实变影及网格影,上述特点与文献报道一致,但该患者对激素治疗反应欠佳。后期患者腹腔转移性淋巴结已出现增大趋势,考虑PD-1抑制剂抗肿瘤效应已消退,即免疫激活作用已消退,故未再继续加用免疫抑制剂,患者双肺间质性改变明显改善。这提示免疫检查点抑制剂的不良反应与其抗瘤活性并存,因此笔者建议即使在停止免疫治疗后,也应定期随访各系统的ir AEs,直至肿瘤进展。由于该患者病程初期有难以纠正的低氧血症,加之间断发作的心房颤动,未取得病理学依据是本病例的遗憾之处。
利益冲突 所有作者均声明不存在利益冲突

