三亚周边海域泰来草形态、生长特征及其与环境营养元素含量的关系
赵牧秋,王 慧,王 帅,母 罗,符杰丽,张 权,韩秋影,史云峰
(海南热带海洋学院 生态环境学院,海南 三亚572022)
0 引言
海草是全球唯一可以完全生活在海水中的高等植物[1].尽管海草的分布面积不足海洋总面积的0.2%,但它是弥足珍贵的“海底森林”,具有重要的生态系统服务功能:可减缓海水流速稳固底质,吸收污染物净化海水水质,为近海海洋生物提供食物来源及栖息场所,同时具有重要的碳汇功能[2].海草植株由叶片、地下茎(水平根状茎和垂直茎)和根构成,通常把叶片和垂直茎合称茎枝[3].近岸海草床的生物量平均达到460 g·m-2,约占海洋植物总生物量的1%;海草初级生产力种间差异很大,平均为2.7 g·m-2·d-1,与热带草原的生产力相当[4].

三亚周围众多的潟湖、港湾、河口等适宜环境,为海草的生长繁衍提供了优越条件,并在周边海域形成以泰来草(Thalassiahemprichii)为优势种的数量众多的海草床.但由于近几十年来近海海洋工程和旅游业的发展、渔业活动的加强以及入海污染物增多,海草床面临的形势也越来越严峻[11].三亚周边海域的海草床主要分布于珊瑚礁坪内侧沿岸港湾潮间带的低潮带至潮下带上部4 m水深范围[12],由于沉积物为以钙质珊瑚砂为主的碳酸盐,营养物质比较匮乏,尤其缺乏P、Fe等营养元素;同时,有机物的输入导致沉积物中硫化物含量升高,进一步加剧了环境营养要素对海草生长及发育的胁迫作用.
因此,本研究的主要目的是了解三亚周边优势海草泰来草的形态、生长特征及其生存环境的主要营养元素含量,并分析二者的相互关系,以期为三亚海草床的保护和恢复提供参考依据.
1 材料与方法
1.1 研究区域与研究方法
笔者在三亚周边海域选择5处以泰来草为优势种的海草床(图1),分别为西岛海草区(XD)、情人湾海草区(QRW)、鹿回头海草区(LHT)、小东海海草区(XDH)和后海海草区(HH).由于同一海草床内核心区、边缘区与草斑区海草的生长状况和营养水平通常存在差异,故将后海海草区进一步划分为核心区(HH-C)、边缘区(HH-E)和草斑区(HH-P).
2019年9—10月,笔者选择大潮低潮时段进行样品采集.在每个海草分布区内随机抛出5个30 cm×30 cm的样方(间隔3 m以上),将样方内的泰来草连同地下根系一同挖出,用海水冲洗干净后带回实验室做进一步测量.同时在取样点周围0.5 m半径范围内采集海水和沉积物间隙水样带回实验室用于营养元素含量分析.泰来草样品带回实验室后,分别测定株高、叶宽、单株叶片数、根茎直径、茎枝间距、根长、茎枝对应根数等形态指标(每样方随机测定3组数据),并统计茎枝密度和根尖密度.其后,用干净的刀片将附着在海草叶片的藻类等海洋生物和杂质刮除,将样品分成地上和地下两部分,于60 ℃烘干至恒重后分别测定其地上部生物量和地下部生物量.
同时,在采样点周围(0.5 m半径范围以内)选择健康海草植株,用针孔标记法[3]测定泰来草的地上部生产力,海草生长期为5 d.
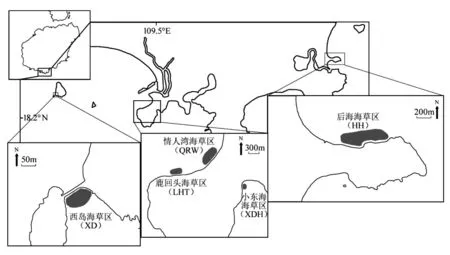
图1 三亚周边海域泰来草取样位置
1.2 水样分析与数据处理

应用Excel 2010及SPSS 22.0进行统计分析;采用One-Way ANOVA比较泰来草形态、生长指标以及海水、间隙水营养元素含量的差异;采用Pearson法对海草形态、生长指标与海水、间隙水营养元素含量进行相关分析.
2 结果与分析
2.1 泰来草形态及生长指标
泰来草茎枝形态及生长指标如表1所示.各采样区泰来草株高分布在10.5~16.4 cm范围,以后海核心区和边缘区为最高,后海草斑区和西岛次之,情人湾、鹿回头和小东海的泰来草较矮;各采样区泰来草叶宽介于0.74~0.81 cm,总体差距不大;单株叶片数为3.4~4.8,后海、小东海和西岛单株叶片较多,情人湾和鹿回头较少;不同海草区泰来草茎枝密度差异较为显著,总体呈现小东海>西岛>鹿回头>情人湾≈后海,在后海则呈现核心区>边缘区>草斑区.
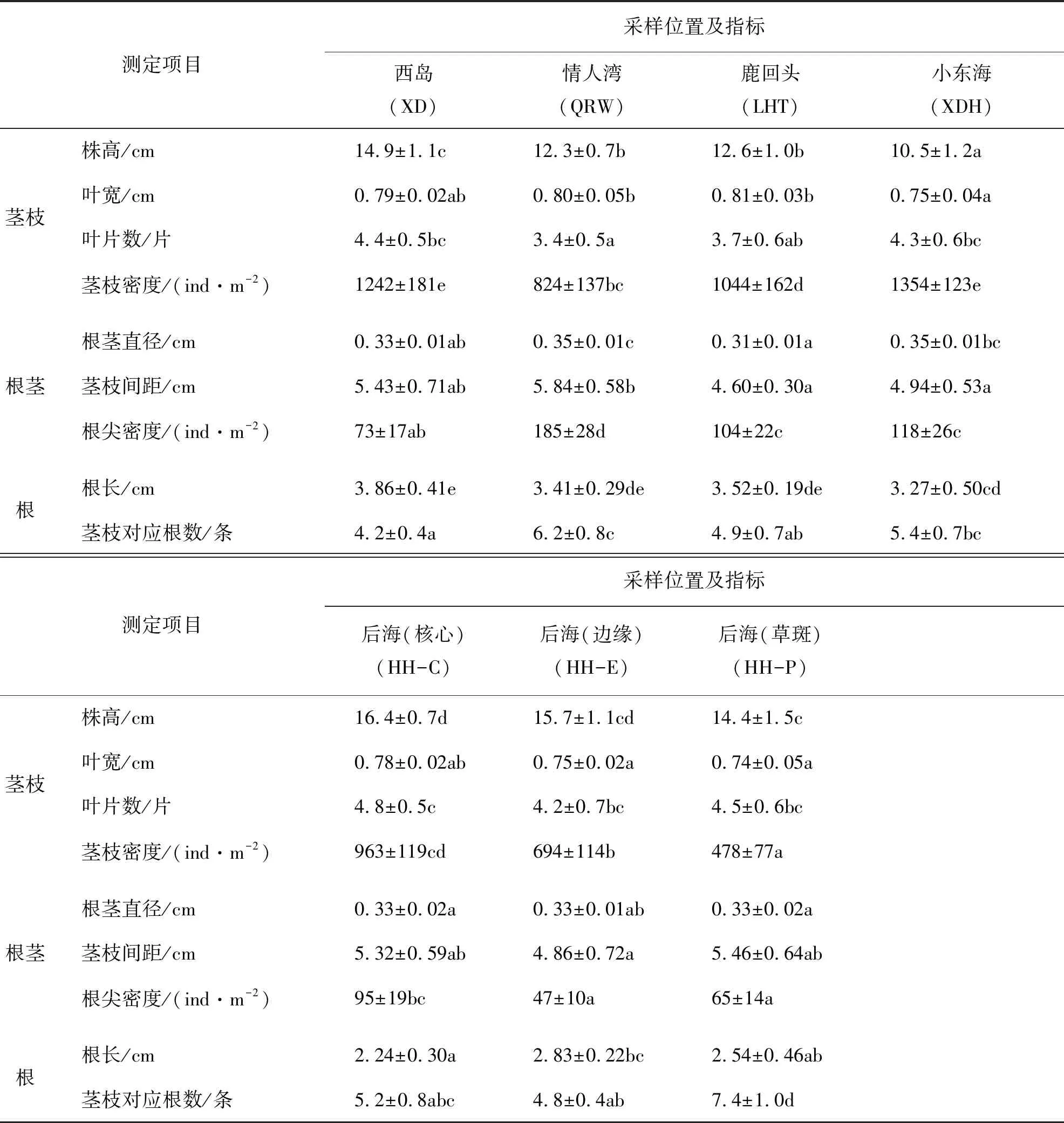
表1 三亚周边海域泰来草部分形态及生长指标
注:同一行数据后的不同字母代表各采样区的泰来草存在显著差异(P<0.05),下同.
不同海草分布区泰来草根茎直径和茎枝间距范围分别为0.31~0.35 cm和4.60~5.84 cm,且差异较小(表1).海草根尖是根茎延伸的生长点,其密度以情人湾最高,鹿回头和小东海次之,西岛和后海较低.泰来草根长分布范围为2.24~3.86 cm,以西岛、情人湾和鹿回头海草区根长较长,后海海草区根长较短;茎枝对应根数最多7.4条(HH-P),最少4.2条(XD).
本次调查的各泰来草分布区生物量及生产力情况如图2所示.由图2可知,西岛泰来草地上生物量最高,为109.1 g·m-2;鹿回头、小东海和情人湾依次降低,分别为80.8、79.4和62.4 g·m-2;后海泰来草的地上生物量按核心、边缘、草斑的顺序依次降低,分别为93.8、59.1、38.3 g·m-2.泰来草的地下生物量以情人湾最高,达到312.1g·m-2;后海草斑区(HH-P)最低,仅70.2 g·m-2;其他分布区介于102.3~172.5 g·m-2范围.各区海草总生物量(地上生物量+地下生物量)介于108.4(HH-P)~374.5(QRW) g·m-2范围,地下生物量/地上生物量介于1.16(XD)~5.00(QRW)之间.
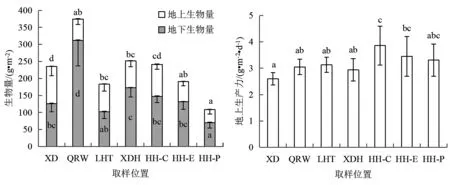
图2 三亚周边海域泰来草生物量和地上生产力
后海泰来草具有最高的生产力,平均达到3.54 g·m-2·d-1,且核心区、边缘区和草斑区差异不显著;情人湾、小东海和鹿回头海草生产力居中且无显著性差异;西岛泰来草生产力最低,为2.60 g·m-2·d-1.
2.2 海草床环境营养元素含量
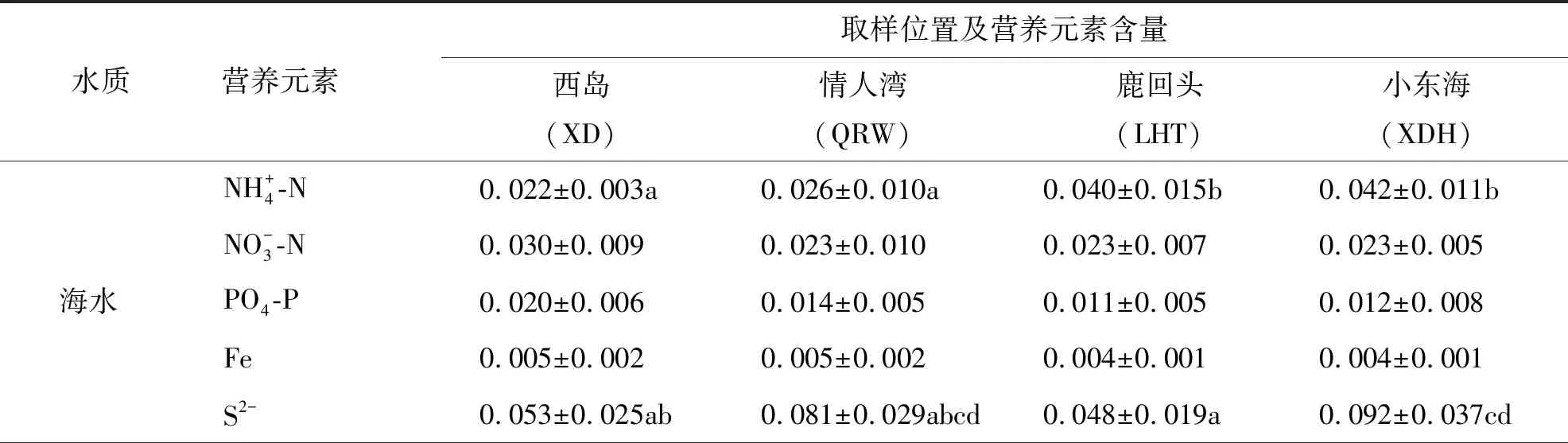
表2 三亚周边海域泰来草分布区海水和沉积物间隙水营养元素含量
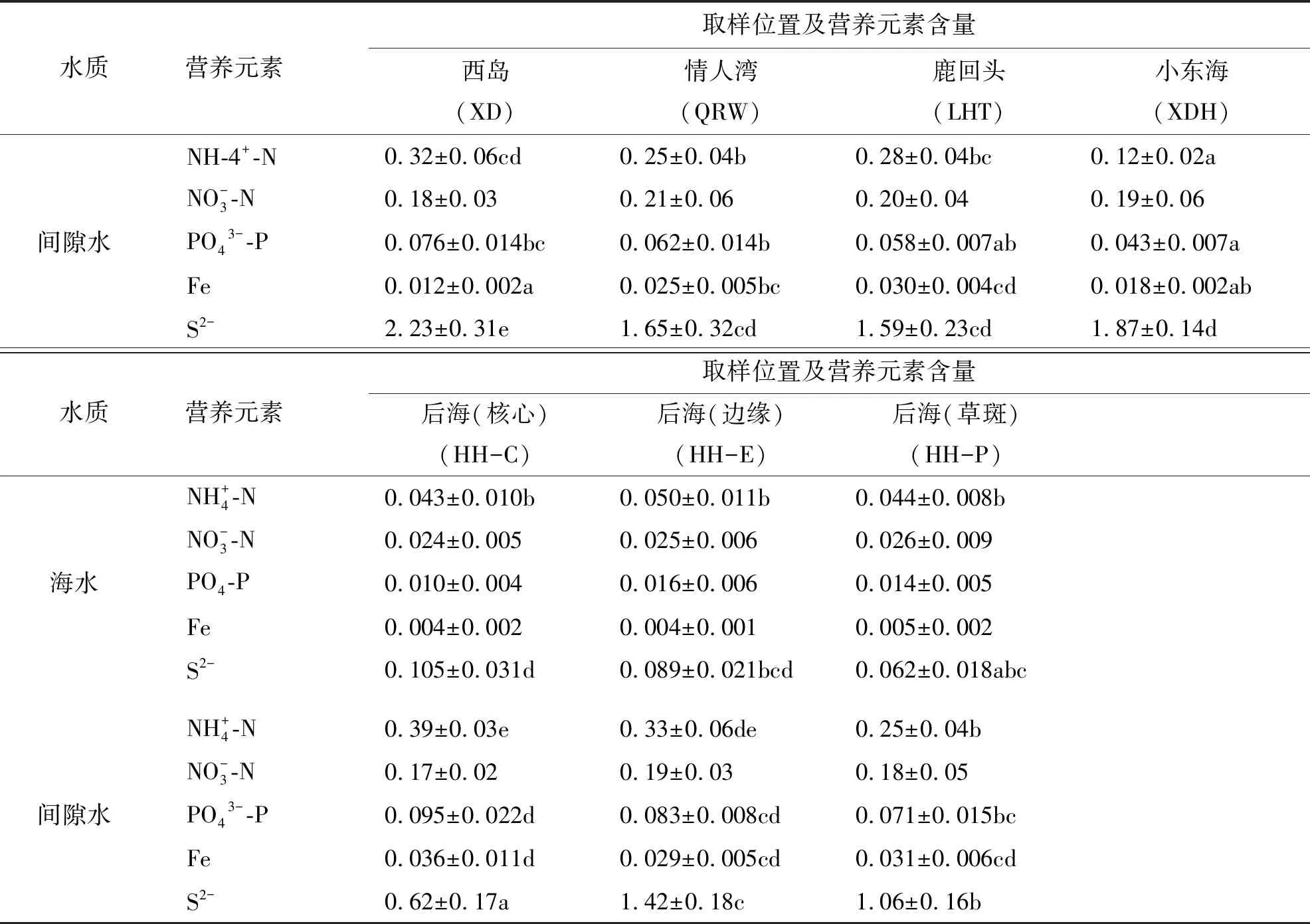
表2(续)
2.3 泰来草形态、生长指标与环境营养元素含量之间的相互关系
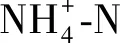
表3 三亚周边海域泰来草形态、生长指标与环境营养元素含量的相关系数
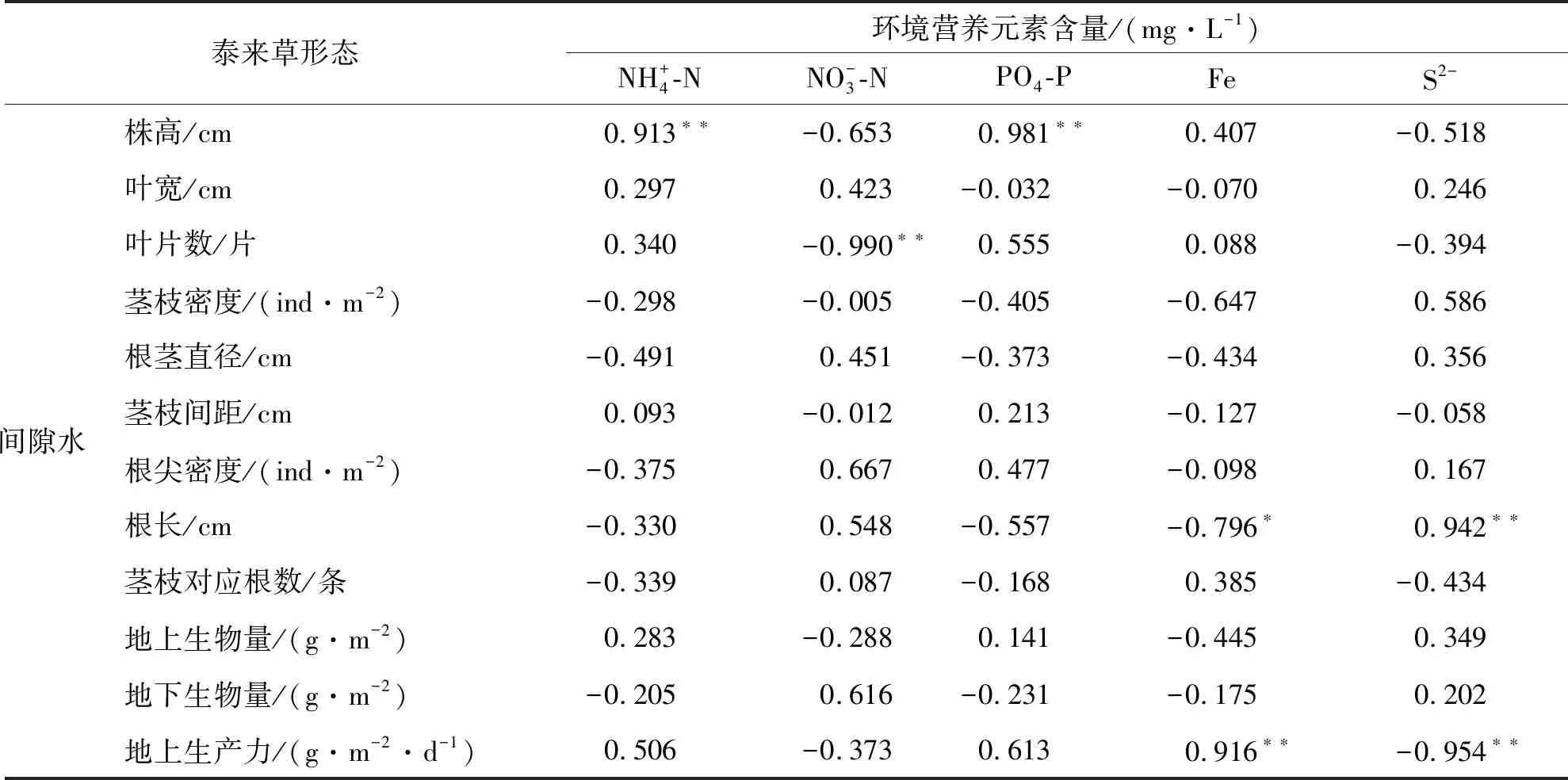
表3(续)
注:*代表显著相关(P<0.05),**代表极显著相关(P<0.01),下同.
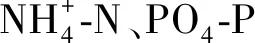
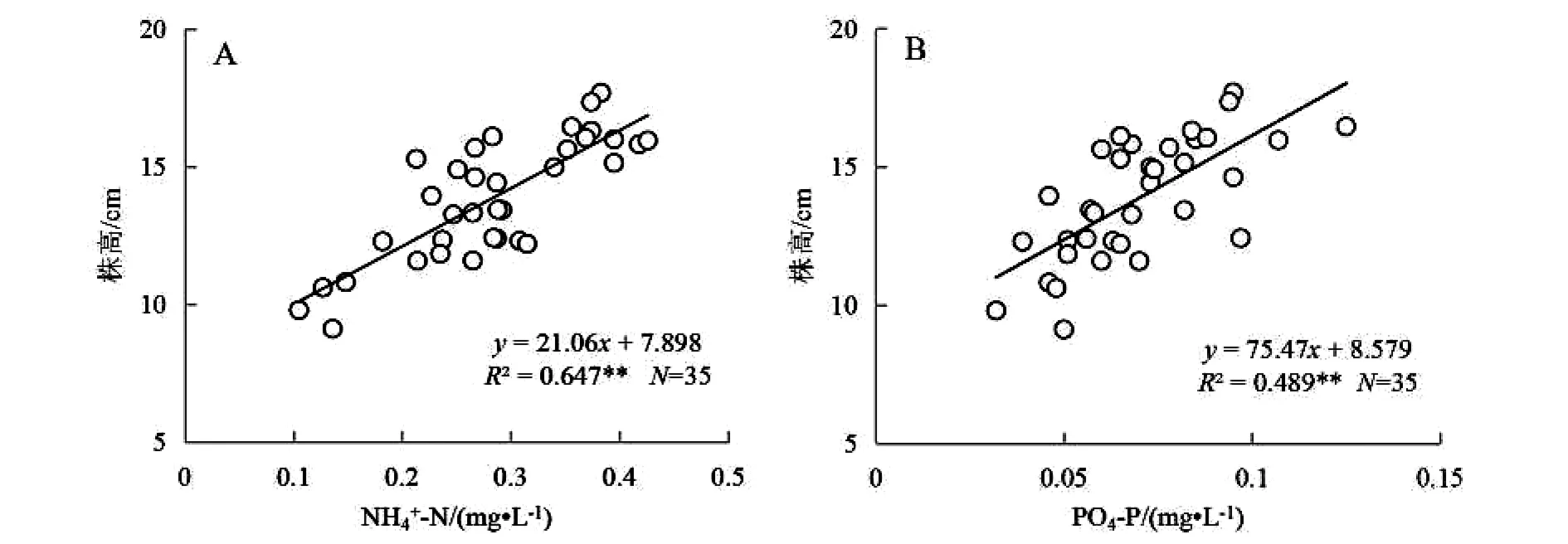
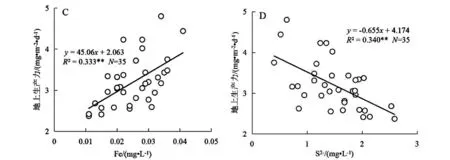
图3 三亚周边海域泰来草株高(A、B)和地上生产力(C、D)与部分环境营养元素含量的相关性分析
3 讨论
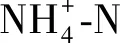
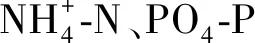
Fe元素是植物生长及代谢必不可少的营养元素[17].有学者认为在热带海区,由于Fe易被碳酸盐底质所束缚导致其有效性极地,可能成为海草生长的限制因素[18].本研究发现泰来草地上生产力与沉积物间隙水Fe含量存在极显著(P<0.01)的正相关关系,说明Fe的含量极有可能是三亚周边海区海草生长的限制因子,而沉积物间隙水是海草Fe元素重要的供给源.Whelan等[19]和Xu等[9]60认为泰来草主要是通过海水而不是沉积物吸收Fe元素,而本研究并未发现泰来草的形态或生长指标与海水Fe含量存在显著相关关系.
尽管沉积物硫化物是海草S营养的主要来源[20],但已有大量研究表明,沉积物中硫化物的积累是导致海草床退化的重要诱因[21-22].本研究结果表明,三亚周边海域泰来草的生产力与沉积物硫化物含量呈极显著(P<0.01)负相关关系,这也再次证实海草床硫化物含量的增加可降低海草的生产能力,并可能最终导致海草床的衰退.

