萘乙酸对绿豆芽维生素C的影响及其残留量的研究
陈功轩,王 杏,张洪权,邓樱花*
(1.湖北第二师范学院化学与生命科学学院,武汉 430205;2.湖北第二师范学院植物抗癌活性物质提纯与应用湖北省重点实验室,武汉 430205)
绿豆芽含有丰富的营养成分,例如维生素C、B、A、E及多种矿质元素,其中维生素B17是较强的抗癌物质,经常食用芽菜能有效防治高血压、糖尿病、高胆固醇、胃癌及直肠癌等多种疾病[1-2].绿豆芽因营养价值高,为广大消费者所喜爱,市场需求量极大.
研究表明,萘乙酸(NAA)是一种广谱型植物生长外源性调节剂,机理上NAA能显著促进内源性生长素生成及代谢[3-4].生长素参与植物生长发育的各个阶段,它们可能在极低的浓度条件下调节细胞的伸长、分裂,组织肿胀,不定根的形成,胚胎发生的诱导以及促进细胞壁的松弛等[5].因此在农业生产中,为加快种子发芽,植株生长,有人将NAA应用于种子萌发和生长的各个阶段.但是NAA对人畜是有低毒性的,大鼠急性口服LD50为1 000~5 900 mg·kg-1,对皮肤和粘膜有刺激作用.因此从食品安全的角度看,寻找一种灵敏度高、专一性强、操作简便的定性定量分析NAA残留的方法具有重要意义.
目前,NAA的分析方法主要有高效液相色谱法(HPLC)[6]、液相—质谱联用法[7]、气相色谱法[8]、气相—质谱联用法[9]等多种方法.高效液相色谱法具有专一性强、灵敏度高、重现性好和操作简便等优势,被广泛应用于NAA的测定[10-12].
本文以市场上出售的普通绿豆为试材,发芽后测定不同浓度NAA处理下的胚根、下胚轴和子叶等部位维生素C含量,初步探讨不同浓度NAA对绿豆芽维生素C的影响,旨在为绿豆芽生产选择最适浓度的生长调节剂提供一定的参考价值.此外,采用高效液相色谱法,对绿豆芽中NAA的残留做进一步分析测定.
1 实验部分
1.1 试剂和仪器
萘乙酸(NAA)、磷酸、可溶性淀粉、碘酸钾、碘化钾、氢氧化钠等均为分析纯,购于国药集团化学试剂有限公司;甲醇(HPLC级)购自Tedia (Tedia Chemical,USA).
Agilent1260高效液相色谱仪(配四元泵、在线脱气和紫外检测器)、BD-FYX种子发芽箱(南京贝蒂实验仪器有限公司)、SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司)、BUCHI旋转蒸发仪R-210(瑞士步琦有限公司)、Eppendorf高速离心机5840R(恒科贸易)、ME104E 电子天平(瑞士梅特勒-托利多公司)和FE28 pH计(梅特勒-托利多有限公司).实验中所用水为超纯水(Millipore,Bedford,MA,USA).
NAA培养液的配制:准确称量一定量NAA,用少量酒精溶解,再用超纯水配制浓度为1×10-5mol·L-1的NAA培养液,再逐步稀释成1×10-6、1×10-7、1×10-8、1×10-9mol·L-1的NAA培养液,共5个浓度.
NAA标准工作液的配制:称取NAA 适量,精密称定,用甲醇溶解并定容至10 mL,配制成250 μg·mL-1的储备液;然后将储备液稀释成为0.50~30.00 μg·mL-1的NAA标准工作液系列,低温避光保存.
1.2 实验方法
1.2.1 发芽试验 挑选外表无残缺、健康、发芽势好、发芽率高的200粒新鲜绿豆六组.取6个培养皿编号1、2、3、4、5、6,用酒精擦拭消毒,1到5号培养皿分别依次加入10 mL的1.9 μg·mL-1、1.9×10-1μg·mL-1、1.9×10-2μg·mL-1、1.9×10-3μg·mL-1、1.9×10-4μg·mL-1NAA 培养液和200粒绿豆,6号培养皿中加入10 mL超纯水和200粒绿豆作为对照.放入种子发芽箱内培养,温度设为25 ℃,无光照.每天9∶00、14∶00、19∶00分别在6个培养皿中定时浇自来水30 mL.
1.2.2 维生素C(Vc)含量的分析(碘量法) 样品提取:在培养的第7 d,将用NAA溶液处理过并发芽且长势一致、性状稳定的绿豆芽依次按从小到大的浓度选取足够量作为实验材料.然后用天平称取0.5 g绿豆芽的子叶各三份放入研钵中,充分研磨匀浆,分别移取2%的盐酸4 mL冲洗研钵加入10 mL离心管中,摇匀,放入离心机离心转速为4 000 r·min-1,温度为4 ℃,时间15 min,取上清液为提取液[13].
滴定:在三角瓶中,用移液管中注入1% KI液0.50 mL、0.5% 淀粉液1.00 mL、样品提取液5.00 mL、蒸馏水3.50 mL.用0.000 167 mol·L-1碘酸钾滴定,缓慢加入并摇动三角瓶.至溶液颜色为微蓝色,半分钟不褪色.记录消耗碘酸钾的毫升数.另空白对照组加入1% KI液0.50 mL、0.5% 淀粉液1.00 mL、2% 盐酸5.00 mL、蒸馏水3.50 mL[14].
以相同方法测量绿豆芽下胚轴、胚根中Vc含量.
1.2.3 色谱分析方法
1) 色谱条件
色谱柱:Agilent ZORBAX Eclipse Plus C18反相色谱柱(4.6×150 mm,5 μm);流动相:A为甲醇、B为磷酸-氢氧化钠缓冲溶液(0.01 mol·L-1,pH=3.0);流动相比例A%∶B%=70∶30,等度洗脱;柱温:40 ℃;检测波长为220 nm;流速1.0 mL·min-1;进样量20 μL.
2) 样品处理
参考文献[15]的样品处理方法,在培养的第8天,选取培养的长势正常、性状完整的豆芽,纯水润洗三次再用滤纸吸干,准确称取20.0 g,切碎后将样品研磨成匀浆,加入60 mL预冷(-20 ℃)的80%甲醇溶液,匀浆液在常温下(不超过25 ℃)超声震荡30 min,然后在4 ℃、4 000 r·min-1的条件下离心15 min.抽滤,将滤液转至旋蒸瓶内,减压蒸发浓缩至约10 mL水溶液.
将减压浓缩后的水溶液用2.0 mol·L-1HCl调pH至2.5~2.9,溶液转入250 mL的分液漏斗,加入相同体积的乙酸乙酯萃取2~3次.NAA在此条件下完全溶于乙酸乙酯溶液中.合并上层乙酸乙酯相,并在旋转蒸发仪上减压蒸发(38 ℃)至干,用纯甲醇溶解后定容至10 mL进行HPLC分析.
2 结果与讨论
2.1 不同浓度NAA对绿豆芽Vc含量的影响
用碘量法对绿豆芽胚根、下胚轴、子叶等部位所含VC的量进行测量,对比施加NAA培养液和空白组,分析NAA对绿豆芽品质的影响.测量结果见表1.

表1 绿豆芽中各部位Vc含量Tab.1 Vc content in different parts of mungbean sprouts
由表1可知,在培养绿豆芽过程中,不同浓度的NAA培养液对豆芽品质有一定的影响.从下胚轴来看,当NAA浓度为1.9×10-1μg·mL-1时,Vc含量为NAA空白培养液的2倍以上(p<0.05).从子叶来看,当NAA浓度为1.9 μg·mL-1、1.9×10-1μg·mL-1时Vc含量均较高,其含量为空白的2.5至3 倍左右(p<0.05).综合比较,认为采用较低浓度而非高浓度NAA培养液,如1.9×10-1μg·mL-1,即能促进绿豆发芽成根,及提升绿豆芽中Vc含量,这与文献[16-17]吻合.
2.2 NAA分析色谱条件的建立
2.2.1 最大吸收波长的确定 在190~400 nm紫外波长范围内对NAA的标准溶液进行扫描,如图1所示.从图中可见,NAA的最大吸收波长为220 nm.后续NAA残留分析中,紫外检测波长选择在220 nm.
2.2.2 流动相的选择 分别采用45%、55%、65%、70%、75%含量的甲醇作为流动相,考察其对NAA保留时间的影响.当甲醇含量为45% 的时候,NAA保留时间为13.22 min,如图2所示,时间较长.随着甲醇含量提高,NAA保留时间变短,当甲醇含量为70%的时候,NAA保留时间2.76 min,时间较短,如图3所示.当甲醇含量继续提高到75%时,NAA与杂质峰没有达到基线分离.因此实验中选用70%甲醇,30%磷酸缓冲溶液(0.01 mol·L-1,pH=3.0)为最合适的流动相.

图1 NAA紫外吸收光谱图Fig.1 The ultraviolet absorption spectrum of NAA
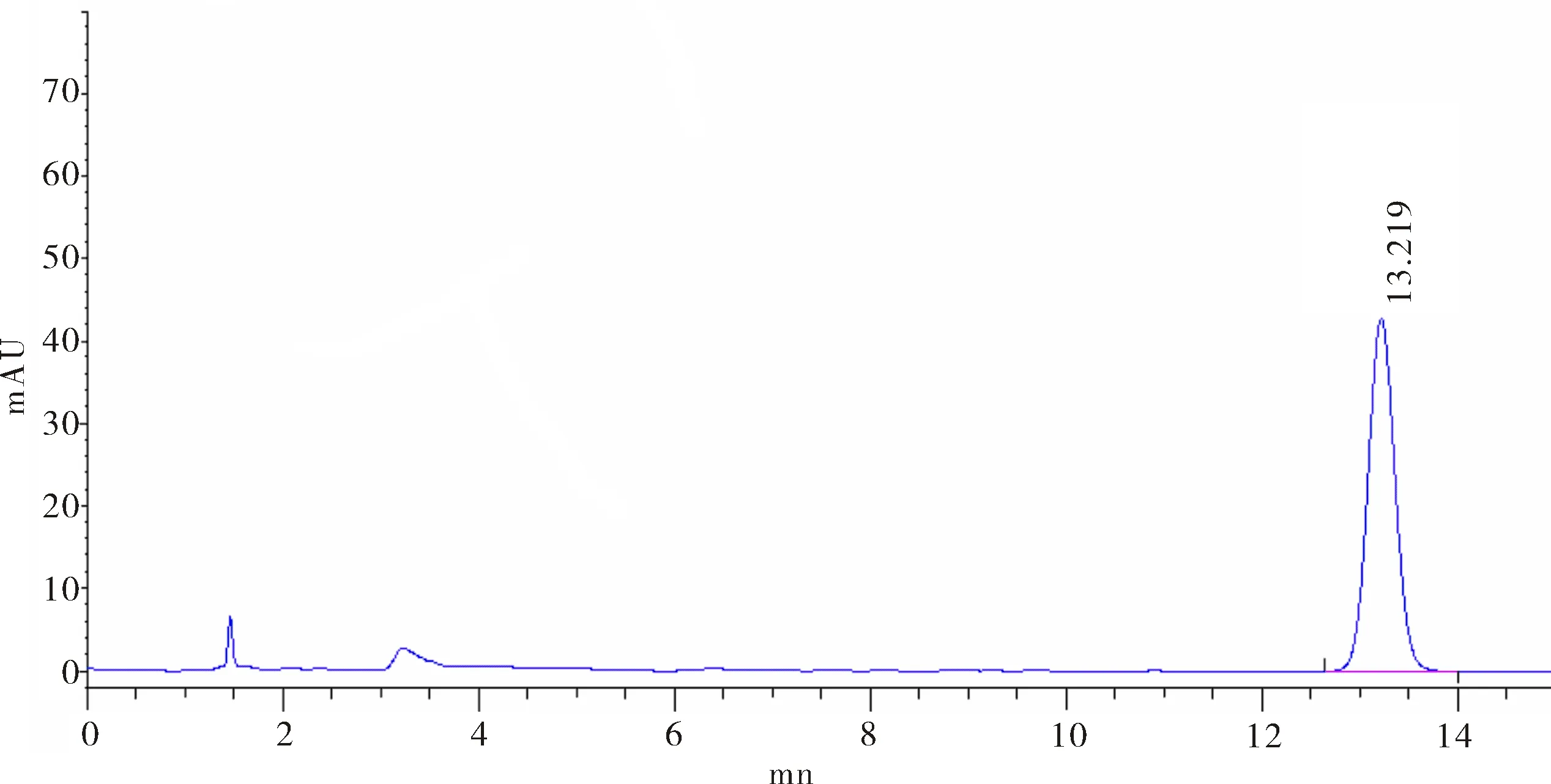
图2 流动相中甲醇含量为45% NAA的色谱图Fig.2 Chromatogram of NAA when the methanol content is 45% in mobile phase
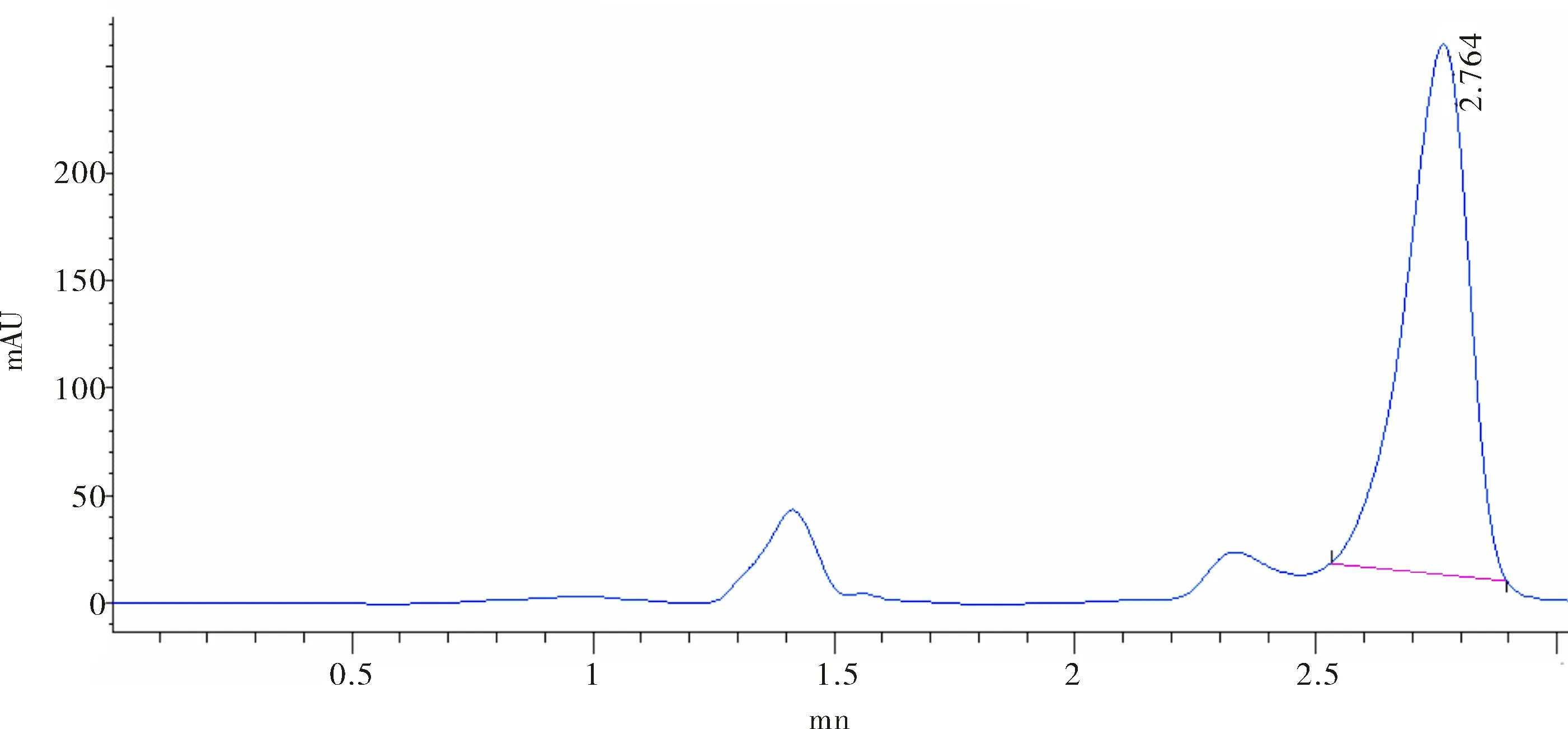
图3 流动相中甲醇含量为70% NAA的色谱图Fig.3 Chromatogram of NAA when the methanol content is 70% in mobile phase
2.2.3 柱温的选择 柱温对物质的分离具有重要的影响,柱温过高会使分离对象的扩散速度加快,分离时间缩短;柱温过低,降低扩散速度和分离效能,同时出现峰形变宽等现象[10].实验中,考察了不同的柱温对NAA分离的影响,结果表明当柱温为30 ℃和35 ℃时,峰形较宽,保留时间较长;当柱温超过40 ℃时,NAA与杂质峰没有达到基线分离.最后选择的柱温是40 ℃.
2.3 NAA检测方法学的考察
2.3.1 NAA线性范围与检出限 配制0.50、1.00、3.75、7.50、15.00和30.00 μg·mL-1的NAA标准溶液,按“1.2.3色谱条件”进行测定,绘制样品浓度(横坐标X,μg·mL-1)与峰面积(纵坐标Y,mV·s)标准曲线,进行线性回归分析,且当信噪比为3(S/N=3)时,该方法对NAA的最低检出限(LOD)为0.01 μg·mL-1.对30.00 μg·mL-1的NAA溶液进行5次重复实验,其相对标准偏差(RSD)为2.19%.分析结果如表2所示,结果表明方法在0.50~30.00 μg·mL-1线性范围内,线性良好,精密度较高.

表2 线性范围及检出限Tab.2 The linear range and limit of detection
2.3.2 NAA样品加标回收率和精密度 本实验中样品均来自于实验室自发的绿豆芽.在绿豆芽的成熟期(8 d)后进行样品添加回收测定,分别加入1.00、7.50、15.00 μg·mL-1的NAA标准溶液,按照1.2.3所述对样品进行前处理操作后,进行色谱测定,实验结果如图4所示.为了考察方法的精密度,对每一添加浓度样品重复测定5次.结果表明:NAA的加标回收率在100.2%~110.6%之间,相对标准偏差(RSD)在2.90%~3.89%之间,方法的回收率和重现性均较好.所得结果见表3.

A) 绿豆芽空白样品;B) 样品添加15.00 μg·mL-1 NAA标准溶液A) control sample;B) mungbean sprout sample with 15.00 μg·mL-1 NAA图4 绿豆芽样品色谱图Fig.4 Chromatograms of the mungbean sprout samples

表3 方法加标回收率及精密度Tab.3 Standard recovery rate and precision
2.4 样品中NAA残留量的分析
在绿豆芽的成熟期(8 d)后按照1.2.3所述进行前处理后,采用建立的分析方法对NAA溶液培养的绿豆芽中的NAA残留量进行分析,所得结果如表4所示.
从表中可见,培养皿中添加一定浓度的NAA后,绿豆芽中的NAA残留量均高于空白对照组.但可以看到,在测试的NAA培养液的浓度范围内(1.9 μg·mL-1及以下),绿豆芽中的NAA含量不超过0.041 μg·g-1.根据我国《GB2763-2012食品中农药最大残留限量》中规定萘乙酸的限量为0.1 mg·kg-1[18],说明本实验选取的NAA培养基浓度可安全地用于绿豆芽生产过程而不会导致残留问题.

表4 绿豆芽中的NAA残留量Tab.4 Residues of NAA in mungbean sprout
3 结论
本文选用对照培养的方法,比较探究NAA对绿豆芽中Vc的代谢影响,实验结果表明NAA培养液浓度为1.9×10-1μg·mL-1时,绿豆芽中Vc含量最高,这可为绿豆芽的培养选择最适浓度的生长调节剂提供一定的指导价值.而且,本研究表明NAA对于绿豆芽生根及发芽具有促进作用,并发现对营养成分如Vc在绿豆芽不同部位分布具有一定的影响.研究探索NAA与内源性生长素如吲哚-3-乙酸的代谢和分布关系,具有一定的科学实用价值,也是将来可能的研究方向.
此外,本文建立了一种分析绿豆芽中NAA残留的方法,流动相为甲醇和磷酸-氢氧化钠缓冲溶液(0.01 mol·L-1,pH=3.0)(70∶30,V/V)组成,柱温为40 ℃,紫外检测波长220 nm.该方法的线性关系良好,检出限较低、精密度好、回收率比较理想.所建立的绿豆芽中植物激素残留的测定方法满足国家标准对食品中植物激素残留测定的要求,可提供给相关部门用于对农产品和食品的质量监控.

