n-3多不饱和脂肪酸的抗炎作用和2型糖尿病
孙桂菊,柳和春,许登峰,陆怡霏
·营养健康促进·
n-3多不饱和脂肪酸的抗炎作用和2型糖尿病
孙桂菊,柳和春,许登峰,陆怡霏
东南大学公共卫生学院,南京,210009。
众多研究表明,n-3多不饱和脂肪酸(n-3PUFA)具有抗炎作用,同时也与2型糖尿病(T2DM)的发生发展有关。本文对n-3PUFA通过抗炎作用改善T2DM的作用进行了阐述,为n-3PUFA在T2DM预防和治疗中的应用提供科学依据。
n-3多不饱和脂肪酸;炎症因子;2型糖尿病
糖尿病已成为威胁人类健康最重要的慢性非传染性疾病之一。2019年国际糖尿病联盟数据显示,全球20~79岁糖尿病患者总数达4.63亿,占该年龄段人口总数的9.3%;我国20~79岁糖尿病患者总数为1.16亿[1]。2013年涉及我国31个省级行政单位的研究显示,糖尿病患病率在5.4%~ 22.1%,北部地区患病率高,西部和南部地区患病率低[2]。《中国居民营养与慢性病状况报告(2015年)》显示,2012年我国18岁及以上居民糖尿病患病率为9.7%[3],其中,江苏省18岁以上居民糖尿病患病率为8.9%[4]。南京市成人糖尿病患病率是7.4%,随着年龄的增加,糖尿病的患病率有明显增高的趋势,60岁以上人群糖尿病患病率达19.8%[5]。心血管疾病(cardiovascular disease,CVD)是糖尿病患者特别是2型糖尿病患者死亡的主要原因,成年糖尿病病人的CVD发病风险高出无糖尿病人群2~4倍[6]。研究表明,n-3多不饱和脂肪酸(N-3 polyunsturated fatty acid,n-3 PUFA)与2型糖尿病(type 2 diabetes mellitus,T2DM)和炎症均有关系,尤其炎症水平在慢性病发生发展中的作用近年来成为医学的研究热点,但动物试验和体外试验研究较多。下面就n-3 PUFA的抗炎作用及其在T2DM发生发展中作用的人群研究资料进行分析和阐述。
1 n-3 PUFA在体内的代谢转化及产物
膳食中n-3 PUFA来源分为动物性来源和植物性来源。动物性来源主要为海产品,以二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexenoic acid,DHA)为代表,植物性来源主要为亚麻籽油、紫苏油等,以-亚麻酸(Alpha-linolenic acid,ALA)为代表。n-3和n-6 PUFAs在生物体内都发挥重要作用,这两族PUFA在功能上相互协调制约,共同调节生物体的生命活动。如图1所示,n-6 PUFA的母体是亚油酸(linoleic acid,LA),由它可衍生出γ-亚麻酸(γ-linolenic acid,GLA)、花生四烯酸(arachidonic acid,AA)等;n-3 PUFA的母体是ALA,可转化成EPA、二十二碳五烯酸(docosapentaenoic acid,DPA)和DHA。Delta-5去饱和酶(D5D)和Delta-6去饱和酶(D6D)是由FADS1和FADS2基因编码的,是n-3和n-6 PUFA代谢的共同关键酶[7]。n-6系列的AA可产生二十碳烷酸(PGE2、PGI2、TXB2和LTB4),n-3系列的EPA可产生二十碳烷酸(PGE3、PGI3、TXB3和LTB5)。来自n-6 PUFAs的TXB2有强烈的血小板凝集和血管收缩作用,而来自n-3 PUFAs的TXB3则无血小板凝集作用,而且血管收缩作用极弱[8];来自n-6 PUFA的LTB4是促白细胞趋吞噬、血小板凝集、增强血管通透性和促进溶酶体酶释放的重要炎性介质,如肿瘤坏死因子(tumor necrosis factor,TNF)、白介素-6(interleukin 6,IL-6),而来自n-3 PUFA的LTB5在这些方面的作用则较LTB4小得多。另外,n-3 PUFA代谢过程中还产生具有抗炎作用的其他内分泌素,如缓解因子、神经保护因子[9]。尽管ALA可以在体内转化成EPA和DHA,但是其转化率非常低。所以人体必须摄入一定量含有EPA和DHA的食物(如鱼油),才能达到最佳能量代谢比例。不同年龄和性别的ALA转化率亦不相同。男性ALA转化为EPA和DHA的转化率分别为4%~8%和0%~4%。女性中的ALA转化率较高,分别为21%和9.2%[10]。见图1。
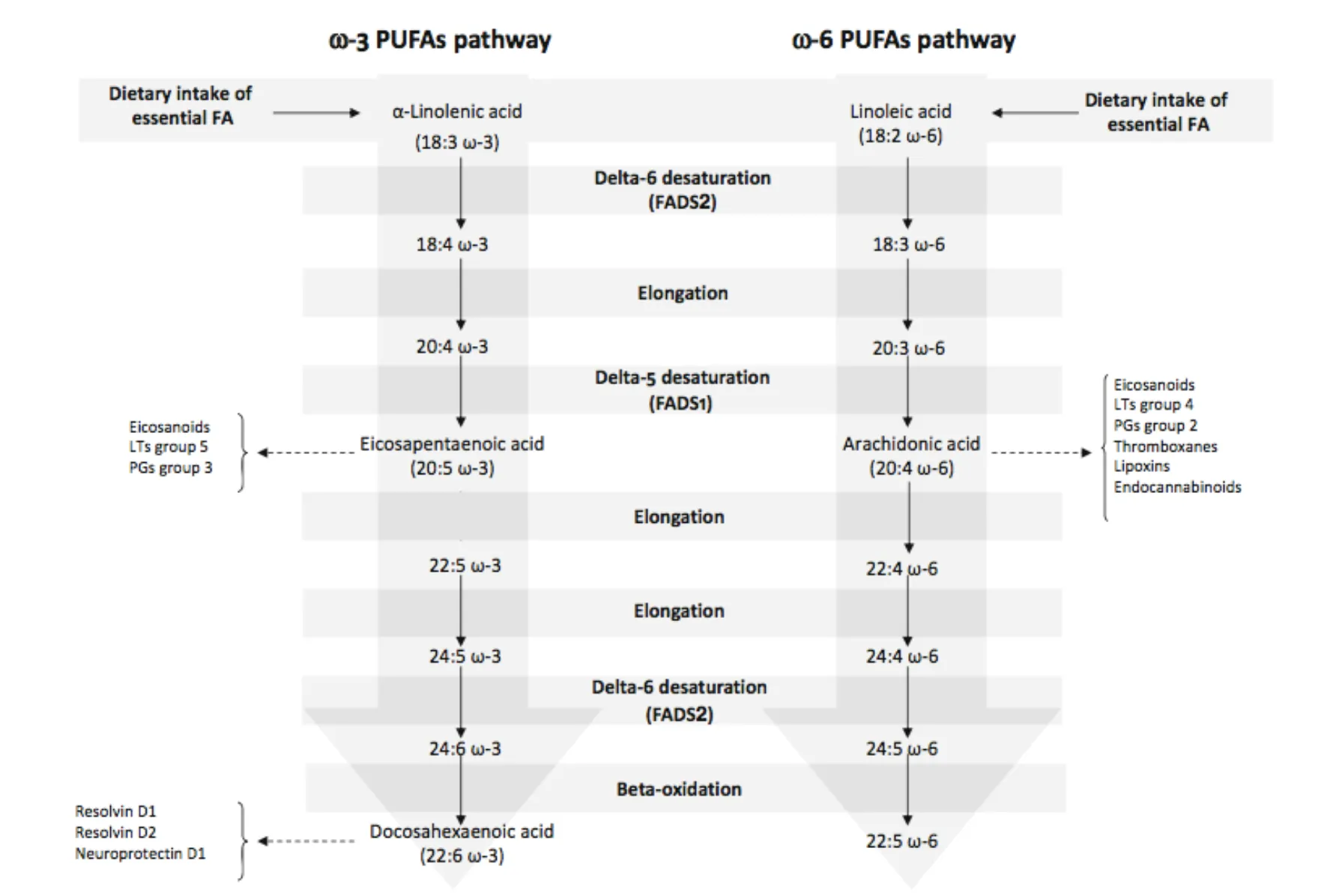
图1 n-3和n-6 PUFAs代谢途径
2 n-3 PUFA与2型糖尿病
在过去的几十年间,尽管发表了不少关于膳食n-3 PUFA摄入与糖尿病发病风险的研究,其结论仍存在争议。研究结果一方面显示n-3 PUFA可降低T2DM风险,如日本[11]、新加坡华人[12]、中国上海女性队列研究[13]均显示摄入较多的鱼类等海产品与T2DM发病风险呈负相关。2019年我国的一项前瞻性队列研究显示n-3 PUFA摄入量低可能与较高的T2DM风险有关[14]。随机对照研究显示,鱼油对老年T2DM患者胰岛素敏感性有改善作用[15],且动物性来源(鱼油)、植物性来源(紫苏油)及动植物性来源(鱼油+ALA)兼有的n-3 PUFA在改善T2DM合并血脂异常人群糖代谢方面均有作用[16]。另一方面研究显示,n-3 PUFA与糖尿病发病风险相互关系在不同种族人群中的研究不一致。2016年一项前瞻性队列研究的meta分析显示,在亚洲人群中,n-3 PUFA与糖尿病发病风险呈负相关,在西方人群中则呈现正相关[17]。24项队列以及病例对照研究也发现,亚洲人群摄入鱼类和海洋性n-3 PUFA可降低T2DM发生风险,摄入高剂量鱼类和海洋性n-3 PUFA对西方人群则是危险因素[18]。
3 炎症因子与n-3 PUFA
炎症反应的基本要素包括炎症细胞(巨噬细胞、粒细胞、淋巴细胞、血小板、内皮细胞)、炎症介质(TNF、IL、PAF、LTs、PGs、粘附分子、自由基、溶酶体酶、蛋白酶、缓激肽、补体系统等)、靶细胞(器官或系统的实质细胞、上皮细胞等)以及引起的效应(微循环障碍和内脏器官代谢功能和形态损伤、凝血功能紊乱、微血管微血栓形成等)。在炎症过程中由细胞释放或由体液产生的、参与或引起炎症反应的化学物质称为炎症介质(inflammatory mediators)。细胞因子(cytokine)是众多炎性介质的一部分。细胞因子是多种细胞所分泌的能调节细胞生长分化、调节免疫功能、参与炎症发生、创伤愈合等具有生物活性的低分子量蛋白质或多肽的总称,包括白细胞介素(interleukins,ILs)、干扰素(interferon,IFN)、肿瘤坏死因子(tumor necrosis factor,TNF)、集落刺激因子(colony- stimulating factor,CSF)、趋化因子(chemokines)、生长因子(growth factor,GF)[19]。细胞因子具有介导天然免疫、介导和调节特异性免疫应答、诱导凋亡、刺激造血等功能,近年来与慢性非传染性疾病的关系也引起了广泛关注。体内炎症反应的发生是促炎-抗炎因子的平衡的结果,如肿瘤坏死因子-α、干扰素-γ、白细胞介素-6、血栓素A2、白三烯、血小板活化因子及氧自由基、C反应蛋白(C- reactive protein,CRP)、前列腺素等是促炎因子,而IL-4、IL-10、IL-13等,转化生长因子-β1(TGF-β1)、脂联素,抗氧化维生素等是抗炎因子。
膳食n-3 PUFA也能影响体内的炎性水平,属于抗炎因素。n-3 PUFA抗炎症反应的作用机制:一是n-3 PUFA富集于细胞膜,提高细胞膜EPA和DHA脂肪酸的比例,影响胞内信号传导,抑制炎症相关的转录因子NF-kappa B的转录活性[20],从而减少促炎性细胞因子TNF-alpha、IL-6和IL-8等的表达[21];二是如前所述,n-3 PUFA可以抑制花生四烯酸类产生促炎症调节作用的前列腺素(PGE2)和白三烯B4等;三是n-3 PUFA代谢生成具有消炎、止痛等生理活性的衍生物,如经酶催化产生消退素(resolvins)和保护素(protectins),可刺激中性粒细胞和巨噬细胞等分泌产生抗炎性细胞因子IL-4、IL-10、IL-13等,来减弱炎症反应,调节机体炎症水平。实验研究证实,消散素和保护素在关节炎、结肠炎、哮喘、急性肾损伤等多种炎性疾病中发挥重要的抗炎作用[22-24]。Resolvin E1,resolvin D1和protectin D1能抑制浸润性中性粒细胞的细胞迁移,从而减轻局部炎症[24]。此外,resolvin D1和protectin D1还能抑制TNF-and IL-1的产生,从而减弱炎症反应[25]。
4 n-3 PUFA抗炎作用在改善T2DM中的作用
近年来,众多研究表明,体内高炎性水平与胰岛素抵抗、T2DM、高脂血症、动脉粥样硬化(atherosclerosis,AS)、CVD等有关,因此,n-3 PUFA可能影响T2DM的发生发展及合并AS和CVD的风险。一项针对8项随机对照研究的meta分析表明,接受n-3PUFA补充剂(无论EPA还是DHA)的T2DM患者的CRP水平明显降低[26]。Bahreini等[27]的meta分析表明,补充n-3 PUFA或富含n-3 PUFA的食物干预均会增加T2DM患者中血清中脂联素的水平,亚组分析表明对脂联素的作用,干预时间≤8周者无影响,而干预时间>8周时,可以提高血脂联素水平。脂联素可以抑制肿瘤坏死因子的生成与释放,具有一定的抗炎症作用。这些发现支持了n-3 PUFA通过影响脂联素水平发挥对T2DM患者的有益作用。另外,n-3 PUFA通过升高脂联素水平,抑制促炎细胞因子和核因子-kB蛋白表达,进一步改善胰岛素代谢并减轻炎症水平,从而起到抗AS作用[28]。2019年,一项meta分析发现,n-3 PUFA可以降低糖尿病和CVD患者的炎性生物标志物,改善相关糖脂代谢相关指标[29]。但也有研究表明,在长期存在、控制良好的T2DM和AS患者中,使用高剂量的n-3PUFA(每天1 g的EPA和1 g的DHA,干预3个月)进行治疗没有改善凝血、代谢和炎症状态的作用。
事实上,n-3 PUFA作为膳食补充剂或保健食品在居民中的服用率在不断上升。尽管n-3 PUFA的抗炎作用在改善T2DM中的作用已经有一些人群研究报道,但仍需更大样本量和更长研究周期的研究,以提供更多的科学证据。
[1] Federation I D. IDF diabetes atlas[M]. 9th eds. Brussels, Belgium: International Diabetes Federation, 2019.
[2] Zhou M G, Astell-Burt T, Bi Y F, et al. Geographical variation in diabetes prevalence and detection in China: Multilevel spatial analysis of 98,058 adults[J]. Diabetes Care, 2015, 38(1):72-81.
[3] 国家卫生计生委疾病预防控制局. 中国居民营养与慢性病状况报告[M]. 北京: 人民卫生出版社, 2016.
[4] 武鸣, 周金意. 江苏省慢性病及其危险因素监测报告(2013)[M]. 南京: 南京师范大学出版社, 2013.
[5] 谢国祥, 郭宝福, 李小成, 等. 南京市城乡居民营养与健康状况监测报告[M]. 南京: 江苏凤凰科学技术出版社, 2019.
[6] Dal Canto E, Ceriello A, Ryden L, et al. Diabetes as a cardiovascular risk factor: An overview of global trends of macro and micro vascular complications[J]. Eur J Prev Cardiol, 2019, 26(S2):25-32.
[7] Tosi F, Sartori F, Guarini P, et al. Delta-5 and delta-6 desaturases: crucial enzymes in polyunsaturated fatty acid-related pathways with pleiotropic influences in health and disease[J]. Adv Exp Med Biol, 2014, 824:61- 81.
[8] Krmer H, Stevens J, Grimminger F, et al. Fish oil fatty acids and human platelets: Dose-dependent decrease in dienoic and increase in trienoic thromboxane generation [J]. Biochem Pharmacol, 1996, 52(8):1211-1217.
[9] Calder P C. Omega-3 fatty acids and inflammatory processes: from molecules to man[J]. Biochem Soc trans, 2017, 45(5):1105-1115.
[10] Huang Y S, Pereira S L, Leonard A E. Enzymes for transgenic biosynthesis of long-chain polyunsaturated fatty acids[J]. Biochimie, 2004, 86(11):793-798.
[11] Nanri A, Mizoue T, Noda M, et al. Fish intake and type 2 diabetes in Japanese men and women: the Japan Public Health Center-based Prospective Study[J]. Am J Clin Nutr, 2011, 94(3):884-891.
[12] Brostow D P, Odegaard A O, Koh W P, et al. Omega-3 fatty acids and incident type 2 diabetes: The Singapore Chinese Health Study[J]. Am J Clin Nutr, 2011, 94(2): 520-526.
[13] Villegas R, Xiang Y B, Elasy T, et al. Fish, shellfish, and long-chain n-3 fatty acid consumption and risk of incident type 2 diabetes in middle-aged Chinese men and women[J]. Am J Clin Nutr, 2011, 94(2):543-551.
[14] Zhang Y, Zhuang P, Mao L, et al. Current level of fish and omega-3 fatty acid intakes and risk of type 2 diabetes in China[J/OL]. Journal of Nutritional Biochemistry. 2019, 74:108249 (2019-12) [2020-04-12]. https://www. sciencedirect.com/science/article/abs/pii/S0955286319301251. DOI:10.1016/j.jnutbio.2019.108249.
[15] 王炎炎, 王锋, 杨贤, 等. 深海鱼油对2型糖尿病老年患者糖脂代谢影响:一项双盲随机对照研究[J]. 营养学报, 2017, 39(2):127-133.
[16] 王锋, 柳和春, 刘小松, 等. 不同来源ω-3多不饱和脂肪酸对2型糖尿病合并血脂异常人群糖脂代谢的影响[J]. 中华预防医学杂志, 2019, 53(6):570-575.
[17] Chen C, Yang Y, Yu X, et al. Association between omega-3 fatty acids consumption and the risk of type 2 diabetes: A meta-analysis of cohort studies[J]. J Diabetes Invest, 2016, 8(4):480-488.
[18] Zheng J S, Huang T, Yang J, et al. Marine N-3 poly- unsaturated fatty acids are inversely associated with risk of type 2 diabetes in Asians: a systematic review and meta- analysis[J/OL]. PloS One, 2012, 7(9):e44525 (2012-09- 11). [2020-04-12]. https://www.ncbi.nlm.nih.gov/pmc/ar ticles/PMC3439396/. DOI:10.1371/journal.pone.0044525.
[19] Calder P C. Marine omega-3 fatty acids and inflame- matory processes: Effects, mechanisms and clinical relevance[J]. Biochim Biophys Acta. 2015, 1851(4): 469-484.
[20] Novak T E, Babcock T A, Jho D H, et al. NF-kappa B inhibition by omega -3 fatty acids modulates LPS- stimulated macrophage TNF-alpha transcription[J]. Am J Physiol Lung Cell Mol Physiol, 2003, 284(1):L84-89.
[21] Calder P C. Omega-3 fatty acids and inflammatory processes. Nutrients, 2010, 2(3):355-374.
[22] Serhan C N, Clish C B, Brannon J, et al. Anti-microinflammatory lipid signals generated from dietary-3 fatty acids via cyclooxygenase-2 and transcellular processing: a novel mechanism for NSAID and n-3 PUFA therapeutic actions[J]. J Physiol Pharmacol, 2000, 51(4 Pt 1):643-654.
[23] Hong S, Lu Y. Omega-3 fatty acid-derived resolvins and protectins in inflammation resolution and leukocyte functions: Targeting novel lipid mediator pathways in mitigation of acute kidney injury[J/OL]. Front Immunol, 2013, 4:13 (2013-01-30) [2020-04-12]. https://static. pubmed.gov/portal/portal3rc.fcgi/4190210/img/3977009. DOI:10.3389/fimmu.2013.00013.
[24] Serhan C N, Hong S, Gronert K, et al. Resolvins: A family of bioactive products of omega-3 fatty acid transformation circuits initiated by aspirin treatment that counter proinflammation signals[J]. J Exp Med, 2002, 196(8):1025-1037.
[25] Serhan C N. Pro-resolving lipid mediators are leads for resolution physiology[J]. Nature, 2014, 510(7503):92- 101.
[26] Lin N, Shi J J, Li Y M, et al. What is the impact of n-3 PUFAs on inflammation markers in type 2 diabetic mellitus populations?: A systematic review and meta-analysis of randomized controlled trials[J/OL]. Lipids Health Dis, 2016, 15:133 (2016-08-20) [2020-04- 12]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC499 2564/pdf/12944_2016_Article_303.pdf. DOI:10.1186/s1 2944-016-0303-7.
[27] Bahreini M, Ramezani A H, Shishehbor F, et al. The effect of omega-3 on circulating adiponectin in adults with type 2 diabetes mellitus: A systematic review and meta-analysis of randomized controlled trials[J]. Can J Diabetes, 2018, 42(5):553-559.
[28] Farimani A R, Hariri M, Azimi-Nezhad M, et al. The effect of n-3 PUFAs on circulating adiponectin and leptin in patients with type 2 diabetes mellitus: A systematic review and meta-analysis of randomized controlled trials[J]. Acta Diabetol, 2018, 55(7):641-652.
[29] Natto Z S, Yaghmoor W, Alshaeri H K, et al. Omega-3 fatty acids effects on inflammatory biomarkers and lipid profiles among diabetic and cardiovascular disease patients: A systematic review and meta-analysis[J/OL]. Sci Rep-UK, 2019, 9(1):18867 (2019-12-11) [2020-04- 15]. https://www.nature.com/articles/s41598-019-54535- x.pdf. DOI:10.1038/s41598-019-54535-x
Anti-inflammatory Effect of N-3 Polyunsaturated Fatty Acids and Type 2 Diabetes Mellitus
Many studies have shown that N-3 polyunsaturated fatty acids (n-3PUFA) have anti-inflammatory effects and are also related to the occurrence and development of type 2 diabetes mellitus (T2DM). In this paper, the role of n-3PUFA in improving T2DM through anti-inflammatory effect is described, which provides scientific basis for the application of n-3PUFA in the prevention and treatment of T2DM.
N-3 polyunsaturated fatty acids; Inflammatory factors; Type 2 diabetes mellitus
10.16117/j.cnki.31-1974/r.202002002
国家自然基金面上项目(81872618)。
孙桂菊(1963—),女,山东淄博人,博士,教授,主要研究方向为营养与慢性病,gjsun@seu.edu.cn。
2020-04-19。

