连翘酯苷A对感染H9N2型禽流感小鼠Toll样受体4信号通路影响的研究
盛 楠,鲁冠杰,付 岳,田学琳,胡 格
(北京农学院动物科学技术学院/兽医学(中医药)北京市重点实验室,北京102206)
禽流感病毒(Avian influenza virus,AIV)根据其毒力分为A、B、C三型,属于正黏病毒家族中的包膜病毒[1]。可通过抗原漂移和抗原转移引起疾病和大流行。不同的血红凝集素(Hemagglutinin,HA)及神经氨酸酶(Neuraminidase,NA)组成不同的亚型,如H5N1、H7N9、H3N2、H9N2等[2]。其中H9N2型禽流感病毒(H9N2 Avian influenza virus,H9N2-AIV)流行最为广泛,也威胁人类健康。
禽流感病毒侵入机体后,在宿主细胞内复制繁殖对宿主的正常生理代谢功能造成损害,严重则引起细胞死亡,病毒感染期间Toll样受体4(Toll-like receptor 4,TLR4)信号通路触发细胞内核因子-κB(Nuclear factor kappa-B,NF-κB)信号传导途径的活化,并上调许多产生炎性介质的基因。在长期的互相影响过程中,机体逐步形成一段复杂的抗病毒网络。感染治疗期间,神经系统和胃肠系统易产生相关副作用,限制许多药物的使用,造成抗病毒的药物相对较少。天然草药具有低毒性、作用范围广等优点,体现出对呼吸道病毒有很好的抑制作用。连翘酯苷A(forsythoside A,FSA)是从连翘的风干果中分离得到的苯乙醇糖苷产品,为连翘的主要有效成分之一,具有体外抗菌,抗氧化和抗炎等活性[3],且对神经具有一定保护作用[4],已被用于多种病毒性疾病的治疗并取得一定疗效,但限制病毒复制及其他具体作用机制尚有待进一步证实。
本研究采用H9N2型禽流感病毒建立小鼠急性肺损伤模型,连翘酯苷A分组治疗,通过对其肺系数、体质量、组织病理变化、炎性因子水平及TLR4相关蛋白等指标,探讨连翘酯苷A对H9N2型禽流感病毒感染小鼠的影响,为连翘酯苷A抗病毒作用机制的研究提供参考。
1 材料与方法
1.1 材 料
H9N2型禽流感病毒通过鸡胚繁殖获取感染性尿囊液,测定血凝效价后-80 ℃冰箱保存;42~56日龄SPF级Balb/c小鼠,体质量18~20 g,购自北京兴隆动物养殖厂;小鼠白细胞介素6(IL-6)检测试剂盒购自mlbio酶联生物公司;石蜡切片机(LEICA公司);生物组织包埋机(LEICA公司);免疫印迹试验(Western Blot)所用MyD88抗体、NF-κB p65抗体、P-NF-κB p65抗体均购自Cell Signaling Technology生物公司;荧光素标记山羊抗兔二抗、荧光素标记山羊抗小鼠二抗均购自碧云天生物公司。
1.2 方 法
1.2.1 病毒的制备 按照国家sop操作规程步骤,进行病毒的制备。从-80 ℃冰箱取出病毒,将病毒按100 μL/只注入鸡胚尿囊腔。37 ℃温箱培养鸡胚2~3 d。收获鸡胚前1 d置于4 ℃冰箱过夜。无菌移液枪吸取尿囊液置于收集管中,收获的鸡胚尿囊液3 000 r/min离心15 min去除血液和细胞后,根据Reed-Muench方法对病毒滴度进行计算,测定血凝效价为10-9,分装冻存于-80 ℃冰箱备用。
1.2.2 小鼠半数致死量(LD50)测定 35只Balb/c小鼠,随机分成7组,用灭菌生理盐水将病毒液10倍稀释得到100、10-1、10-2、10-3、10-4、10-5的6个梯度,每个稀释度分别滴鼻接种一组小鼠(100 μL/只)。对照组滴鼻接种100 μL 的灭菌生理盐水。接种后各组小鼠隔离饲养,防止交叉感染连续观察14 d,记录各组小鼠的发病死亡情况,按照Reed-Muench法计算LD50。
1.2.3 动物模型的建立 60只Balb/c小鼠随机分成对照组及模型组,每组小鼠30只逐一记录初始体质量。对照组每只小鼠鼻腔接种100 μL无病毒感染的正常鸡胚尿囊液,模型组接种100 μL测定后的病毒鸡胚尿囊液,从两组小鼠各随机取出15只单独饲养,每天称量体质量观察采食量变化及临床表现,统计死亡率绘制生存曲线,其余小鼠在3、5、7 d分别取3只小鼠称量体质量后处死,取肺部组织观察并进行肺水肿评估检测。各组小鼠均保持自由饮食及饮水,分离饲养防止交叉感染,连续观察14 d称量体质量后全部处死取肺组织检测备用。
1.2.4 试验动物的处理及分组 将120只小鼠随机分成5组,分别为对照组、模型组、低剂量组、中剂量组和高剂量组。对照组小鼠滴鼻接种无病毒感染的正常鸡胚尿囊液(100 μL/只);稀释病毒尿囊到LD50浓度,滴鼻接种其余各组小鼠(100 μL/只);低剂量组、中剂量组、高剂量组给予连翘酯苷A,剂量分别20、40、80 mg/kg,连续7 d。自由饮食及饮水,分离饲养防止交叉感染,每天检测体质量变化。
1.2.5 小鼠的肺水肿评估 小鼠感染后在3、5、7、14 d每组分别取3只小鼠称量体质量后处死,用剪刀镊子小心剖开胸腔,取出肺脏,在无菌生理盐水中漂洗去血液后用滤纸吸干水分,称量肺质量及右侧肺叶质量,将右肺置于37 ℃恒温干燥箱中干燥,直到质量不再变化,记录数值。按肺湿质量(mg)/肺干质量(mg)计算肺湿干质量比,按肺湿质量(mg)/体质量(g)计算肺系数,衡量肺水肿程度。
1.2.6 肺脏组织切片的制作及观察 小鼠感染后在3、5、7、14 d每组分别取3只小鼠称量体质量后处死,取左侧一半肺叶于组织包埋盒置于4%多聚甲醛中固定,另一半肺组织经液氮速冻后置于-80 ℃冰箱备用。固定后的组织按照脱水、透明、浸蜡、包埋、石蜡切片、染色制作病理切片显微镜观察并拍照。
1.2.7 细胞因子检测 小鼠感染后在3、5、7、14 d每组分别取3只小鼠称量体质量后取血,离心取血清,按照小鼠IL-6试剂盒说明检测细胞因子。
1.2.8 组织总蛋白提取及蛋白定量 取出冻存的第5天肺组织剪碎成细小碎片,加入裂解液,玻璃匀浆器匀浆,直至充分裂解。离心取上清按照BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit,BCA)进行蛋白浓度测定。根据标准曲线计算样品蛋白浓度。调整样品浓度,加上样缓冲液水浴加热使蛋白变性。-80 ℃冰箱保存备用。
1.2.9 TLR4信号通路相关蛋白检测 提取蛋白进行电泳,按照配胶电泳、转膜、封闭、抗体孵育、超敏ECL化学发光试剂盒显色步骤进行,最后进行Western blot结果扫描。利用软件image J进行灰度分析,将得出的数值进行计算并用GraphPad 5分析作图。
1.3 统计分析
试验数据以均数±标准差表示,采用t检验分析比较各组数据,用#、*表示P<0.05,即差异显著;用 ##、**表示P<0.01,即差异极显著。
2 结果与分析
2.1 小鼠半数致死量(LD50)测定
对照组小鼠无明显病理变化,没有死亡;经14 d观察统计病毒感染后小鼠,随着病毒浓度降低死亡率下降。10-1时小鼠死亡率高于50%,10-2时死亡率低于50%,半数致死量应在10-1~10-2之间(表1),根据Reed-Much方法计算结果LD50为10-1.78/0.1 mL。
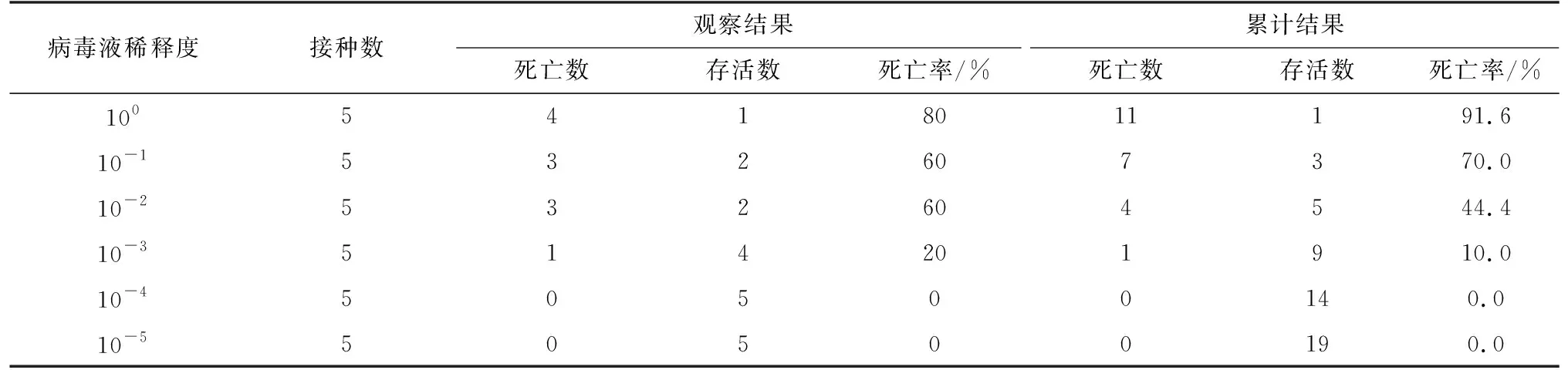
表1 H9N2感染小鼠LD50测定(只)Tab.1 Results of LD50 of H9N2 infected in mice(single)
2.2 小鼠造模后表现
2.2.1 小鼠各项指标变化 通过14 d的临床观察,对照组小鼠无明显病理变化,模型组小鼠表现出精神不振、弓背、站立不稳、被毛竖立,且可以听到明显的呼吸音,鼠笼中小鼠蜷缩聚集在一起,呈现畏寒扎堆的情况(图1-A)。剖检第7天的模型组小鼠,可见肺部充血、淤血、肿大,呈现深红色,肺叶有大面积坏死灶(图1-B)。模型组小鼠第2天起体质量开始下降(图1-C),整体病情逐渐加重,第3天开始出现死亡,5~7 d临床症状最为明显,死亡率最高(图1-D)。
2.2.2 小鼠肺水肿评估 模型组小鼠随时间增加,肺湿干质量比与肺系数逐渐增加,第7天肺湿干质量比最大损伤表现最为严重。与正常组相比,模型组小鼠3~7 d肺湿干质量比与肺系数均呈现极显著差异(P<0.01),7 d后病情逐渐好转,在观察期最后一天,与对照组相比,模型组小鼠肺湿干质量比及肺系数具有显著差异(P<0.05),见表2。

表2 肺湿质量/干质量与肺系数的变化(n=3)Tab.2 Lung W/D ratio and changes of lung coefficient in the mice(n=3)
注:与对照组相比,*表示P<0.05,**表示P<0.01。
Note:*P<0.05,**P<0.01vs.control group.
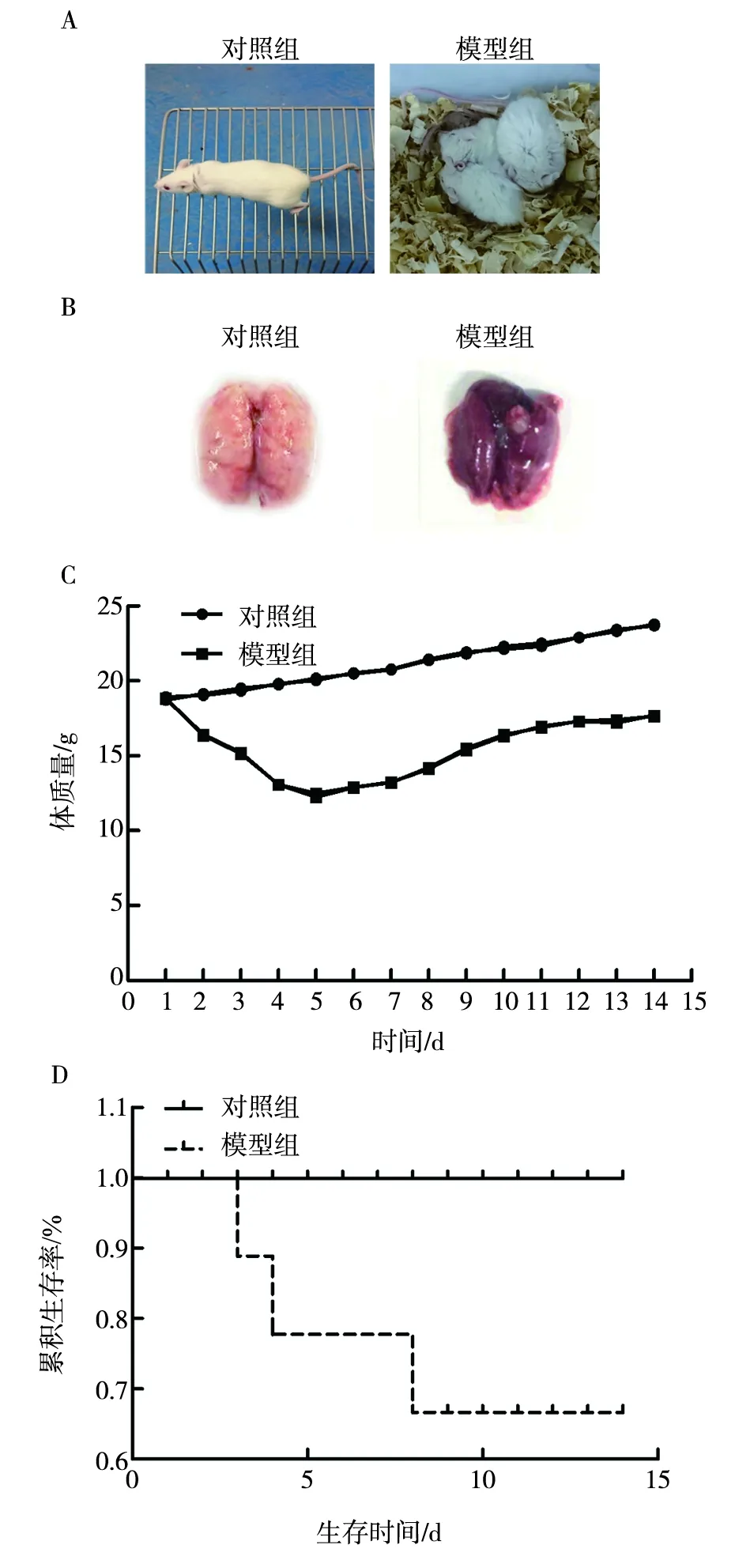
注:A 小鼠临床表现;B 小鼠肺组织解剖学观察;C 小鼠体质量变化;D 累积生存曲线。Note:A is clinical manifestation of mice; B is observation of lung tissue anatomy in mice; C is changes in body weight of mice; D is cumulative survival function curves.图1 小鼠各项指标变化Fig.1 Changes indicators of mice
2.3 连翘酯苷A对H9N2型禽流感病毒小鼠体征及小鼠体质量的影响
2.3.1 小鼠临床表现 对照组小鼠无特异体征变化;模型组小鼠被毛竖立,弓背,全身紧张,聚集蜷缩在鼠笼一角,行动迟缓,迅速消瘦且采食饮水量减少,与对照组有显著区别。与模型组相比中剂量组、高剂量组小鼠弓背程度减小,被毛竖立程度降低,行动及采食饮水均有明显改善(图2)。
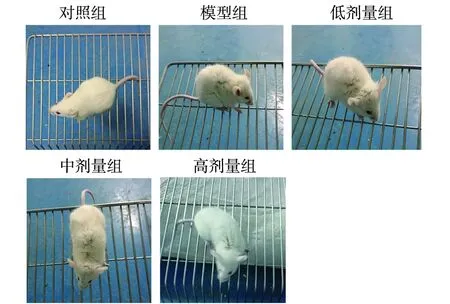
图2 小鼠临床表现Fig.2 Clinical manifestation of mice
2.3.2 小鼠体质量变化 试验过程中每天监测小鼠体质量,第2天开始,对照组小鼠体质量呈上升趋势,其余各组小鼠体质量均明显下降。与对照组相比,模型组小鼠体质量降低严重,在5~6 d急剧下降且达到最低峰。与模型组相比,低剂量组、中剂量组、高剂量组小鼠体质量下降率减小(图3)。

图3 H9N2-AIV感染小鼠后的体质量变化Fig.3 Weight change of H9N2-AIV infected mice
2.4 连翘酯苷A对H9N2型禽流感病毒小鼠病理组织学的影响
2.4.1 小鼠肺组织解剖学变化 由于5~7 d模型组小鼠病情发展最为严重,因此选择第5天进行病理剖检检测肺部病理变化(n=3)。对照组小鼠肺无明显病理变化,模型组小鼠肺部充血淤血,呈现深红色病灶。与对照组相比,低剂量组、中剂量组、高剂量组损伤区域减小,水肿及充血症状有所减轻,其中中剂量组、高剂量组与模型组有显著差别(图4)。
2.4.2 小鼠肺部病理学变化 为进一步探究其病理组织的变化,进行肺组织切片观察。与对照组相比,模型组小鼠肺泡细胞结构遭到破环,肺泡间质大量粒细胞聚集,淋巴细胞增多,肺泡间质多处充血淤血。与模型组相比,低剂量组、中剂量组、高剂量组肺泡间质炎性细胞渗出明显减少,肺组织损伤减轻,有明显改善(图5)。
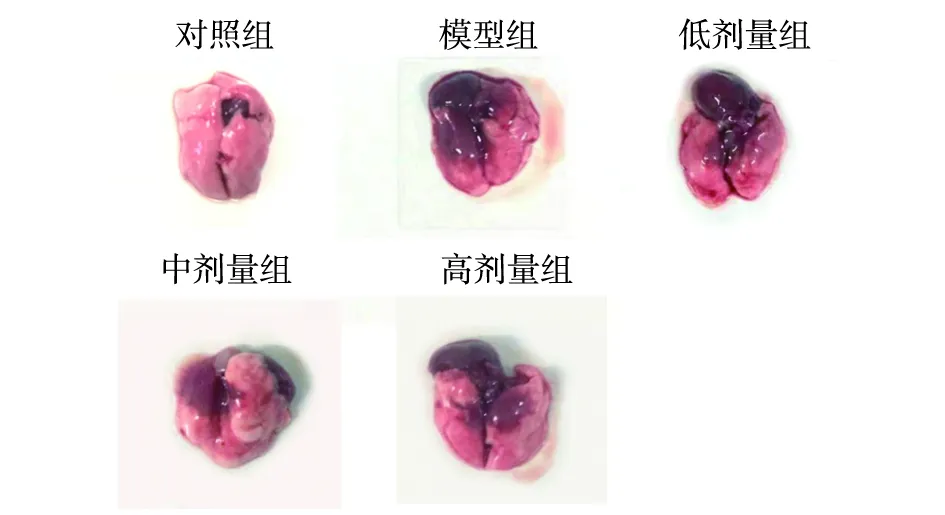
图4 小鼠肺组织解剖学观察Fig.4 Observation of lung tissue anatomy in mice
2.5 连翘酯苷A对H9N2型禽流感病毒小鼠肺水肿的影响
为探究连翘酯苷A对H9N2-AIV感染小鼠后肺水肿的影响,分别检测肺湿质量与干质量比及肺系数。对照组小鼠肺湿干质量比与肺系数均无明显变化;第5天与第7天模型组肺湿干质量比与肺系数逐渐增大且极显著高于其余4组(P<0.01),低剂量组、中剂量组、高剂量组均极显著低于模型组(P<0.01),治疗后第14天中剂量组、高剂量组逐渐恢复到正常水平(图6-A、图6-B)。
2.6 连翘酯苷A对H9N2型禽流感病毒小鼠炎症细胞的影响
采用ELISA方法检测小鼠血清中细胞因子IL-6的含量变化。与对照组相比,各组小鼠IL-6水平在5~7 d极显著升高(P<0.01);3~7 d模型组和低剂量组小鼠血清中IL-6表达极显著高于对照组(P<0.01);第5天及第7天中剂量组和高剂量组IL-6含量极显著低于模型组(P<0.01),第14天逐步恢复到正常水平(图7)。
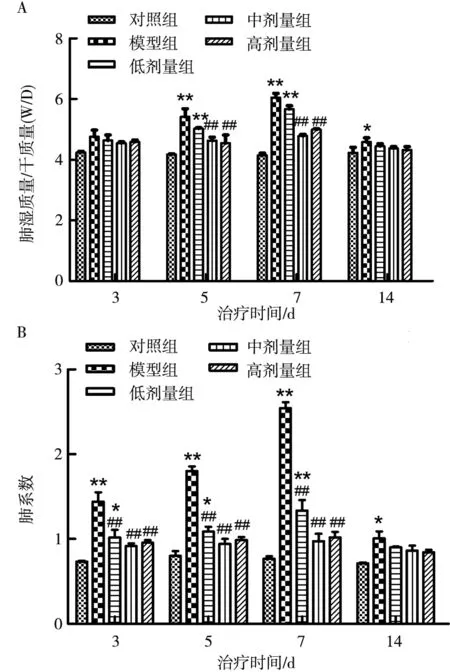
注:与对照组相比,*表示P<0.05,**表示P<0.01;与模型组相比#表示P<0.05,##表示P<0.01;A是小鼠肺湿质量与干质量比;B是小鼠肺系数变化。Note: *P<0.05,**P<0.01 vs.control group;#P<0.05,##P<0.01 vs.model group; A is Lung wet weight/dry weight(W/D) ratio of mice; B is Lung coeffcient of Mice.图6 小鼠肺水肿指标变化Fig.6 Changes of pulmonary edema index in mice

注:直箭头指示区域为大量炎性粒细胞聚集;环形箭头指示肺泡间质充血。Note:The straight arrow indicates that there is a large number of inflammatory granulocytes in the indicating area; the circular arrow indicates congestion in the alveolar stroma.图5 感染H9N2-AIV小鼠肺病理组织学变化Fig.5 The changes of lung histopathology of H9N2-AIV infected mice
2.7 连翘酯苷A对H9N2型禽流感病毒小鼠TLR4信号通路关键蛋白表达的影响
为了验证连翘酯苷A对TLR4信号通路的影响,利用Western Blot方法对第5天各组肺组织进行MyD88,NF-κBp65,P-NF-κB p65蛋白表达检测(图8)。模型组关键蛋白表达量极显著高于对照组(P<0.01),加入连翘酯苷A治疗后,呈现下调趋势,中剂量组与高剂量组均极显著低于模型组(P<0.01)。
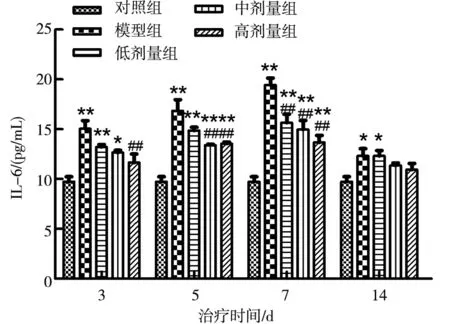
注:与对照组相比,*表示P<0.05,**表示P<0.01;与模型组相比#表示P<0.05,##表示P<0.01。Note:*P<0.05,**P<0.01 vs.control group;#P<0.05,##P<0.01 vs.model group.图7 连翘酯苷A对小鼠感染H9N2-AIV后IL-6的影响Fig.7 Effect of forsythoside A IL-6 in serum of mice infected with H9N2-AIV

注:与对照组相比,*表示P<0.05,**表示P<0.01;与模型组相比#表示P<0.05,##表示P<0.01。Note:*P<0.05,**P<0.01 vs.control group;#P<0.05,##P<0.01 vs.model group.图8 小鼠肺组织中TLR4, MyD88, NF-κB p65和p-NF-κB p65蛋白表达Fig.8 Expression of TLR4, MyD88, NF-κB p65 and p-NF-κB p65 protien in lung tissue of mice
3 讨 论
禽流感病毒对哺乳动物物种适应过程十分复杂,能够影响所有类型的鸟类,其具体作用机制目前尚不完全清楚[5]。采用H9N2-AIV侵入小鼠机体,引起动物产生急性肺损伤或其他严重的病理形式造成的急性肺损伤模型检测发病机制,可为人类急性肺损伤反应的关键步骤提供重要的试验依据[6]。本研究中模型组小鼠感染后疾病发展进程趋势及指标检测结果与早前研究建立模型[7]结果一致提示小鼠急性肺损伤模型成功建立。
禽流感病毒具有高度传染性,损伤呼吸系统造成人和动物高发病率和死亡率。TLR4是机体识别病原体的固有免疫受体,募集下游信号分子,活化核转录因子NF-κB,调控相关受体、酶等发挥免疫学效应[8]。在禽流感病毒感染期间,TLR4信号通路起着重要的调节作用。多项研究发现经病毒感染后可激活TLR4信号通路,活化NF-κB信号传导途径,上调相关炎性介质的基因,引起肺部IL-6、IL-10等细胞因子含量升高[9]。细胞因子是一种调节蛋白,具有调节免疫、抗病毒等多种生物学活性。复杂的细胞因子级联反应造成组织水肿、出血等症状[10-11],给动物体造成严重损伤甚至威胁生命,有效的治疗药物可以抑制细胞因子过表达,保护机体减轻免疫损伤。
近年广泛的试验研究显示中草药抗病毒有广阔前景,中药的研究分为单味药和复方药,与西药不同的是单味中药便可含有多种有效成分,抗病毒机理复杂[12-13]。中药的抗病毒机制研究具有非常重要的意义。连翘酯苷A是连翘中抗病毒的有效成分单体,具有较好的生物学活性及免疫调节作用[14-16],逐渐被应用于禽流感病毒及急性肺损伤的治疗。许多研究显示,连翘酯苷A可以通过介导多种炎症通路下调免疫因子,调控机体免疫反应,达到抗病毒作用[17-20]。本研究发现,连翘酯苷A可减轻小鼠肺组织的病理损伤,降低肺水肿程度及细胞因子IL-6的表达,缓解炎症损伤。提示连翘酯苷A可能通过炎症通路调控免疫应答,抑制IL-6表达量,减轻炎症反应。禽流感病毒能上调MyD88、NF-κB p65、P-NF-κB p65表达量,而低剂量组、中剂量组、高剂量组均能抑制其表达,且与IL-6炎症因子含量变化趋势一致,提示连翘酯苷A可能通过TLR4信号通路影响NF-κB p65激活,调控细胞因子水平从而达到抗损伤效果,起到维持机体内环境稳定的作用。
连翘酯苷A对低剂量组、中剂量组、高剂量组小鼠均起到治疗作用,降低禽流感病毒对小鼠造成的病理性损害。
连翘酯苷A可减轻禽流感所致的急性肺损伤,其主要作用机制可能是通过抑制MyD88、NF-κBp65、P-NF-κB p65信号通路,减轻炎症因子过度表达。其具体作用途径需进一步研究,为临床使用中药提供更完善的依据。

