伊豆锦葡萄皮花青素的树脂纯化及稳定性研究
生庆海,闫 斌,王 晔,2,刘 坤,贾艳菊
(1.河北经贸大学生物科学与工程学院,河北石家庄 050061;2.北京化工大学生命科学与技术学院,北京 100029)
花青素是一类常见的天然色素,主要存在于植物的果实、叶片和花中,使植物呈现不同颜色[1]。由于花青素不稳定,天然条件下花青素通常与糖形成花色苷。花色苷是黄酮类物质,是可以安全食用的植物色素[2]。可以作为食品添加剂、着色剂应用于食品,相对于合成色素,天然色素满足了人们对于食品安全的要求,近年来越来越受到人们的欢迎。
天然花色素的纯化一般以植物为原料,常见的有杨梅、越橘、火龙果、葡萄、红心萝卜等[3],但由于其含量较低且价格较高等原因,在我国只有较少的开发利用,不能满足市场的需求[4]。大孔树脂吸附法是目前纯化花色苷类物质最常用的方法,效果较好的大孔树脂有XAD-7HP,X-5,AB-8,NKA-9型等[5]。伊豆锦葡萄是景川彦雄于1970年杂交得到的葡萄品种,属于巨峰群品种,粒大饱满,呈紫黑色,微有草莓香味,皮厚肉脆[6]。伊豆锦葡萄皮含有大量的花青素,目前还没有关于其花青素提取及稳定性的研究。试验以伊豆锦葡萄皮为原料,研究其葡萄皮中花青素的纯化及稳定性,为伊豆锦葡萄资源的开发利用和天然花青素的获取、应用提供数据支撑。
1 材料与方法
1.1 材料与仪器
试验材料:伊豆锦葡萄,2016年9月购自紫藤葡萄庄园。剔除果肉的果皮,风干打成粉,过40目筛,干燥器中保藏,备用。
主要试剂:柠檬酸、柠檬酸钠、乙酸乙酯、没食子酸、福林酚等,均为国产分析纯;ADS-8,AB-8,HPD-100A,SP207型大孔树脂,天津尖峰天然产物研究公司提供。
主要仪器:R201型旋转蒸发器,上海申胜生物技术有限公司产品;UV-5200B型紫外分光光度计,上海光谱仪器有限公司产品;PHS-3C型数字显示酸度计,上海仪电科学仪器股份有限公司产品。
1.2 试验方法
1.2.1 伊豆锦葡萄皮色素色价的测定
参照邓洁红等人[7]的方法,稍作改变。配制酸性乙醇溶液(乙醇体积分数60%,pH值2.31),取4支离心管,每支离心管中加入0.5 g葡萄皮粉和20 mL提取液,浸提3 h后离心20 min,取上清液。一直提取至上清液无色,将所有上清液汇总过滤,最后一次的上清液和渣粉一起过滤定容,用浓度为0.1 mol/L的柠檬酸和浓度为0.1 mol/L的柠檬酸钠按一定的比例配成pH值为3的缓冲溶液,用分光光度计于波长500~700 nm内扫描,找到最大吸收峰。计算出色价。

式中:A——吸光度;
W——葡萄皮质量,g。
结果表明,尹豆锦花青素溶液于波长543 nm处有最大吸收峰,故选择543 nm作为测定波长,伊豆锦葡萄皮中色素的色价为6.7。
1.2.2 伊豆锦葡萄皮花青素的提取
称取50 g葡萄皮渣,加入酸性乙醇溶液(pH值2.31,60%乙醇),比例为1∶30,超声波辅助提取60 min,于40℃下抽滤,将粗提液在45℃下以转速100 r/min旋转蒸发,加入2倍体积的乙酸乙酯进行萃取,分层后取水相,萃取2次,于4℃下保存。
1.2.3 树脂的选择
准确称量已经活化好的 ADS-8,AB-8,HPD-100A,SP207型4种大孔吸附树脂各0.5 g,配制pH值2.47(含乙醇6.6%)的花青素溶液(C0),取15 mL,置于100 mL三角瓶中,于20℃下以转速100 r/min培养20 h。测溶液中花青素浓度(C1),计算吸附率。吸附完成后,蒸馏水洗脱,再分别加入15 mL酸性乙醇溶液(pH值2.47,80%乙醇,0.3%柠檬酸),25℃下解析20 h,测定解析液中花青素的质量浓度(C2),计算解析率。每组设置3组平行试验。

式中:C0——吸附前溶液中花青素质量浓度,mg/mL;
C1——吸附后溶液中花青素质量浓度,mg/mL;
C2——解析后溶液中花青素质量浓度,mg/mL。
1.2.4 伊豆锦葡萄皮花青素浓缩液的制备
选择最佳树脂进行活化,装柱,在上柱液pH值2.0,流速1 mL/min的条件下进行纯化,用酸性乙醇溶液(pH值2.47,80%乙醇,0.3%柠檬酸)进行解析,得到浓缩溶液。
1.2.5 伊豆锦葡萄皮花青素稳定性分析
(1) 光照对稳定性的影响。取一定量浓缩溶液,稀释到一定色价,分别取10 mL置于透明玻璃样品瓶中,封口,分别置于黑暗、自然光、日光灯下的环境中,每2 d取样测定样品溶液中花青素含量,以保存率表示原花青素稳定性,计算公式为:

式中:W1——检测时样品中花青素含量,%;
W2——初始样品中原花青素含量,%。
(2)温度对稳定性的影响。取一定量浓缩溶液,稀释到一定色价,分别取10 mL置于透明玻璃样品瓶中,封口,分别位于4℃,室温,40,60,80℃下进行保存,每隔1 h测1次吸光度,其他步骤同1.2.5(1)。
(3)pH值对稳定性的影响。取一定量的花青素浓缩液,稀释成pH值为2.2,3.0,4.0,5.0,6.0,7.0,8.0的溶液,观察颜色变化,测定吸光度。
(4)金属离子对稳定性的影响。取一定量浓缩溶液,稀释到一定色价,分别取10 mL置于透明玻璃样品瓶中,分别加入 K+,Na+,Ca2+,Fe2+,Fe3+,Al3+,使溶液中各类离子的浓度分别达到1 mmol/L和10mmol/L,每1h测1次吸光度,其他步骤同1.2.5(1)。
(5)氧化剂对稳定性的影响。配制质量分数为0.05%,1.00%,2.00%,3.00%的H2O2溶液,依次取5 mL的花青素溶液,分别用不同浓度的H2O2溶液定容,分别在0,1,2,3,4,5 h后测定其于波长543 nm处的吸光度,其他步骤同1.2.5(1)。
(6)还原剂对稳定性的影响。配制质量浓度分别为0.04,0.08,0.16,0.32 g/L的维C溶液,依次吸取5 mL伊豆锦葡萄皮色素液,分别用不同浓度的维C溶液定容,分别在0,1,2,3,4,5 h后测定其于波长543 nm处的吸光度,其他步骤同1.2.5(1)。
2 结果与分析
2.1 大孔树脂的选择结果
树脂的静态吸附(A) 和解析(B) 见图1。
由图1可以看出,型号不同的大孔树脂对伊豆锦葡萄皮花青素的吸附、解析效果存在一定差异。其中,ADS-8,AB-8,HPD-100A和SP207型树脂对花青素的吸附率分别为86.70%,90.16%,87.34%,91.35%,AB-8和SP207型树脂好于ADS-8和HPD-100A型树脂 , 且显 著 性 差 异 (p<0.05); ADS-8, AB-8,HPD-100A和SP207型的解析率分别为65.42%,62.48%,67.37%,79.47%,SP207型的解析率最高且与其他3种树脂差异显著(p<0.05)。结合两图比较可知SP207型树脂吸附和解析效果最好,SP207型树脂是最合适的树脂。

图1 树脂的静态吸附(A) 和解析(B)
2.2 伊豆锦葡萄皮花青素稳定性研究
2.2.1 光照对花青素稳定性的影响
光照对稳定性的影响见图2。
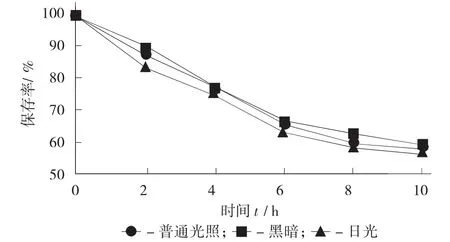
图2 光照对稳定性的影响
由图2可以看出,在前6 d保存率下降的比较明显,后4 d较为平缓,保存时间越长,稳定性越低。2 d后,普通光照、日光的花青素保存率分别为90%,87%,83%,且差异显著(p<0.05)。说明色素对于光照敏感、耐光性不好。光照会使花青素生成一种中间代谢产物,C4羟基会进一步转变成2,4,6-三羟基苯甲酸等产物,促使花青素降解,因此在花青素溶液保存时要注意避光保存[8]。
2.2.2 温度对花青素稳定性的影响
温度对花青素保存率的影响见图3。

图3 温度对花青素保存率的影响
由图3可以看出,反应5 h后,在4℃,室温,40,60,80℃的保存率分别为83.4%,74.4%,74.1%,65.0%,52.5%。根据数据可知,温度对花青素影响很大,花青素的保存率会随着温度的升高而降低,这是因为当温度升高时,花青素溶液的平衡会朝着生成无色查尔酮的方向进行,从而导致花青素的降解和褪色[9],因此花青素保存时应该避免高温。
2.2.3 pH值对花青素稳定性的影响
pH值对花青素保存率的影响见图4。

图4 pH值对花青素保存率的影响
由图4可以看出,pH值不同,花青素的保存率也不同。在pH值2~3内,吸光度值较大。在不同酸碱条件下,溶液颜色也会显现出明显差别,当溶液是碱性的时候呈现蓝色,在中性的时候呈现紫色,在酸性溶液中呈现红色。据文献记录,当pH值小于2时,花青素主要是以红色的2-苯基苯并吡喃阳离子存在,当pH值小于8时,主要是以无色的甲醇假碱或查尔酮存在,当pH值大于8时主要是以蓝色的离子化醌式碱的形式存在[10]。
2.2.4 金属离子对花青素稳定性的影响
金属离子对花青素保存率的影响见图5。
由图5可以看出,10 mmol/L的钾离子对花青素的稳定性影响不大,5 h后保存率依然为86%;1 mmol/L的钾离子、钙离子和钠离子对花青素的稳定性均有一定影响,反应5 h后保存率依然在60%以上。三价铁离子和二价铁离子对花青素的稳定性有明显的破坏作用,随着时间的延长,花青素的保存率明显下降,且浓度高的保存率更低。铝离子则有明显的增色效应,1 mmol/L和10 mmol/L的铝离子均增强了花青素溶液的保存率,而且10 mmol/L的保存率略高于1 mmol/L。

图5 金属离子对花青素保存率的影响
2.2.5 氧化剂对花青素稳定性的影响
H2O2对花青素保存率的影响见图6。

图6 H2O2对花青素保存率的影响
由图6可以看出,H2O2对葡萄皮花青素的稳定性有很大的影响,加入过氧化氢的花青素溶液的保存率均低于对照组,反应2 h后H2O2质量分数为0.5%,1.0%,2.0%,3.0%时,花青素溶液的保存率分别为86%,85%,83%,83%,随着质量分数的增大,保存率在下降。反应5 h后保存率分别为71%,70%,69%,61%。由此可见,H2O2会使花青素的保存率快速下降。可能是由于H2O2可直接亲核进攻花青素的C位,使花青素开环生成查尔酮,查尔酮进一步降解生成各种无色的酯类物质[8]。
2.2.6 还原剂对花青素稳定性的影响
维C对花青素保存率的影响见图7。

图7 维C对花青素保存率的影响
由图7可以看出,维C加速花青素的降解,使花青素保存率降低,对花青素稳定性有一定的影响。1 h后维C质量浓度为0.04,0.08,0.16,0.32 g/L时花青素溶液的保存率分别为87%,86%,88%,87%;5 h后维C质量浓度为0.04,0.08,0.16,0.32 g/L时,花青素溶液的保存率分别为67%,64%,63%,52%,随着质量浓度的增大,花青素溶液的保存率下降,且加入抗坏血酸后花青素的保存率均低于对照组,可见抗坏血酸对花青素有一定的影响。
3 结论
伊豆锦葡萄皮花青素溶液最大吸收峰为波长543 nm处,伊豆锦葡萄皮中色素的色价为6.7。大孔树脂SP207对伊豆锦葡萄皮中的花青素具有良好的吸附和解析性能,纯化效果非常理想。伊豆锦葡萄皮花青素溶液在不同pH值下颜色有所不同,pH值在2.2~3.0时花青素水溶液为红色,pH值4.0时为淡黄白色,pH值5.0时为黄色,pH值6.0时为红紫色,pH值7.0~8.0时为暗兰紫色。高温、光照、氧化剂和还原剂都会破坏花青素的稳定性。Fe3+,Fe2+使其保存率明显降低,10 mmol/L的钾离子对花青素的稳定性影响不大,1 mmol/L的钾离子、钙离子和钠离子对花青素的稳定性均有一定影响,Al3+对花青素稳定性有增强作用。避光、低温、低pH值,加入Al3+均有利于提高花青素的稳定性。

