鸡传染性法氏囊病病毒VP2蛋白在昆虫细胞-杆状病毒表达系统中的分泌表达及免疫原性分析
洪家兵 , 王 萍 , 王晓玥 , 于非可 , 刘文晓 , 李永清
[1.江西农业大学动物科学技术学院 , 江西 南昌 330045 ; 2.北京市农林科学院畜牧兽医研究所 畜禽疫病防控技术北京市重点实验室 , 北京 海淀 100097 ; 3. 北京农学院 兽医学(中医药)北京市重点实验室 , 北京 昌平 102206]
鸡传染性法氏囊病(Infectious bursal disease,IBD)是由鸡传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的一种急性、高度接触性的免疫抑制性疾病[1-2]。IBDV主要感染3周龄左右的幼鸡,病鸡通常表现出精神沉郁、下痢、共济失调等临床症状[3]。自1962年美国首次报道该病以来,IBD不断在世界范围内蔓延,给我国乃至全世界的养禽业带来了巨大的经济损失[4]。
IBDV对许多消毒剂具有很强的抵抗力,很难从受污染的家禽场所中清除,疫苗接种仍是防治IBD的唯一可行选择。现阶段传统经典毒株的减毒活疫苗和灭活疫苗仍是防治IBDV应用最广泛的疫苗[5-6],但是鉴于IBDV易变异、毒力返强的特点,传统疫苗已不能对IBDV产生有效保护作用。作为一类新型疫苗,亚单位疫苗具有安全性高、纯度高和稳定性好等优点,现已成为研究的热点。
IBDV是双链RNA病毒科的一类直径约为70 nm 的非囊膜病毒,其基因组由2个大小不等的片段组成,A片段主要编码VP2、VP3、VP4和VP5蛋白,B片段编码具有RNA聚合酶活性的VP1蛋白[7-8]。作为IBDV的主要结构蛋白,VP2蛋白主要存在于病毒的核衣壳外表面,携带了病毒主要的中和性抗原表位,可诱导产生中和抗体,是开发鸡IBD基因工程亚单位疫苗的首选蛋白[9-11]。本试验利用Bac-to-Bac昆虫表达系统高效、稳定的分泌表达了IBDV VP2蛋白,为IBDV诊断试剂盒和基因工程亚单位疫苗的研究提供了有力工具。
1 材料与方法
1.1 材料 卡那霉素、X-Gal、氨苄青霉素、无内毒素质粒小提中量试剂盒,均购自天根生化科技(北京)有限公司;庆大霉素、四环素,均购自北京索莱宝科技有限公司;DNA胶回收试剂盒,购自OMEGA公司;FITC标记的山羊抗鼠IgG、HRP标记的山羊抗鼠IgG、DAPI、IPTG,均购自Sigma公司;HF502C昆虫细胞无血清培养基,购自苏州市沃美生物技术有限公司。
1.2 序列优化及引物合成 从GenBank中下载已公布的鸡IBDVVP2基因序列(登录号KU530208.1),根据昆虫细胞-杆状病毒表达系统的密码子偏好性对其进行密码子优化。在VP2序列的N端添加蜂毒肽[12]序列,C端添加6×His序列,优化后的序列由生工生物工程(上海)股份有限公司合成。
根据杆状病毒表达载体的核苷酸序列及优化后的IBDVVP2基因,设计了1对同源臂扩增引物,在上下游引物分别添加酶切位点XhoI和NdeⅠ,由北京擎科生物科技有限公司合成。引物序列信息见表1。
1.3 杆状病毒转移载体的构建与鉴定 以密码子优化的VP2基因序列为模板,利用引物IBD029和IBD030进行PCR扩增,反应体系:10 μL 5×Prime-STAR Buffer (Mg2+Plus),4 μL dNTP Mix,0.5 μL Prime STAR HS DNA Polymerase,1 μL IBD029,1 μL IBD030,1 μL模板和32.5 μL ddH2O;反应条件:94 ℃ 变性2 min,98 ℃变性10 s,56 ℃退火15 s,72 ℃延伸90 s,总延伸10 min。通过琼脂糖凝胶电泳检测PCR结果,回收PCR产物。利用限制性内切酶XhoI和NdeI处理pFast BacTM1,利用诺唯赞同源臂连接试剂盒将含有同源臂的VP2序列定向克隆到线性化的pFast BacTM1载体上,连接体系:0.65 μL线性化载体,3 μL插入片段,4 μL 5×CE Ⅱ Buffer,2 μL Exnase Ⅱ,10.35 μL ddH2O。将连接产物转化感受态细胞DH5α,次日挑取阳性克隆,送北京擎科生物科技有限公司测序。
1.4 重组穿梭质粒的构建及鉴定 将构建成功的pFast-VP2转移载体转化新鲜制备的DH10BAC感受态细胞,在SOC培养基中37 ℃震荡培养4 h。取100 μL菌液均匀涂布在含卡那霉素、庆大霉素、四环素、IPTG和X-Gal的LB固体培养基上,37 ℃培养24 h。挑取单个白色菌落,利用特异性引物和PUC/M13通用引物进行PCR鉴定,获得重组杆粒rBac-VP2。扩大培养后,提取重组杆粒。
1.5 重组杆状病毒的拯救与传代 利用Invitrogen公司的ExpiFectamine Sf Transfection Reagent转染试剂盒将重组穿梭质粒转染至昆虫细胞SF9,28 ℃培养。每天观察细胞状态,待第4天细胞出现明显病变时,收集细胞培养上清为P0代杆状病毒。将P0代杆状病毒接种昆虫细胞SF9,盲传至P3代,鉴定重组杆状病毒。
1.6 VP2蛋白在SF9细胞中的表达及鉴定
1.6.1 PCR鉴定 提取P2代重组杆状病毒基因组,利用特异性引物和M13通用引物采用1.3中的反应体系和程序进行PCR鉴定。
1.6.2 间接免疫荧光(IFA)鉴定 将P2代毒接种于6孔板,感染生长良好的SF9细胞,27 ℃避光培养72 h。当细胞病变达到70%左右时,参考文献[13]的方法进行IFA鉴定,6×His单抗(1∶500倍稀释)为一抗、FITC标记的山羊抗鼠IgG(1∶10 000倍稀释)为二抗。
1.6.3 Western Blot鉴定 将P2代重组杆状病毒接种于透气的T175细胞培养瓶,感染处于对数生长期的SF9细胞,待细胞病变达到70%左右时,将细胞悉数吹下,3 000 r/min离心6 min,分别收集细胞培养上清和细胞沉淀。按照常规Western Blot操作步骤进行试验,6×His单抗(1∶5 000倍稀释)为一抗、HRP标记的山羊抗鼠IgG(1∶10 000倍稀释)为二抗。
1.7 VP2蛋白的表达条件优化与纯化 将P3代毒接种三角摇瓶,感染处于对数生长期的High Five细胞,分别于48、60、72、84 h和96 h取1 mL细胞培养液,离心分别收集细胞培养上清进行Western Blot鉴定,以确定VP2蛋白的最佳表达条件。扩大培养,收集感染病毒的细胞培养液,用His纯化柱纯化目的蛋白。
1.8 VP2蛋白反应原性研究 将P3代重组杆状病毒接种100 mL High Five细胞,培养72 h。12 000 r/min 离心10 min,分别收集细胞沉淀和细胞上清。细胞沉淀经PBS重悬后,超声裂解,离心收集上清。参照文献[14]的方法进行琼脂扩散试验,检测重组VP2蛋白与IBDV阳性血清的反应原性。
2 结果
2.1VP2基因的PCR扩增 利用设计的同源臂引物PCR扩增IBDVVP2基因,以1%琼脂糖凝胶电泳检测,获得了大小约为1 470 bp的扩增产物,与预期结果相符,见图1。

图1 VP2基因片段PCR扩增
2.2 重组穿梭质粒rBac-VP2的PCR鉴定 以M13通用引物和VP2特异性引物对重组穿梭质粒rBac-VP2进行PCR鉴定。如图2所示,特异性引物扩增得到大小约为1 470 bp的目的条带,M13通用引物扩增得到大小约为3 770 bp的条带,均与目的大小相符,表明重组杆状病毒质粒Bacmid-VP2构建成功。
2.3 重组杆状病毒的PCR鉴定 提取P2代重组杆状病毒基因组,用VP2特异性引物进行检测,在1 470 bp 左右出现特异性条带(如图3所示),说明VP2基因与杆状病毒发生同源重组并成功感染了SF9细胞。

图3 PCR鉴定VP2-Bac重组杆状病毒
2.4 VP2蛋白的IFA鉴定 结果如中插彩版图4所示,未感染重组杆状病毒的SF9细胞无荧光,感染重组杆状病毒的SF9细胞能检测到明亮的绿色荧光。说明重组VP2蛋白在SF9细胞中成功表达。
2.5 VP2蛋白的Western Blot鉴定 结果如图5所示,细胞培养上清和细胞沉淀中均可出现特异性条带。再次说明重组VP2蛋白在SF9细胞中成功表达,并且可分泌到细胞培养上清中。

图5 表达产物的Western Blot鉴定
2.6 VP2蛋白的纯化 参照预表达结果,在大量表达VP2蛋白时选择在接毒72 h后收获细胞上清。经离心抽滤后,4 ℃条件下用蠕动泵挂镍柱。然后用梯度浓度的咪唑(20、50 mmol/L和400 mmol/L)纯化并洗脱VP2蛋白,各洗脱峰进行SDS-PAGE鉴定。结果如图6所示,VP2蛋白挂镍柱后50 mmol/L咪唑洗脱峰可见较大量的目的蛋白。
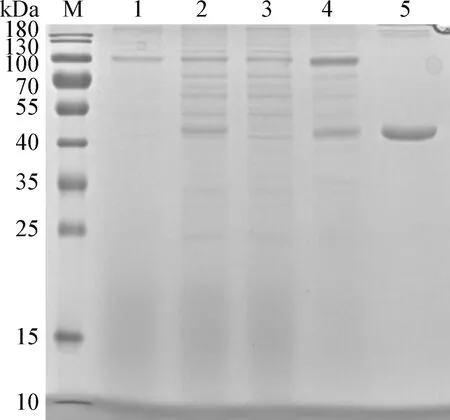
图6 VP2蛋白SDS-PAGE分析
2.7 重组VP2蛋白的反应原性 以IBDV阳性血清作为中间孔,细胞培养上清和细胞沉淀超声上清依次倍比稀释后添加至周围孔。加样扩散24 h后,可见1∶8细胞培养上清稀释孔仍可出现蛋白沉淀线,说明本试验构建的重组杆状病毒可以作为IBDV亚单位疫苗的候选株。见中插彩版图7。
3 讨论
1962年,IBDV首次在美国被发现,随后传播到全球每一个养禽的国家。我国学者周蛟1982年首次分离得到IBDV[15],现今IBDV已在我国广泛流行,给养禽业带来了巨大的经济损失。由于尚未出现IBD的特效药,疫苗免疫仍然是防治IBDV的有效手段。目前市场上应用最多的还是经典毒株的减毒活疫苗和灭活疫苗,在一定程度上能降低IBDV的感染。但是变异株和超强毒株的出现加大了防控难度,因此亚单位疫苗成为了研究中关注的新方向。作为IBDV的主要结构蛋白,VP2蛋白主要存在于病毒的核衣壳外表面,携带了病毒主要的中和性抗原表位,可诱导中和抗体的产生,是开发鸡IBDV亚单位疫苗的首选蛋白。目前,重组VP2蛋白已在不同的外源表达系统中得以表达,但是蛋白不能正确可溶性表达、表达量低仍旧是一大难题。
Bac-to-Bac杆状病毒表达系统对表达产物具有良好的翻译后修饰作用,能使所表达的蛋白接近于天然蛋白的结构和活性。目前,该系统已成为外源重组蛋白表达的有力工具。本试验先根据昆虫细胞密码子偏好性对VP2序列进行了密码子优化,采用同源臂连接技术,直接将目的基因定向克隆至表达载体pFast BacTM 1,这样直接省去了连接克隆载体和酶切鉴定等一系列繁琐步骤,大大的节省了人力物力。其次,本试验在序列前端引入了蜂毒信号肽,Westren Blot结果显示,目的蛋白可以分泌到细胞培养上清中,这在一定程度上减少了目的蛋白的降解,并且简化了蛋白纯化的步骤。同时本课题组利用Westren Blot对感染重组杆状病毒后48、60、72、84 h和96 h目的蛋白表达量进行研究,结果显示,48~72 h时蛋白表达量逐渐增加,72 h之后蛋白出现不同程度的降解。通过对蛋白表达时效的比较,能判断出蛋白纯化的最佳时间点。琼脂扩散试验显示,细胞培养上清1∶8稀释后仍可出现蛋白沉淀线,说明本试验筛选获得的重组杆状病毒可以作为鸡传染性法氏囊病病毒亚单位疫苗的候选株,接下来本课题组将进一步对重组VP2蛋白的免疫效果进行评价,有望为IBDV的防治提供更加有效的制品。

