大叶锣的酚性成分及其体外抗氧化活性研究
龚 宇,罗 伟,周蕙祯,李丽梅,陈胡兰*
1成都中医药大学药学院 中药材标准化教育部重点实验室,成都 611137;2西南民族大学药学院,成都 610041
大叶锣(DidissandrasesquifoliaC.B.Clarke.)为苦苣苔科(Gesneriaceae)漏斗苣苔属(Didissandra)多年生草本,别名大一面锣、白毛草,主要分布于我国的四川、贵州等西南地区,常生长在海拔900~1 600 m的山坡、路旁及峭壁等地。它是我国民间使用的药用植物,目前多为野生,被收录于《四川中药志》,具有益气补血、补肾固精的作用,主要用于治疗心悸怔肿、神经衰弱、崩漏带下、小便淋沥等疾病[1]。苦苣苔科植物种类十分丰富,从该科植物如降龙草(HemiboeasubcapitataClarke)、吊石苣苔(LysionotuspauciflorusMaxim)等中发现了黄酮类、苯乙醇苷类、醌类、萜类、酚类糖苷等多种化学成分[2]。现代药理研究表明其具有抗菌、抗病毒、抗氧化、抗肿瘤等良好生物活性,且有文献表明苯乙醇苷类化学成分具有神经保护、降低血糖等重要作用[3,4],从一定程度上说明该科植物是具有潜在生物学活性化合物的重要来源。迄今为止,尚未发现漏斗苣苔属植物的化学成分以及生物活性等方面的相关报道,为了明确漏斗苣苔属植物的化学成分以及生物活性,本研究运用多种色谱技术首次对大叶锣的甲醇及甲醇/水提取物的化学成分进行研究。
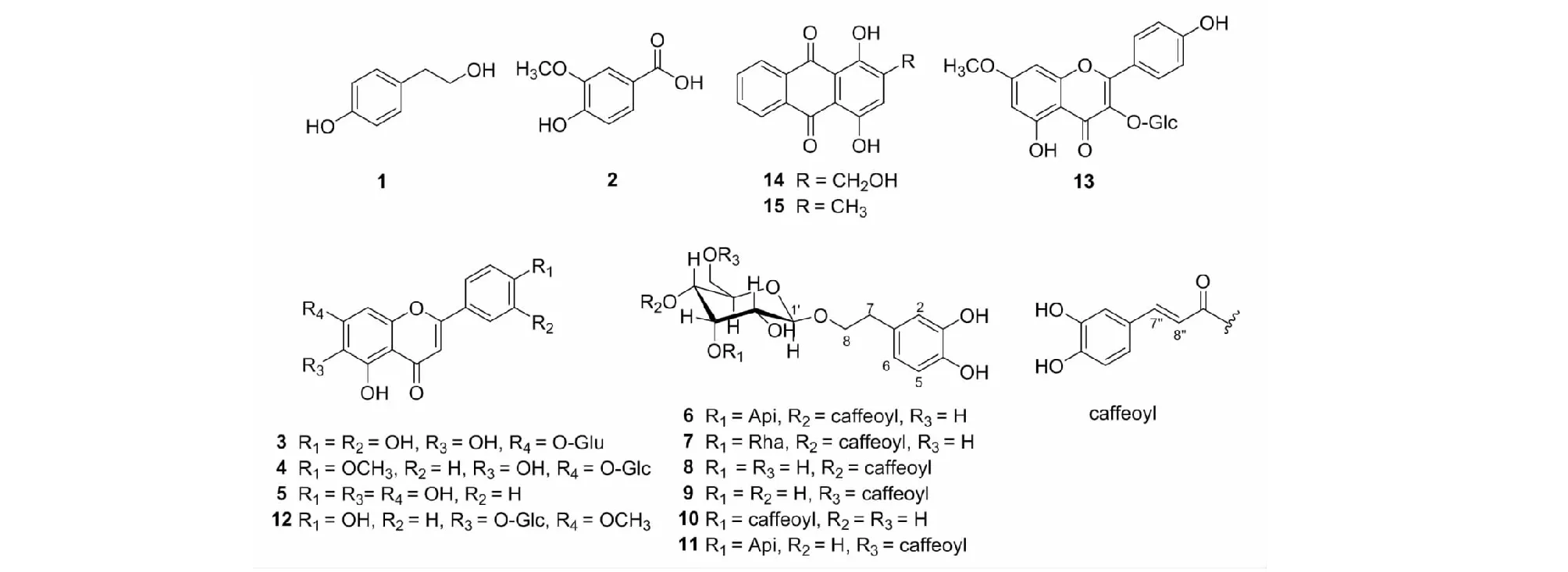
图1 化合物1~15的化学结构Fig.1 The chemical structures of compounds 1-15
1 仪器与材料
1.1 仪器
AVANCE III-400型核磁共振仪(德国Bruker公司);MicrOTOF QII高分辨质谱仪(德国Bruker公司);Varioskan Flash全波长扫描式多功能读数仪(美国Thermo公司);半制备色谱柱 (250 mm × 21.2 mm,10 μm,苏州纳微生物科技有限公司,250 mm × 10 mm,5 μm,日本YMC公司);半制备液相色谱仪(伍丰LC-100)。
1.2 药品与试剂
甲醇、乙腈、二氯乙烷、乙酸乙酯、石油醚等有机溶剂(成都科隆化学品有限公司,AR);MeOD,DMSO-d6以及CDCl3等氘代试剂(美国Sigma-Aldrich,99.8% D);柱色谱硅胶(100~200目和200~300目)、薄层板硅胶(254 nm)(青岛海洋化工厂);Sephadex LH-20(GE Healthcare Bio-Sciences AB);反相硅胶(苏州纳微生物科技有限公司);DPPH(四川维克奇生物科技有限公司,≥ 97%);ABTS(上海迈瑞尔化学技术有限公司,98%);FRAP(北京百灵威科技有限公司,98.5%)。
1.3 药材
大叶锣植物的全草于2018年7月采自四川省都江堰市青城山,植物标本经成都中医药大学药学院王光志教授鉴定为苦苣苔科漏斗苣苔属植物大叶锣(DidissandrasesquifoliaC.B.Clarke.)。
2 实验方法
2.1 提取和分离
取干燥大叶锣(全草)粗粉242.0 g,依次用甲醇(1.5 L)和70%甲醇-水(1.3 L),在60 °C下提取3次,每次1 h,合并滤液,减压浓缩,得总浸膏40.2 g(16.6%)。总浸膏用水分散后,进行MCI凝胶柱层析,分别以纯水、20%甲醇-水、40%甲醇-水、60%甲醇-水、80%甲醇-水和纯甲醇进行梯度洗脱,合并得到6个组分:纯水(A,23.9 g)、20%甲醇-水(B,3.9 g)、40%甲醇-水(C,2.7 g)、60%甲醇-水(D,3.1 g)、80%甲醇-水(E,3.9 g)和纯甲醇(F,3.4 g)。
随后,依次将A、B、C和D四个组分进行Sephadex LH-20柱层析(VMeOH∶Vwater= 1∶1),经TLC检测将点型相似的组分合并,分别从A中合并得到了6段流分(A1~6),B中得到了5段(B1~5),C中得到了3段(C1~3),D中得到3段(D1~3)。其中,A1段经过Sephadex LH-20(VMeOH∶Vwater= 1∶1)进一步纯化,得到5个流分A1-1~A1-5,A1-3经半制备液相(20%乙腈-水),分离得到化合物3(130.0 mg,24 min)。A2经半制备液相色谱,以25%乙腈-水溶剂洗脱,得化合物2(5.1 mg,26 min)。A4经半制备液相(20%乙腈-水)制备,分离得到化合物1(15.7 mg,17 min)。B4经半制备型HPLC-YMC色谱,40%甲醇-水为洗脱剂,分离得到化合物6(243.8 mg,24 min)和化合物7(251.6 mg,27 min)。B5段经过反相柱层析(10%甲醇水→60%甲醇水)得到B5-1~B5-4四个流分,其中B5-3使用半制备型HPLC-YMC(18%乙腈-水)分离,依次得到化合物8(150.9 mg,23 min)、9(206.0 mg,26 min)、10(60.2 mg,19 min)和11(100.6 mg,34 min)。C2段经Sephadex LH-20(VMeOH∶Vwater= 1∶1)纯化得C2-1~C2-4,C2-3通过半制备高效色谱(28%乙腈-水)制备,得化合物4(3.2 mg,28 min)。C3经过Sephadex LH-20(VMeOH∶Vwater= 2∶1)柱色谱纯化,结合半制备高效色谱(39%乙腈-水),分离得到化合物5(2.5 mg,17 min)。D2利用半制备型HPLC-YMC(25%乙腈-水)制备,得到化合物12(6.0 mg,27 min)。D3经Sephadex LH-20(VMeOH∶Vwater= 2∶1)纯化得化合物13(5.0 mg)。E段组分经硅胶柱层析,使用石油醚-乙酸乙酯(100∶1→1∶1)梯度洗脱,合并浓缩后得E1~E6,E1经Sephadex LH-20柱(VMeOH∶VEDC=1∶1)进一步纯化,得化合物14(15.4 mg)。F段经过硅胶柱层析(石油醚-乙酸乙酯100∶1→1∶1)梯度洗脱,得到流分F1~F6,F2经反复结晶得化合物15(10.3 mg)。
2.2 体外抗氧化活性测定
2.2.1 DPPH自由基清除测定
参考Xiang[5]的方法对大叶锣浸膏的六个不同极性组分(A~F)和6个含量较高的化学成分(化合物6~11)进行DPPH自由基清除能力的测定。将待测样品用DMSO溶解并稀释至一系列适当的浓度,取20.0 μL待测液与新鲜制备的DPPH溶液(160.0 μL,2.0 × 10-4mol/L)混合,摇匀后避光放置30 min。反应完毕后迅速在全波长扫描式多功能读数仪下于515 nm处读数,使用抗坏血酸作阳性对照,并以不同质量浓度(5.0、20.0、50.0、100.0、150.0 μg/mL)抗坏血酸的吸光度为纵轴,浓度为横轴绘制标准曲线。结果表示为每克干燥样品的抗坏血酸当量(mmol VCE/g),所有试验均重复三次。
2.2.2 ABTS+自由基清除测定
ABTS+自由基清除能力的测定参照Apea-Bah[6]所述的方法进行:将ABTS+溶液用无水乙醇适当稀释,使得ABTS+储备液在734 nm处的吸光度为0.7左右,然后将待测样品(20.0 μL)加到70.0 μL的ABTS+自由基储备溶液中,室温下反应10 min后在734 nm处读取吸光度。同DPPH测定法一样,以Vc作阳性对照,并绘制标准曲线。自由基清除活性显示为每克干样品的抗坏血酸当量(mmol VCE/g),所有试验均重复三次。
2.2.3 总还原能力测定(FRAP)
根据文献[7]的方法,我们对各个样品的总还原能力进行了测定。以FeSO4作为阳性对照,取10.0 μL待测液与180.0 μL反应液(TBTZ)混合,37 ℃水浴保持30 min后于593 nm处读数。结果以不同浓度的FeSO4(50.0、100.0、200.0、300.0、400.0、500.0 μg/mL)做标准曲线,计算每克样品中的FeSO4当量(mmol FeSO4/g),所有试验均重复三次。
3 实验结果
3.1 化合物的结构鉴定
化合物1白色粉末(MeOH);5%硫酸-乙醇显色剂呈红色。1H NMR(400 MHz,DMSO-d6)δ:6.96(2H,d,J= 8.4 Hz,H-2,6),6.64(2H,d,J= 8.4 Hz,H-3,5),3.51(2H,t,J= 7.2 Hz,H-2′),2.59(2H,t,J= 7.2 Hz,H-1′)。经与文献[8]比对基本一致,鉴定该化合物为对羟基苯乙醇。
化合物2白色粉末(MeOH);1H NMR(400 MHz,DMSO-d6)δ:7.44(1H,d,J= 8.6 Hz,H-6),7.42(1H,s,H-2),6.85(1H,d,J= 8.6 Hz,H-5),3.80(3H,s,OCH3)。经与文献[9]比对基本一致,鉴定该化合物为香草酸。
化合物3黄色固体(MeOH);5%硫酸-乙醇显色剂呈黄色。ESI-MS:m/z478.92 [M-H]-;1H NMR(400 MHz,DMSO-d6)δ:7.42(1H,d,J= 4.7 Hz,H-2′),7.35(1H,dd,J= 9.1,4.7 Hz,H-6′),6.93(1H,s,H-8),6.88(1H,d,J= 9.1 Hz,H-5′),6.70(1H,s,H-3),5.10(1H,d,J= 6.0 Hz,H-1″),3.26~3.88(m,Glu-H)。经与文献[10]比对基本一致,鉴定该化合物为6-hydroxyluteolin-7-O-glucuronide。
化合物4黄色固体(MeOH);5%硫酸-乙醇显色剂呈黄色。ESI-MS:m/z463.08 [M+H]+,301.02 [M - Glc+H]+;1H NMR(400 MHz,DMSO-d6)δ:8.05(2H,d,J= 8.8 Hz,H-2′,6′),7.19(2H,d,J= 8.8 Hz,H-3′,5′),6.96(1H,s,H-8),6.83(1H,s,H-3),5.03(1H,d,J= 7.2 Hz,Glc-H-1),3.92(3H,s,OCH3),3.72~3.17(m,Glc-H)。经与文献[11]比对基本一致,鉴定该化合物为stachannin A。
化合物5黄色固体(MeOH);5%硫酸-乙醇显色剂呈黄色。1H NMR(400 MHz,MeOD)δ:7.89(2H,d,J= 8.6 Hz,H-2′,6′ ),6.92(2H,d,J= 8.6 Hz,H-3′,5′),6.83(1H,s,H-8),6.63(1H,s,H-3)。与文献[12]比对基本一致,鉴定该化合物为野黄芩素。
化合物6棕黄色固体(MeOH-Water);5%硫酸-乙醇显色剂呈红色→淡黄绿色。1H NMR(400 MHz,MeOD)δ:7.63(1H,d,J= 14.9 Hz,H-7″),7.06(1H,d,J= 1.4 Hz,H-2″),6.97(1H,dd,J= 8.1,1.4 Hz,H-6″),6.80(1H,d,J= 8.1 Hz,H-5″),6.70(1H,d,J= 2.3 Hz,H-2),6.67(1H,d,J= 8.2 Hz,H-5),6.58(1H,dd,J= 8.2,2.3 Hz,H-6),6.26(1H,d,J= 14.9 Hz,H-8″),5.35(1H,d,J= 1.5 Hz,Api-H-1),4.40(1H,d,J= 7.9 Hz,Glc-H-1),4.04(1H,m,H-8),3.90(1H,d,J= 1.4 Hz,Api-H-2),3.42~3.77(m,Api/Glc-H),2.80(2H,m,H-7);13C NMR(100 MHz,MeOD)δ:131.4(C-1),114.9 (C-2),146.1(C-3),144.7(C-4),116.5(C-5),121.2(C-6),36.5(C-7),72.2(C-8),127.6(C-1″),115.1(C-2″),146.8(C-3″),149.7(C-4″),117.1(C-5″),123.1(C-6″),147.7(C-7″),116.3(C-8″),168.3(C=O),104.1(C-1′),75.8(C-2′),81.4(C-3′),70.6(C-4′),75.9(C-5′),62.3(C-6′),111.5(C-1′″),78.2(C-2′″),80.6(C-3′″),75.12(C-4′),65.6(C-5′)。经与文献[13]比对基本一致,鉴定该化合物为calceolarioside E。
化合物7棕黄色固体(MeOH-Water);5%硫酸-乙醇显色剂呈红色。1H NMR(400 MHz,MeOD)δ:7.48(1H,d,J= 15.9 Hz,H-7″),6.93(1H,d,J= 1.9 Hz,H-2″),6.83(1H,dd,J= 8.2,1.9 Hz,H-6″),6.66(1H,d,J= 8.2 Hz,H-5″),6.57(1H,d,J= 1.9 Hz,H-2),6.54(1H,d,J= 8.2 Hz,H-5),6.42(1H,dd,J= 8.2,1.9 Hz,H-6),6.13(1H,d,J= 15.9 Hz,H-8″),5.05(1H,s,Rha-H-1),4.70(1H,t,J= 9.7 Hz,Glc-H-4),4.25(1H,d,J= 7.9 Hz,Glc-H-1),3.80~3.17(m,H-8 or Rha/Glc-H),2.65(2H,m,H-7),0.95(3H,d,J= 6.2 Hz,Rha-CH3);13C NMR(100 MHz,MeOD)δ:131.4(C-1),117.1(C-2),144.6(C-3),146.0(C-4),116.5(C-5),121.3(C-6),36.5(C-7),72.3(C-8),127.6(C-1″),115.2(C-2″),149.7(C-3″),146.8(C-4″),116.3(C-5″),123.2(C-6″),148.0(C-7″),114.6(C-8″),168.3(C=O),104.1(C-1′),76.1(C-2′),81.7(C-3′),70.5(C-4′),75.9(C-5′),62.3(C-6′),103.0(C-1′),72.2(C-2′),72.0(C-3′),73.8(C-4′),70.4(C-5′),18.4(C-6′)。经与文献[14]比对基本一致,鉴定该化合物为verbasoside。
化合物8深棕绿色固体(MeOH);5%硫酸-乙醇显色剂呈红色。1H NMR(400 MHz,DMSO-d6)δ:7.49(1H,d,J= 15.9 Hz,H-7″),7.05(1H,s,H-2″),6.99(1H,d,J= 7.7 Hz,H-6″),6.75(1H,d,J= 7.7 Hz,H-5″),6.64(1H,d,J= 8.1 Hz,H-5),6.62(1H,s,H-2),6.48(1H,d,J= 8.1 Hz,H-6),6.23(1H,d,J= 15.9 Hz,H-8″),4.63(1H,t,J= 9.4 Hz,Glc-H-4),4.27(1H,d,J= 7.7 Hz,Glc-H-1),3.06~3.89(m,H-8/Glc-H),2.68(2H,m,H-7);13C NMR(100 MHz,DMSO-d6)δ:129.2(C-1),116.3(C-2),145.5(C-3),145.0(C-4),114.9(C-5),119.6(C-6),35.1(C-7),70.3(C-8),125.5(C-1″),115.5(C-2″),145.7(C-3″),148.6(C-4″),115.8(C-5″),121.4(C-6″),143.6(C-7″),113.9(C-8″),166.0(C=O),102.8(C-1′),74.1(C-2′),74.7(C-3′),71.3(C-4′),73.6(C-5′),60.9(C-6′)。经与文献[15]比对基本一致,鉴定该化合物为calceolarioside A。
化合物9棕绿色固体(MeOH);5%硫酸-乙醇显色剂呈红色。1H NMR(400 MHz,DMSO-d6)δ:7.44(1H,d,J= 15.9 Hz,H-7″),7.05(1H,s,H-2″),6.96(1H,d,J= 8.0 Hz,H-6″),6.74(1H,d,J= 8.0 Hz,H-5″),6.60(1H,s,H-2),6.57(1H,d,J= 8.1 Hz,H-5),6.44(1H,d,J= 8.1 Hz,H-6),6.27(1H,d,J= 15.9 Hz,H-8″),4.37(1H,d,J= 11.7 Hz,Glc-6′a),4.22(1H,d,J= 7.6 Hz,Glc-H-1),4.14(1H,dd,J= 11.7,6.0 Hz,Glc-6′b),2.97~3.77(m,H-8/Glc-H),2.65(2H,m,H-7);13C NMR(100 MHz,DMSO-d6)δ:129.4(C-1),116.1(C-2),145.3(C-3),143.8(C-4),116.6(C-5),119.7(C-6),35.4(C-7),70.5(C-8),125.6(C-1″),114.0(C-2″),145.9(C-3″),148.9(C-4″),115.7(C-5″),121.7(C-6″),145.3(C-7″),115.1(C-8″),166.8(C=O),103.2(C-1′),73.6(C-2′),76.7(C-3′),70.3(C-4′),74.0(C-5′),63.8(C-6′)。经与文献[16]比对基本一致,鉴定该化合物为calceolarioside B。
化合物10深墨绿色固体(MeOH);5%硫酸-乙醇显色剂呈红色。1H NMR(400 MHz,DMSO-d6)δ:7.43(1H,d,J= 15.9 Hz,H-7″),7.05(1H,s,H-2″),6.98(1H,d,J= 8.0 Hz,H-6″),6.75(1H,d,J= 8.0 Hz,H-5″),6.63(1H,s,H-2),6.62(1H,d,J= 8.3 Hz,H-5),6.47(1H,d,J= 8.3 Hz,H-6),6.24(1H,d,J= 15.9 Hz,H-8″),4.88(1H,t,J= 9.3 Hz,Glc-H-3),4.32(1H,d,J= 7.7 Hz,Glc-H-1),3.86~3.77(m,H-8/Glc-H),2.65(2H,m,H-7);13C NMR(100 MHz,DMSO-d6)δ:129.2(C-1),116.4(C-2),145.2(C-3),143.6(C-4),115.9(C-5),119.6(C-6),34.7(C-7),70.2(C-8),125.7(C-1″),115.5(C-2″),145.7(C-3″),148.4(C-4″),115.5(C-5″),121.3(C-6″),144.8(C-7″),114.8(C-8″),166.2(C=O),102.6(C-1′),71.5(C-2′),77.8(C-3′),68.0(C-4′),76.7(C-5′),60.7(C-6′)。经与文献[17]比对基本一致,鉴定该化合物为plantainoside A。
化合物11棕黄色固体(MeOH);5%硫酸-乙醇显色剂呈红色→淡黄绿色。1H NMR (400 MHz,DMSO-d6)δ:7.44(1H,d,J= 15.6 Hz,H-7″),7.05(1H,s,H-2″),6.95(1H,d,J= 8.1 Hz,H-6″),6.74(1H,d,J= 8.1 Hz,H-5″),6.60(1H,s,H-2),6.57(1H,d,J= 8.0 Hz,H-5),6.44(1H,d,J= 8.0 Hz,H-6),6.27(1H,d,J= 15.6 Hz,H-8″),5.22(1H,d,J= 1.5 Hz,Api-H-1),4.35(1H,d,J= 11.3 Hz,Glc-H-1),4.19(1H,m,H-8),3.99(1H,d,J= 1.4 Hz,Api-H-2),3.15~3.88(m,Api/Glc-H),2.67(2H,m,H-7);13C NMR(100 MHz,DMSO-d6)δ:129.1(C-1),116.3(C-2),145.6(C-3),143.6(C-4),115.5(C-5),119.5(C-6),34.9(C-7),70.4(C-8),125.4(C-1″),114.9(C-2″),145.4(C-3″),148.6(C-4″),115.8(C-5″),121.5(C-6″),145.0(C-7″),113.8(C-8″),166.6(C=O),102.8(C-1′),73.5(C-2′),81.7(C-3′),68.5(C-4′),73.6(C-5′),63.7(C-6′),109.2(C-1′″),76.0(C-2′″),79.1(C-3′″),73.3(C-4′″),63.0(C-5′″)。经与文献[18]比对基本一致,鉴定该化合物为isonuomioside A。
化合物12黄色固体(MeOH);5%硫酸-乙醇显色剂呈黄色。ESI-MS:m/z485.09 [M+Na]+,323.15 [M - Glc+Na]+,301.16 [M - Glc+Na]+;1H NMR(400 MHz,DMSO-d6)δ:7.97(H,d,J= 8.7 Hz,H-2′,6′),6.93(2H,d,J= 8.7 Hz,H-3′,5′),6.93(1H,s,H-8),6.84(1H,s,H-3),5.03(1H,m,Glc-H-1),3.90(3H,s,OCH3)。与文献[19]比对基本一致,鉴定该化合物为7-O-甲基黄芩素-6-O-葡萄糖苷。
化合物13黄色固体(MeOH);5%硫酸-乙醇显色剂呈黄色。ESI-MS:m/z485.12 [M+Na]+;1H NMR(400 MHz,DMSO-d6)δ:7.86(2H,d,J= 8.3 Hz,H-2′,6′),6.86(2H,d,J= 8.3 Hz,H-3′,5′),6.60(1H,s,H-8),6.38(1H,s,H-6),5.41(1H,br s,Glc-H-1),3.83(3H,s,OCH3)。与文献[20]比对基本一致,鉴定该化合物为鼠李柠檬素-3-O-β-D-葡萄糖苷。
化合物14橙红色晶体(CHCl3);5%硫酸-乙醇显色剂呈橙红色。1H NMR(400 MHz,CDCl3)δ:13.33(1H,s,1-OH),12.94(1H,s,4-OH),8.35(2H,m,H-6,7),7.86(2H,m,H-5,8),7.44(1H,s,H-3),4.86(2H,s,2-CH2)。与文献[21]比对基本一致,鉴定该化合物为1,4-二羟基-2-羟甲基蒽醌。
化合物15橙红色晶体(CHCl3);254 nm处有紫外吸收,5%硫酸-乙醇显色剂呈橙红色。1H NMR(400 MHz,CDCl3)δ:13.37(1H,s,1-OH),12.99(1H,s,4-OH),8.37~8.34(2H,m,H-6,7),7.84~7.82(2H,m,H-5,8),7.18(1H,q,H-3),2.38(3H,d,J= 0.7 Hz,CH3)。与文献[22]比对基本一致,鉴定该化合物为1,4-二羟基-2-甲基蒽醌。
3.2 体外抗氧化活性的测定
植物能够产生高度多样化的天然抗氧化剂,这些物质在防止或延缓活性氧和非自由基对脂质、蛋白质和核酸的氧化损伤中起着重要作用,因此对植物中化合物进行抗氧化活性的测定是非常必要的。本实验测定了大叶锣总浸膏A~F六个组分以及化合物6~11的体外抗氧化活性,结果如图2所示。每个化合物均表现出一定的抗氧化能力,DPPH测定的变化范围为0.02~0.35 mmol VCE/g,ABTS为0.25~4.28 mmol VCE/g,FRAP为0.29~18.16 mmol FeSO4/g。
DPPH自由基抗氧化能力测试结果表明,化合物10(5.35±0.04 mmol VCE/g)的DPPH自由基清除能力最强,各个化合物DPPH自由基清除活性顺序如下:10>9>11>6>7>8。其中化合物9(5.14±0.36 mmol VCE/g)和10的DPPH自由基清除活性略小于阳性对照组(5.68±0.10 mmol VCE/g),并且表现出比酪醇(EC50= 11.74 mg/mL)更强的抗氧化活性[23]。化合物9和10在ABTS自由基清除测定和FRAP测定中同样也显示出更高的抗氧化活性,且化合物6~11的总还原能力均大于FeSO4(6.58 mmol/g),显示出了良好的抗氧化活性。有文献报道多个酚羟基的出现,尤其是存在邻二羟基构象的排列是具有良好自由基清除活性的重要结构特征[24]。从大叶锣中分离得到的化合物6~11皆具“邻二羟基构象”的咖啡酸和羟基酪醇片段,进一步证明了该类化合物具有较高体外抗氧化活性的结构基础。
同时,各组分的体外抗氧化活性测定的结果表明,B(3.58±0.00 mmol VCE/g)、C(2.75±0.07 mmol VCE/g)和D(3.41±0.01 mmol VCE/g)组分的DPPH、ABTS自由基的清除能力优于其他组分,按以下顺序排列:B > C > D > A > E > F。结合该植物各极性段所含化合物类型情况,具有强抗氧化性的苯乙醇苷类和黄酮类化合物主要来源于B、C和D这三段,由此可以说明这类化合物的存在是其高抗氧化性的主要贡献者。

图2 大叶锣化学成分及浸膏的抗氧化活性测定结果Fig.2 Antioxidant activity of chemical constituents and different extracts from D.sesquifolia.
4 结论
本研究从大叶锣植物全草的甲醇以及甲醇-水提取物中共分离鉴定了15个化合物,所有化合物均首次从漏斗苣苔属植物中分离得到。结果显示大叶锣的酚性成分主要为苯乙醇苷类和黄酮类化合物,首次揭示了漏斗苣苔属植物成分多样性。此外,体外抗氧化活性研究结果表明,各组分以及主要化合物均具有抗氧化活性。其中苯乙醇苷类化合物9和10的抗氧化活性最为优异,为大叶锣提取物的抗氧化活性提供了物质基础。截至目前国内外对大叶锣的研究甚少,本次研究补充了该植物在化学成分以及抗氧化活性方面的知识,为其在天然抗氧化剂的开发以及药物先导化合物的筛选上奠定基础。此外,该研究分析的植物总浸膏量较少,分离鉴定的大多为主要化学成分,对其微量成分的研究有所欠缺,而且生物活性的研究比较单一,仅涉及到体外抗氧化活性。后续研究将会围绕微量成分的分析以及文献提及的神经保护等生物活性开展,试图寻找结构新颖皆具良好生物活性的化合物。

