硫辛酸-香豆素偶联物合成及抗肿瘤活性研究
戴 一,冯 艳,陈天芹
1安徽新华学院药学院,合肥 230088;2中国科学技术大学化学系,合肥 230036
1 材料与方法
1.1 仪器与试剂
BruckerACF-300型核磁共振仪(布鲁克(北京)科技有限公司);CytoFLEX流式细胞仪(美国贝克曼库尔特公司);奥林巴斯IX71荧光显微镜(日本奥林巴斯公司);API3000质谱仪(美国PE公司);bio-rad mode680酶标仪(美国伯乐生命医学产品有限公司);硫辛酸、7-羟基-4-甲基香豆素(阿拉丁试剂有限公司)。DEME培养基(hyclone公司),胎牛血清FBS(Lonsera公司),MTT、活性氧检测试剂盒及细胞凋亡检测试剂盒(碧云天公司),其他试剂均为分析纯。
1.2 受试细胞株
受试细胞株人肝癌HepG2细胞、人宫颈癌细胞HeLa细胞、人卵巢癌A2780细胞及人肺癌A549细胞来自于美国ATCC公司。
1.3 硫辛酸-香豆素偶联物及正辛酸-香豆素偶联物合成路线
以硫辛酸为起始原料,二氯亚砜作为酰氯化试剂合成硫辛酰氯,所得酰氯在缚酸剂三乙胺存在的条件下与7-羟基-4-甲基香豆素发生酯化反应即得硫辛酸-香豆素偶联物,同法合成正辛酸-香豆素偶联物,合成路线见图1。
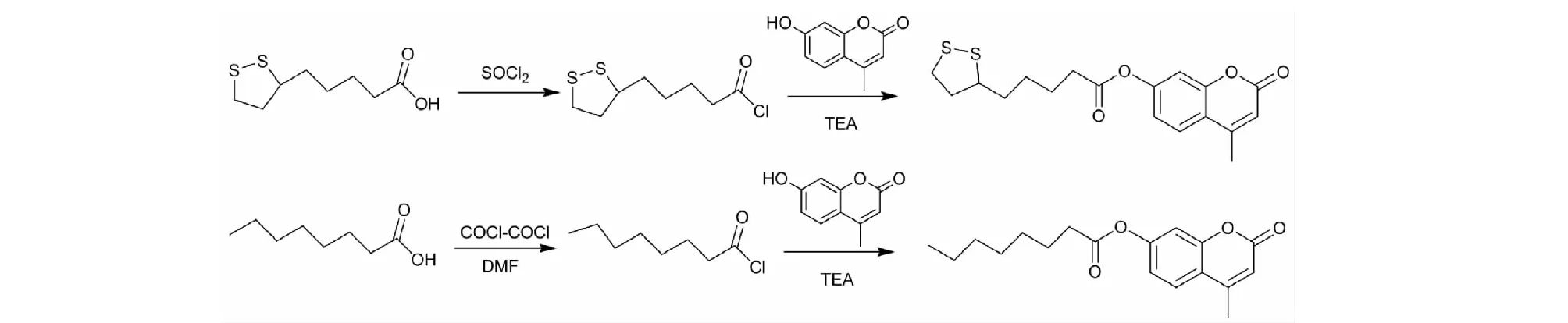
图1 硫辛酸-香豆素偶联物及正辛酸-香豆素偶联物的合成路线Fig.1 Synthesis route of lipoic acid-coumarin conjugate and n-caprylic acid-coumarin conjugate
1.4 化学合成
1.4.1 硫辛酰氯的制备[20]
取二氯亚砜(2.04 mL,28.0 mmol)溶于30 mL 二氯甲烷中,在0 ℃ 缓慢滴入硫辛酸(3.88 g,18.72 mmol)的50 mL二氯甲烷溶液中,滴加完毕,室温反应4 h,减压除去溶剂,得浅黄色固体,即为硫辛酰氯,保存备用。
1.4.2 硫辛酸-香豆素偶联物的合成
7-羟基-4-甲基香豆素(1.76 g,10 mmol)溶于50 mL无水四氢呋喃中,加入三乙胺(1.39 mL,10 mmol)。另取硫辛酸酰氯(2.25 g,10 mmol),溶于50 mL 无水四氢呋喃中,冰水浴条件下缓慢滴入上述溶液中,滴加完毕,室温搅拌反应,TLC跟踪反应(展开剂为石油醚:乙酸乙酯=2∶1)。反应完毕,减压除去溶剂,以乙酸乙酯溶解,分别以稀盐酸、饱和食盐水洗涤,无水硫酸钠干燥,过滤,粗产物过硅胶柱,以石油醚:乙酸乙酯=4∶1洗脱,得黄色固体。
1.4.3 正辛酰氯的制备
事实上,许沁想错了。许沁在葛局长的心中,早已没有任何位置了。当然这并不是位置的问题,而是为官之道。在葛局长看来,许沁是条狗,是条随时会咬人的狗,是条翻脸不认人的狗。一旦受到威胁或伤害,她会逮谁咬谁。葛局长不能不严加提防,因而断然割断了和许沁的任何联系。
取正辛酸(2.88 g,20.00 mmol) 溶于100 mL 二氯甲烷中,0 ℃ 条件下缓慢滴入草酰氯(3.06 g,24.00 mmol),滴加完毕,加入2滴DMF作为催化剂,逐渐升温至室温反应4 h,减压除去溶剂,得无色油状物,即为正辛酰氯,保存备用。
1.4.4 正辛酸-香豆素偶联物的合成
7-羟基-4-甲基香豆素(1.76 g,10 mmol)溶于50 mL二氯甲烷中,加入三乙胺 (1.39 mL,10 mmol)。另取正辛酸酰氯(2.25 g,10 mmol)溶于30 mL 二氯甲烷中,冰水浴条件下缓慢滴入上述溶液中,滴加完毕,室温搅拌反应,TLC跟踪反应(展开剂为石油醚∶乙酸乙酯=3∶1)。反应完毕,分别以稀盐酸、饱和食盐水洗涤,无水硫酸钠干燥,过滤,粗产物过硅胶柱,以石油醚∶乙酸乙酯=5∶1洗脱,得无色油状物。
1.5 硫辛酸-香豆素偶联物抗肿瘤活性研究
于96孔板中接种对数生长期肿瘤细胞培养,每孔加5 000个细胞、培养基为100 μL,于37 ℃、5%CO2的条件下培养。培养过夜后给予不同浓度的待测化合物,平行设3个孔,阴性对照组加与给药组等体积的培养基,以DEME 培养基作为空白对照组,给药后继续培养48 h,弃去培养液,每孔加5 mg/mL的MTT溶液20 μL,继续孵育4 h,弃去上清液,每孔加入DMSO 150 μL,震荡10 min,酶标仪570 nm测定吸光度OD值,计算抑制率及IC50值。抑制率=[1-(A实验组-A空白组)/(A对照组-A空白组)]×100%。
1.6 硫辛酸-香豆素偶联物与正辛酸-香豆素偶联物抗肿瘤活性比较
于96孔板中接种对数生长期肝癌HepG2细胞培养,每孔5 000个细胞,37 ℃、5%CO2、100 μL培养基培养。次日给予高低浓度(250和125 μM)的硫辛酸-香豆素偶联物、正辛酸-香豆素偶联物或香豆素与酸的相应混合物,平行设3个孔,阴性对照组加给药组等体积的培养基,以DEME 培养基作为空白对照组,给药后继续培养48 h,弃去培养液,每孔加5 mg/mL的MTT溶液20 μL,继续孵育4 h,弃去上清液,每孔加入DMSO 150 μL,震荡10 min,酶标仪570 nm测定吸光度OD值,计算抑制率。抑制率=[1-(A实验组-A空白组)/(A对照组-A空白组)]×100%。
1.7 硫辛酸-香豆素偶联物对活性氧的清除
于6孔板中接种HepG2细胞,每孔10万个细胞,2 mL完全培养基在37 ℃、5%CO2培养箱培养过夜,于次日分别用含药培养基进行替换继续培养24 h,所加药物的浓度硫辛酸-香豆素偶联物、硫辛酸、硫辛酸与香豆素混合物(摩尔比1∶1)、正辛酸-香豆素偶联物、正辛酸、正辛酸与香豆素混合物(摩尔比1∶1)及香豆素以硫辛酸或正辛酸计均为500 μM。24 h 后按活性氧检测试剂盒(DCFH-DA)(购于碧云天生物)原位处理,经PBS 洗涤后用荧光显微镜观察[21]。
1.8 硫辛酸-香豆素偶联物诱导细胞凋亡
对于硫辛酸-香豆素偶联物诱导的细胞凋亡,本实验于12孔板中接种HepG2细胞,每孔20万个细胞,1 mL完全培养基在37 ℃、5%CO2培养箱培养过夜,于次日分别用含药培养基进行替换继续培养48 h,所加药物的浓度硫辛酸-香豆素偶联物、硫辛酸、硫辛酸与香豆素混合物(摩尔比1∶1)及香豆素均为500 μM。48 h后按Annexin V-FITC 凋亡试剂盒说明书(购于碧云天生物)收集所有细胞,经PBS洗涤后加Annexin V-FITC及PI 进行染色,流式细胞仪检测。
1.9 硫辛酸-香豆素偶联物细胞内水解释放
于6孔板中接种HepG2细胞,每孔10万个细胞,2 mL完全培养基在37 ℃、5%CO2培养箱培养过夜,于次日分别用含药培养基进行替换继续培养,所加药物的浓度硫辛酸-香豆素偶联物为1 mM。在0、1、2、4、6、8 h分别取样,经PBS 洗涤后用荧光显微镜观察。
2 结果与分析
2.1 化合物表征
硫辛酸-香豆素偶联物为黄色固体,收率为73%,TLC的Rf约0.6(展开剂为石油醚∶乙酸乙酯=2∶1);1H NMR(300 MHz,CDCl3)δ:1.45~1.75(m,2H),1.70~2.09(m,5H),2.45(s,3H),2.44~2.59(m,1H),2.64(t,J= 7.4 Hz,2H),3.07~3.29(m,2H),3.55~3.70(m,1H),6.28(s,1H),7.03~7.16(m,2H),7.62(d,J= 8.6 Hz,1H);13C NMR(75 MHz,CDCl3)δ:18.77(4-CH3),24.50(C-3′),28.69 (C-4′),34.10(C-2′),34.59(C-5′),38.55(C-8′),40.27(C-7′),56.28(C-6′),110.45(C-8),114.52(C-2),117.83(C-4a),118.10(C-6),125.40(C-5),151.93(C-7),153.08(C-4),154.18(C-8a),160.50(C-2),171.31(C-1′);IR(KBr)vmax:3 091,2 930,2 859,1 732,1 613,1 568,1 501,1 413,1 384,1 328,1 263,1 227,1 014,981,879 cm-1;ESI-MS:m/z365.2 [M+H]+,387.1 [M+Na]+,729.5 [2M+H]+,746.4 [2M+H2O]+,751.3 [2M+Na]+。
正辛酸-香豆素偶联物为无色油状液体,收率为87%,TLC的Rf约0.7(展开剂为石油醚∶乙酸乙酯=2∶1);1H NMR(400 MHz,CDCl3)δ:0.83~0.94(t,J= 7.9 Hz,3H),1.25~1.43(m,8H),1.71~1.82(q,J= 7.6,7.1 Hz,2H),2.38~2.43(s,3H),2.55~2.64(t,J= 7.5Hz,2H),6.19~6.24(s,1H),7.01~7.09(m,2H),7.55~7.63(dd,J= 8.5,2.1 Hz,1H);13C NMR(100 MHz,CDCl3)δ:13.98(C-8′),18.56(4-CH3),22.52(C-7′),24.68(C-3′),28.83(C-4′),28.92(C-5′),31.56(C-6′),34.18(C-2′),110.16(C-8),114.16(C-2),117.53(C-4a),118.04(C-6),125.40(C-5),152.05(C-7),153.11(C-4),153.93(C-8a),160.28(C-2),171.44(C-1′)。
2.2 硫辛酸-香豆素偶联物抗肿瘤活性研究
通过MTT法评价所得偶联物细胞毒性,结果见表1。除HepG2细胞外,对A2780细胞、A549细胞及Hela细胞,硫辛酸与香豆素的混合物抑制活性均高于单个的母体化合物香豆素或硫辛酸,显示出硫辛酸与香豆素具有一定的协同效果,且硫辛酸-香豆素偶联物的抑制活性明显高于硫辛酸与香豆素的混合物以及单个的母体化合物香豆素、硫辛酸,尤其相比于硫辛酸,活性提高了一个数量级,可见硫辛酸与香豆素的偶联组合提高了硫辛酸抗癌活性。

表1 硫辛酸与香豆素偶联物体外抗肿瘤活性结果
2.3 硫辛酸-香豆素偶联物与正辛酸-香豆素偶联物抗肿瘤活性比较
为确定硫辛酸-香豆素偶联物抗肿瘤活性提高的原因是否由于其本身脂溶性提高增加了摄取所导致,本实验进一步合成了一个脂溶性更大的正辛酸-香豆素偶联物。通过考察在高浓度(250 μM)和低浓度(125 μM)对HepG2细胞的抑制作用,由图2可见,无论在高低浓度,硫辛酸与香豆素的混合物相比于正辛酸与香豆素的混合物,肿瘤抑制活性没有明显的差别,可能因为混合物中硫辛酸、正辛酸或香豆素均为单体,而单独的硫辛酸、正辛酸肿瘤抑制作用较弱,主要表现为香豆素的作用。而高低浓度给药组硫辛酸-香豆素偶联物的肿瘤抑制活性均高于正辛酸-香豆素偶联物,说明硫辛酸-香豆素偶联物抗肿瘤活性提高除了脂溶性提高所致较高摄取因素外,硫辛酸本身也表现出了一种其他方式的抗肿瘤作用,文献报道硫辛酸可以清除ROS而产生肿瘤抑制作用[7,8]。本实验进一步考察了两种偶联物对ROS的清除作用。

图2 硫辛酸-香豆素偶联物与正辛酸-香豆素偶联物抗肿瘤活性比较Fig.2 Comparison of antitumor activity between lipoic acid-coumarin conjugate and n-caprylic acid-coumarin conjugate 注:*P<0.05,**P<0.01。
2.4 硫辛酸-香豆素偶联物对活性氧的清除
低浓度活性氧对肿瘤细胞的增殖、分化及转移等具有重要的促进作用,硫辛酸清除活性氧对于抑制肿瘤细胞的增殖、转移等具有重要价值。采用活性氧检测试剂盒(DCFH-DA)(购于碧云天生物)原位处理,活性氧与DCFH-DA反应可产生绿色荧光。在一定曝光时间条件下,由图A1可见HepG2肿瘤细胞本身可以产生低浓度活性氧,从图B1-D1可见,硫辛酸的参与可以降低ROS的浓度,尤其是硫辛酸-香豆素偶联物可降低效果更为显著,显示出该偶联物显著的活性氧清除功能。由图A2-D2可见,香豆素、正辛酸组成的偶联物或混合物及它们各自的单体,均不能有效地清除肿瘤中的ROS,说明清除ROS可能是硫辛酸-香豆素偶联物产生更强抗肿瘤活性的一个重要原因。

图3 硫辛酸-香豆素偶联物对活性氧的清除Fig.3 Scavenging of reactive oxygen by lipoic acid coumarin conjugate注:HepG2细胞孵育24 h后给药浓度均为500 μM,A1为对照组;A2为香豆素组;B1为硫辛酸-香豆素偶联物组;B2为正辛酸-香豆素偶联物组;C1为硫辛酸与香豆素混合物组;C2为正辛酸与香豆素混合物组;D1为硫辛酸组;D2为正辛酸组。Note:HepG2 cells were pre-incubated for 24 h with drugs at dose of 500 μM,A1:control group;A2:coumarin group;B1:lipoic acid-coumarin conjugate group;B2:n-caprylic acid -coumarin conjugate group;C1:mixture of lipoic acid and coumarin group;C2:mixture of n-caprylic acid and coumarin group;D1:lipoic acid group;D2:n-caprylic acid group.
2.5 硫辛酸-香豆素偶联物诱导细胞凋亡
对于硫辛酸-香豆素偶联物诱导的细胞凋亡,流式细胞仪检测如图4显示,相比于对照组4.94%的凋亡率,单纯硫辛酸对凋亡几乎没有影响,单纯香豆素组可见凋亡率提高到7.28%,但远低于硫辛酸与香豆素混合物组的16.78%及硫辛酸-香豆素偶联物的17.49%,可见硫辛酸与香豆素有明显的协同作用,同时可以发现硫辛酸与香豆素的混合物诱导的凋亡早晚期几乎相等,而硫辛酸-香豆素偶联物诱导的凋亡主要集中在晚期。

图4 硫辛酸-香豆素偶联物诱导细胞凋亡Fig.4 Effect of lipoic acid-coumarin conjugate on the apoptosis注:HepG2细胞孵育24 h后给药浓度均为500 μM,A为对照组;B为硫辛酸组;C为香豆素组; D为硫辛酸与香豆素混合物组;E为硫辛酸与香豆素偶联物组。Note:HepG2 cells were pre-incubated for 24 h with drugs at dose of 500 μM,A:Control group;B:Lipoic acid group;C:Coumarin group;D:The mixture of lipoic acid and coumarin group;E:Lipoic acid-coumarin conjugate group.
2.6 硫辛酸-香豆素偶联物细胞内水解释放
硫辛酸-香豆素偶联物除具有抑制肿瘤细胞生长的活性外,同时具有细胞示踪药物水解释放功能,本实验设计的硫辛酸-香豆素偶联物具有“turn-on”功能,由图5中 A、B图可见,硫辛酸-香豆素偶联物在PBS中用365 nm光激发无蓝色荧光,而当用碱液水解后可以观察到强烈的蓝色荧光,这是因为水解后该偶联物释放出香豆素母体,产生了荧光。在细胞体内,存在着丰富的酯水解酶,可以把硫辛酸-香豆素偶联物同样水解,起到在细胞内示踪药物水解释放的效果。实验进一步研究了该偶联物不同时间细胞内药物水解释放,由图5可见,该偶联物与癌细胞共孵育1 h,基本观察不到蓝色荧光,从2 h开始,蓝色荧光逐渐增强,6 h时达到最强,在8 h时荧光变弱,通过该实验实时检测到药物的水解释放。体现了该偶联物具有示踪药物水解释放的功能。

图5 硫辛酸-香豆素偶联物的细胞内水解释放Fig.5 The release of lipoic acid coumarin conjugate in cancer cells注:A为硫辛酸-香豆素偶联物的氢氧化钠溶液;B为硫辛酸-香豆素偶联物PBS溶液;0、1、2、4、6、8 h 为给药1 mM后各时间点细胞内荧光强度。Note:A:Sodium hydroxide solution of lipoic acid-coumarin conjugate;B:PBS solution of lipoic acid-coumarin conjugate;Fluorescence intensity in cancer cells treated with 1 mM drug at 0,1,2,4,6,8 h.
3 结论
硫辛酸作为一个内源性维生素类分子,具有多种生物功能。近年来在对抗癌治疗方面的研究较为活跃,因单独的硫辛酸治疗效果有限,多对硫辛酸进行结构改造。改造主要在两个位点展开,如本研究采取的方式,利用硫辛酸本身具有的羧基,另一个位点就是打开二硫键形成巯基后进行改造,其中引起较大关注的为CPI-613,已完成临床I期研究[22]。药物可示踪化持续受到广泛的关注,对于个体化给药具有重要的意义。本实验通过硫辛酸与7-羟基-4-甲基香豆素成酯制成了具有可示踪功能的硫辛酸-香豆素偶联物,通过细胞体内酯水解酶的作用释放出硫辛酸及香豆素达到治疗及示踪的一体化。细胞实验显示,该偶联物对肿瘤细胞的增殖抑制活性是硫辛酸的10倍以上,可以有效地清除肿瘤细胞增殖转移赖以生存的低浓度活性氧,其诱导的凋亡为硫辛酸的3.5倍,体现出硫辛酸与香豆素的协同作用,另外给药6 h,可见到强烈的蓝色荧光产生。总之,本实验合成了一种可示踪药物水解释放的硫辛酸-香豆素偶联物,为硫辛酸衍生物的开发提供了一种新的思考。

