淫羊藿总黄酮促进成骨分化的类雌激素作用
林思文,谌少波,殷嫦嫦,邵银初*
1中国人民解放军联勤保障部队第九〇八医院,南昌330001;2九江学院,九江 332000
骨质疏松症常见于绝经后妇女,目前学术上普遍观点认为:绝经后妇女雌激素水平逐渐下降,成骨细胞增生减弱,破骨细胞过度活跃,造成全身性骨量减少、骨组织显微结构破坏,从而显著增加了骨折的风险,影响生存质量。因此,研究如何延缓绝经后妇女骨质疏松症的发展进程,渐渐成为了老年医学领域的一个热门话题。淫羊藿(Epimedii Folium)作为一味祖国传统中药,自古以来为补肾阳、强筋骨、祛风湿之要药。其中,淫羊藿总黄酮(total flavonoids of Epimedii Folium,EF)为从淫羊藿植株中提取的黄酮类化合物,我们的前期研究发现EF具有促进大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)成骨分化的作用[1]。此次试验旨在研究EF促进BMSCs向成骨细胞分化是否与雌激素受体(estrogen receptor,ER)有关,从而确定其是否具有类雌激素作用,对于探讨激素替代疗法治疗绝经后骨质疏松症有积极意义。
1 材料与试剂
1.1 细胞
购自江阴齐氏生物科技有限公司第1代hBMSCs。
1.2 主要试剂及耗材
EF(九江学院药学院提供,纯度>95%,用DMSO配置成40 mg/mL的储存液于4 ℃备用);ICI182780(Selleck公司);DMSO、琼脂糖、TAE、PBS粉、青链霉素(北京索莱宝科技有限公司);胎牛血清(FBS)、0.25%胰蛋白酶-EDTA(美国Gibco公司);α-MEM培养基(美国Hyclone公司);茜素红粉(西陇化工股份有限公司);GREENspin组织/细胞RNA提取试剂盒(北京庄盟国际生物基因科技有限公司);Hi Fi-MMLV cDNA第一链合成试剂盒(北京康为世纪生物科技有限公司);2×Taq Master Mix、DNA Marker:(北京近岸科技有限公司);基因引物(南京金斯瑞生物科技有限公司)。
1.3 主要仪器
超净工作台(苏州净化设备有限公司);三气细胞培养箱(德国Eppendorf公司);TS100-F 倒置相差显微镜(日本Nikon公司);FACS Calibur流式细胞仪(BD公司);酶标仪(美国BioTek公司);凝胶成像系统(美国SIM公司);冷冻高速离心机(珠海黑马医学仪器有限公司);Mini水平电泳槽(美国BIO-RAD公司);PCR仪(杭州博日科技有限公司)。
2 实验方法
2.1 hBMSCs的培养、传代及细胞形态学观察
将购自江阴齐氏生物科技有限公司的含第1代hBMSCs的培养瓶吸弃多余培养基后,置于37 ℃、5%CO2培养箱中继续培养,待贴壁细胞融合达80~90%时,用0.25%胰蛋白酶-EDTA消化细胞,PBS洗涤细胞后加入适量完全培养基(含1%双抗及10%FBS的α-MEM培养基)充分吹打混匀,以1∶2分装于两个培养瓶中,继续置于37 ℃、5%CO2培养箱中培养,以此方法继续传代,细胞逐渐纯化。待细胞量满意后可用含10%FBS的DMSO冻存液冻存部分细胞备用。用倒置相差显微镜观察各代细胞不同时间的细胞形态。
2.2 流式细胞仪鉴定hBMSCs
取第4代hBMSCs进行细胞鉴定。待第4代hBMSCs贴壁融合达80%~90%时,以不含EDTA的0.25%胰蛋白酶消化细胞,离心(1000 rpm,5 min)后弃上清,用含10%FBS的PBS离心洗涤细胞两遍,再用含10%FBS的PBS重悬细胞,调整细胞数至1×106/mL,以每管80 μL分装至4个1.5 mL EP管中,分别加入FITC标记的抗人CD90和CD45单抗,并设置同型对照组(含FITC标记的抗HLA-DR单抗)、空白对照组,室温避光30 min后以含10%FBS的PBS离心洗涤细胞两遍,最后每管加入500 μL PBS充分重悬,2 h内上流式细胞仪检测。
2.3 CCK-8法检测EF对hBMSCs增殖的影响
取第4~6代hBMSCs,待细胞贴壁融合达80%~90%后,以0.25%胰蛋白酶-EDTA消化细胞,PBS离心洗涤两次后,加入培养基(含10%FBS的α-MEM)将细胞充分重悬并计数。调整细胞数至1×104/mL,以每孔200 μL接种于96孔板中,置入37 ℃、5%CO2培养箱中孵育24 h,弃去培养基,分别加入含不同浓度(0、2.5、5、10、20、40 μg/mL)EF(以事先配置好的储存液加入空白培养基配置含40 μg/mL EF的含0.1%DMSO培养基,再与含0.1%DMSO不含药物培养基不同比例混合配置成目标浓度)、均含0.1%DMSO的培养基,每孔200 μL。每个浓度设置4个复孔及1个不含细胞的对照孔。分别在第12、24、48、72 h每孔加入10μL的CCK-8溶液,37 ℃孵育2 h后上酶标仪在450 nm光波长检测各孔吸光度A。计算各浓度吸光度OD=A药物-A对照,并绘制成图表。
2.4 EF促进hBMSCs成骨分化的细胞形态观察
取第4~6代hBMSCs消化后按105/mL接种于细胞数六孔板中,24 h后,更换加有10 μg/mL EF的含10%FBS的α-MEM培养基(含0.1%DMSO),并设置空白对照组(含10%FBS的α-MEM培养基,含0.1%DMSO),每3天换液一次,诱导14天,定期利用倒置相差显微镜观察细胞形态。
2.5 茜素红染色
取第4~6代hBMSCs消化后按105/mL接种于细胞数六孔板中,24 h后,按以下分组更换培养基:对照组(含10%FBS的α-MEM培养基)、EF组(添加20 μg/mL EF的含10%FBSα-MEM培养基)、EF+ICI182780组(添加10 μg/mL EF及1 μmol/L ICI182780的含10%FBSα-MEM培养基),每3天换液一次,诱导14天。弃去培养基,PBS清洗2次,95%乙醇固定10min,三蒸水洗2遍,0.1%茜素红(pH8.3)于37 ℃下反应30 min,PBS冲洗两遍后置于倒置相差显微镜下观察。
2.6 RT-PCR检测OPN、ALP基因的表达
按以上分组作用于细胞,诱导14天后消化并收集细胞,按RNA提取试剂盒说明提取细胞RNA,按逆转录试剂盒说明合成cDNA,加入上下游引物(序列见表1)及Taq扩增,将产物在1%琼脂糖凝胶上进行电泳后在凝胶成像系统紫外灯下拍照。并用Image J软件分析条带灰度。
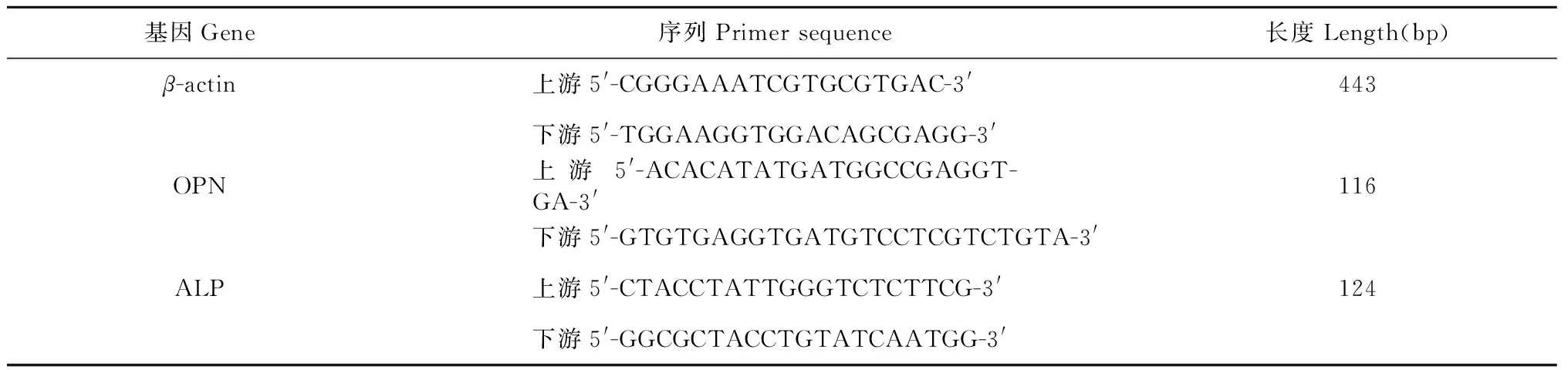
表1 基因引物序列
2.7 统计学处理
3 结果
3.1 hBMSCs培养、传代及细胞形态学观察
传代细胞中,单个细胞呈梭形、多角形贴壁生长,有形态不同的突起,相互之间无规律生长(见图1-1);随着细胞数量的增多,细胞逐渐汇合,突起逐渐消失,细胞排列逐渐规律,呈成纤维细胞样(见图1-2、图1-3);8~9天后,细胞逐渐铺满瓶底,细胞之间连接紧密,呈旋涡状、鱼群样贴壁生长(见图1~4)。
3.2 流式细胞仪检测细胞表面抗原
经传代后的hBMSCs经流式细胞仪鉴定,骨髓间充质干细胞标志CD90表达呈阳性(阳性率92.36%),而造血干细胞标志CD45表达呈阴性(95.40%),结果表明细胞均一性良好(图2)。
3.3 EF对hBMSCs增殖的影响
不同浓度EF作用于hBMSCs后,对hBMSCs的增殖作用存在不同:高浓度组(10、20、40 μg/mL组)对细胞增殖均有不同程度的抑制作用,并且浓度越高、抑制作用越明显;而低浓度组(2.5和5 μg/mL组)反而对细胞增殖存在一定程度的促进作用(图3)。我们选用对细胞有轻微抑制作用的10 μg/mL进行细胞诱导实验。

图1 P3代hBMSCs细胞形态观察(10×10)Fig.1 Morphological observation of P3 generation hBMSCs (10×10)注:1.培养第3天;2.培养第5天;3.培养第7天;4.培养第9天。Note:1.3 days of culture;2.5 days of culture;3.7 days of culture;4.9 days of culture.

图2 细胞表面CD90、CD45表达情况Fig.2 Expression of CD90,CD45 on cell surface

图3 不同浓度EF作用hBMSCs不同时间的细胞吸光度值ODFig.3 Cell absorbance OD of hBMSCs exposed to different concentrations of EF at different time
3.4 EF促进hBMSCs成骨分化的细胞形态观察
EF作用于hBMSCs 后,3~7天内,细胞形态逐渐由长梭形向立方形或多边形转变;7天后随着细胞的增殖,细胞开始重叠,相互聚集成团并逐渐开始形成散在的细胞结节,细胞周围形成沉积的钙盐,成团状或条索状;14天后,细胞聚集成典型的骨小节结构,为大小不等的不规则形,正常的原有细胞形态消失(图4)。

图4 EF作用hBMSCs的细胞形态观察Fig.4 Morphological observation of hBMSCs induced by EF注:1.诱导第3天(10×10);2.诱导第7天(10×10);3.诱导第14天(10×10);4.诱导第14天(10×40)。Note:1.3rd day (10 × 10);2.7th day (10 × 10) ;3.14th day (10 × 10);4.14th day (10 × 40).
3.5 钙结节的茜素红染色表现
茜素红能将钙结节染成红色。实验结果表明:与对照组相比,EF能促进细胞形成大量的钙结节(图5-1和5-2),而当在有雌激素受体阻滞剂ICI182780存在的情况下,EF的这种促进细胞形成钙结节的能力明显受抑制(图5-3)。

图5 茜素红染色后镜下观(10×10)Fig.5 Alizarin red staining under microscope (10 × 10)注:1.对照组;2.EF组;3.EF+ICI182780组。Note:1.Control group;2.EF group;3.EF+ICI182780 group.
3.6 成骨相关基因OPN、ALP的表达
通过检测OPN、ALP基因的表达情况表明:与对照组相比,EF能明显上调OPN、ALP基因的表达(P<0.05),而在EF加入ICI182780 以后,OPN、ALP基因的表达均明显下降(P<0.05)(图6)。

图6 OPN、ALP mRNA的表达结果Fig.6 The expression of OPN,ALP mRNA注:1.对照组;2.EF组;3.EF+ICI182780组。与对照组比较,*P<0.05;与EF组比较,#P<0.05。Note:1.Control group;2.EF group;3.EF+ICI182780 group.Compared with control group,*P < 0.05;Compared with EF group,#P < 0.05.
4 讨论
黄酮类化合物的类雌激素作用已在很多实验中得到证实[2-5]。利用黄酮类化合物的这一特征,学者们逐渐将其与治疗绝经后骨质疏松症联系起来[6,7],我们选用EF对hBMSCs进行诱导,来阐述这一发现。
实验首先使用不同浓度EF作用于细胞,探寻最合适的EF诱导浓度。本研究发现,较高浓度的EF作用于BMSCs主要表现为细胞毒作用,这可能与浓度高的EF增加细胞外渗透压使细胞脱水死亡有关,而低浓度的EF细胞毒作用不明显,甚至有促进其增殖的作用。针对增殖和分化在一定程度上互相抑制的特点,我们选用轻度抑制hBMSCs增殖的EF浓度(即10 μg/mL)进行诱导成骨分化实验。为了验证EF的类雌激素作用,实验设置了EF+ICI182780组,ICI182780作为ER的特异性抑制剂,可以抑制ER受体被激活产生的一系列生物学效用,本实验从细胞形态、钙结节染色、基因表达等多方面进行了结果的阐述。较高浓度的钙、磷、镁沉积并附着于成骨细胞胞浆内的线粒体嵴表面,茜素红可与其中的钙离子螯合,产生深红色或紫红色复合物,根据着色情况可以判断钙盐沉积(钙结节)的状况,从而一定程度上知道各实验组成骨分化的效率。从本实验结果可以看出,EF能有效地促进hBMSCs向成骨样细胞分化并使产生明显矿化钙结节,在添加ICI182780后,这种现象明显受抑制。OPN(骨桥蛋白,osteopontin)与ALP(碱性磷酸酶,alkaline phosphatase)均在骨组织中呈现高表达[8,9],成骨细胞浆内富含大量的OPN和ALP,血液中OPN和ALP的浓度可以反映成骨细胞活性。本实验结果表明,EF能上调OPN、ALP基因的表达,而ICI182780却能抑制EF的这种上调作用。以上实验结果初步表明:EF具有通过上调ER的表达从而促进hBMSCs向成骨分化的作用。这为EF诱导hBMSCs成骨分化的类雌激素所用提供了一个良好的依据。
当然,基于本实验的结果,有后续更为广阔的空间供我们思考。为更好地验证EF的类雌激素作用,实验可以增加雌激素组作为对照,也可以将ER细分到ERα和ERβ两个亚型上进行进一步的研究;甚至后期可以尝试寻找一条相关的下游信号通路,研究具体的分子机制。

