紫娟茶化学成分及其抗炎抗氧化活性研究
李明超,桂浩鑫,李晓蕾,刘 莹,李宇倩,徐天瑞,郝 倩*
1昆明理工大学生命科学与技术学院 云南省高校靶点药物筛选与利用重点实验室,昆明 650500;2昆明理工大学分析测试中心,昆明 650093
“紫娟”为山茶科(Theaeeae)山茶属(Camellia)茶组植物(Camelliasinensis(L.) O.Kuntze),是云南大叶茶变种,因其芽尖、叶、茎、花萼、花梗呈紫色,其茶汤呈淡紫色而得名[1]。紫娟有云南大叶群体国家级茶树良种单株培育而成[2],与常规大叶绿茶相比,其所含花青素、黄酮类、咖啡碱、锌的含量较高[3]。研究发现紫娟茶具有抗氧化[4]、抗炎[5]、降压[6]、降脂[7]、抗增殖[8]及抑菌[9]等功效,其化学成分主要含有花青素类、黄酮及其苷类和儿茶素类[2,3]。本文对紫娟甲醇提取物进行分离纯化,旨在丰富该植物的化学成分研究。此外,对分离得到的化合物进行了抗炎和抗氧化活性测定,为紫娟茶的进一步开发利用提供理论参考。
1 仪器与材料
Avance III 600 MHz超导核磁共振仪(瑞士Bruker BioSpin公司),ODS(日本YMC维美希公司),Sephadex LH-20(美国Pharmacia公司),Diaion HP 20SS(日本三菱公司),Toyopearl HW40F(日本东曹公司),高效液相色谱仪(日本岛津制作所),80~100目和200~300目柱色谱硅胶(青岛海洋化工厂),硅胶GF254薄层预制板(青岛海洋化工厂),超纯水仪(南京权坤生物科技有限公司),超声波清洗机(宁波新芝生物科技股份有限公司),三用紫外分析仪(上海力辰仪器科技有限公司),氘代试剂(美国剑桥CIL(同位素标准品)公司),色谱纯甲醇和乙腈(美国BCR公司),其他试剂为分析纯(西陇化工公司(四川)),一氧化氮测定试剂盒(碧云天生物技术公司)。
紫娟茶2017年购买于云南省西双版纳傣族自治州勐海县,样品由昆明理工大学生命科学与技术学院郝倩博士鉴定,样品标本(ZJ-1701)存于昆明理工大学基础化学实验中心403实验室。
2 实验方法
2.1 提取和分离
紫娟茶1.5 kg,用3倍量的70%的甲醇水(含1%的TFA)超声提取4次,过滤,减压浓缩后经乙酸乙酯萃取,得乙酸乙酯相(AcOEt Fr.)182.4 g,水相(Aq Fr.)256.5 g。取乙酸乙酯部分(14.2 g),经过Diaion HP 20SS柱色谱甲醇水(0%→100%)梯度洗脱,得到6个组分Fr.1~Fr.6。Fr.2(0.21 g)采用Sephadex LH-20凝胶柱色谱乙醇-水-丙酮(1∶0∶0、9∶1∶0、8∶2∶0、6∶4∶0、0∶1∶1)洗脱,得到化合物1(10.7 mg)(图1)。Fr.4(1.20 g)经Diaion HP 20SS柱色谱甲醇-水(0%→100%)梯度洗脱,得到Fr.4-1~Fr.4-9。其中Fr.4-3(651.8 mg)经Sephadex LH-20凝胶柱色谱乙醇-水-丙酮(1∶0∶0、9∶1∶0、8∶2∶0、6∶4∶0、0∶1∶1)洗脱,分离得到化合物2(3.1 mg)和化合物3(40.4 mg),Fr.4-5(66.4 mg)经ODS柱色谱甲醇-水(20%→100%)得到化合物4(2.8 mg)和化合物5(2.1 mg);Fr.4-9经硅胶柱色谱(氯仿-甲醇)纯化得到化合物6(31.5 mg)。Fr.5(3.39 g)Toyopearl HW40F柱色谱甲醇-水(20%→100%)梯度洗脱,合并相同流分得到Fr.5-1~Fr.5-3,Fr.5-1经 ODS柱色谱甲醇-水(20%→100%)洗脱得化合物7(9.7 mg),Fr.5-2分别经Sephadex LH-20凝胶柱色谱乙醇-水-丙酮(1∶0∶0、9∶1∶0、8∶2∶0、6∶4∶0、0∶1∶1)和ODS柱色谱甲醇-水(20%→100%)进行洗脱,分离得到化合物化合物8(182.9 mg)。取水相部分(46.5 g),经Diaion HP 20SS柱色谱甲醇-水(0%→100%)梯度洗脱,得到9个组分Fr.w1~Fr.w9。Fr.w2(4.72 g)依次经Toyopearl HW40F柱色谱甲醇-水(20%→100%),ODS柱色谱甲醇-水(20%→100%)梯度洗脱得到化合物9(12.1 mg)。Fr.w5(1.87 g)经Toyopearl HW40F柱色谱甲醇-水(20%→100%),ODS柱色谱甲醇-水(20%→100%)梯度洗脱得到化合物10(10.8 mg)和化合物11(2.2 mg)。Fr.w7(2.31 g)经Diaion HP 20SS柱色谱甲醇-水(20%→100%)得到化合物12(12.0 mg)。Fr.w9(10.79 g)经Sephadex LH-20葡聚糖凝胶柱色谱尿素-丙酮洗脱得到聚合物(Polymer Fr.)3.01 g。
2.2 活性测定
2.2.1 抗炎活性测定
将小鼠巨噬细胞RAW264.7按照6×104/mL的浓度铺于96孔板,37 °C、5%CO2的培养箱中常规培养于DMEM 培养基中,18 h后加入浓度0.8 μg/mL脂多糖(LPS),反应24 h后,用磷酸盐缓冲液(PBS)洗去LPS,清洗两遍,之后加药处理。药物配置方法如下:紫娟茶粗提物、乙酸乙酯相、水相和聚合物按照5或50 μg/L的浓度溶解于无血清培养基;化合物1~12按照5和50 μmol/L的浓度溶解于无血清培养基。处理24 h后,使用碧云天生物技术公司生产的一氧化氮检测试剂盒(货号:062119191005),按步骤操作,使用酶标仪在540 nm下进行测定并计算出样品中的NO浓度。
2.2.2 抗氧化活性测定
将人肺泡上皮细胞A549按照6×104/mL的浓度铺于96孔板,37 °C、5% CO2的培养箱中常规培养于含有10%的血清的DMEM培养基中,18 h后加入浓度0.8 μg/mL过氧化氢(H2O2),反应24小时后,用磷酸盐缓冲液(PBS)洗去H2O2,清洗两遍,之后加药处理。药物配置方法如下:紫娟茶粗提物、乙酸乙酯相、水相和聚合物按照5或50 μg/L的浓度溶解于无血清培养基;化合物1~12按照5 μmol/L和50 μmol/L的浓度溶解于无血清培养基。
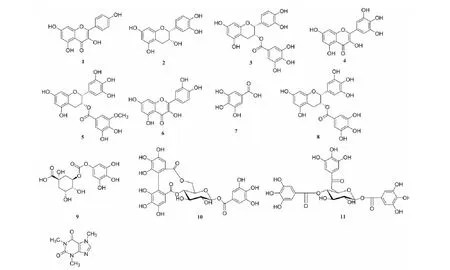
图1 化合物1~12的结构Fig.1 The structures of compounds 1-12
加药处理24 h后,1 000 rpm离心5 min,收集细胞沉淀。用活性氧特异性探针DCFH-DA(无血清培养基1∶1 000稀释)重悬细胞,每5 min混匀1次,共染色20 min,用荧光酶标仪检测荧光强度(激发光波长488 nm,发射光波长525 nm)。
3 实验结果
3.1 结构鉴定
化合物1黄色粉末;分子式为:C15H10O6;1H NMR(600 MHz,CD3OD)δ:8.08(2H,d,J= 8.7 Hz,H-2',H-6'),6.90(2H,d,J= 8.8 Hz,H-3',H-5'),6.38(1H,s, H-6),6.18~6.15(1H,m,H-8)。以上数据与文献[10]报道一致,故鉴定化合物1为山柰酚。
化合物2灰白色粉末;分子式为C15H14O6;1H NMR(600 MHz,CD3OD)δ:6.87(1H,d,J= 1.8 Hz,H-2′),6.70(1H,dd,J= 8.2,1.8 Hz,H-5′),6.65(1H,d,J= 8.1 Hz,H-6′),5.84(1H,d,J= 2.3 Hz,H-8),5.81(1H,d,J= 2.3 Hz,H-6),4.09~4.06(1H,m,H-2),3.25(1H,s,H-3),2.78~2.74(1H,m,H-4a),2.63(1H,dd,J= 16.7,2.8 Hz,H-4b)。以上数据与文献[11]报道一致,故鉴定化合物2为(+)-表儿茶素。
化合物3白色无定形粉末;分子式为C22H18O10;1H NMR(600 MHz,CD3OD)δ:6.85(2H,s,H-2′′,6′′),6.84(1H,d,J= 2.0 Hz,H-2′),6.71(1H,dd,J= 8.3,1.9 Hz, H-5′),6.60(1H,d,J= 8.2 Hz,H-6′),5.87(2H,q,J= 2.3 Hz,H-6,8),5.42(1H, m,J= 4.2,2.3 Hz,H-3),4.91(1H,s,H-2),2.89(1H,dd,J= 17.3,4.6 Hz,H-4a),2.75(1H,dd,J= 17.4,2.1 Hz,H-4b)。以上数据与文献[12]报道一致,故鉴定化合物3为(-)表儿茶素没食子酸酯。
化合物4黄色粉末;分子式为C15H10O8;1H NMR(600 MHz,CD3OD)δ:7.34(2H,s,H-2′,6′),6.37(1H,d,J= 2.1 Hz,H-8),6.17(1H,d,J= 2.1 Hz,H-6);13C NMR(150MHz,CD3OD)δ:175.8(C-4),164.1(C-7),161.1(C-5),156.7(C-9),146.5(C-2),145.3(C-3′,5′),135.9(C-4′),135.5(C-3),107.0(C-2′,6′),103.0(C-10),121.6(C-1′),97.7(C-5),92.9(C-8)。以上数据与文献[13]报道一致,故鉴定化合物4为杨梅素。
在DH6101伏安特性仪实验平台上,伏安法测二极管2AP10和1N4007伏安特性采用电流表内接法和电流表外接法,电路示意如图1所示。电源电压在0~10 V内调节。通过对这两种方法电路图分析,发现这两种实验方法都会存在误差,其主要来源于电表内阻接入电路而引起。在电流表外接实验中,电压表和电流的读数分别是U和I时,由于电压表内阻会进行分流,这样实际通过二极管的电流I'是小于I,它们之间满足下面的关系式[6]:
化合物5白色粉末;1H NMR(600 MHz,CD3OD)δ:6.97(1H,d,J= 1.9 Hz, H-2″),6.92(1H,d,J= 1.9 Hz,H-6″),6.86(1H,d,J= 2.0 Hz,H-2′),6.71(1H,dd,J= 8.3,1.9 Hz, H-6′),6.61(1H,d,J= 8.2 Hz,H-5′),5.92~5.79(2H,m,H-6,8),5.41(1H,dt,J= 4.3,2.6 Hz,H-2),4.97(1H,s,H-3),3.72(3H,s,-OCH3), 2.91(1H,dd,J= 17.3,4.6 Hz,H-4a),2.79(1H,dd,J= 17.4,2.5 Hz,H-4b),13C NMR(150 MHz,CD3OD)δ:166.1(C=O),155.8(C-9),156.5(C-5,7),147.6(C-3″,5″),144.6(C-3,4′),139.1(C-4″),130.1(C-1′),120.0(C-1″),117.7(C-6′),114.5(C-5′),113.6(C-2′),110.4(C-2″,6″),97.89(C-10),95.0(C-6),94.3(C-8),77.1(C-2),68.9(C-3),25.2(C-4)。以上数据与文献[14]报道一致,故鉴定化合物5为表没食子儿茶素-3-O-(3″-O-甲基)没食子酸酯。
化合物6黄色粉末;分子式为C15H10O7;1H NMR(600 MHz,CD3OD)δ:7.73(1H,d,J= 2.1 Hz,H-2′),7.63(1H,dd,J= 8.5,2.1 Hz,H-6′),6.88(1H,d,J= 8.5 Hz,H-5′),6.39(1H,d,J= 2.0 Hz,H-8),6.18(1H,d,J= 2.0 Hz,H-6);13C NMR(150 MHz,CD3OD)δ:175.9(C-4),164.1(C-7),161.1(C-5),156.8(C-2),147.3(C-9),146.5(C-3′),144.8(C-4′),135.8(C-3),122.7(C-3),120.2(C-6′),114.8(C-2′),114.5(C-5′),103.1(C-10),97.8(C-6),92.9(C-8)。以上数据与文献[15]报道一致,故鉴定化合物6为槲皮素。
化合物7无色针状结晶;分子式为 C7H6O5;1H NMR(600 MHz,Methanol-d4)δ:6.87(2H,s,H-2,6)。以上数据与文献[15]报道一致,故鉴定化合物7为没食子酸。
化合物8白色粉末;分子式为C22H18O11;1H NMR(600 MHz,CD3OD)δ:6.96(2H,s,H-2″,6″),6.52(2H,s,H-2′,6′),5.98(1H,s,H-6),5.56~5.49(1H,m,H-3),2.99(1H,dd,J= 17.2,4.6 Hz,H-4a),2.86(1H,dd,J= 17.4,2.2 Hz,H-4b)。以上数据与文献[16]报道一致,故鉴定化合物8为表没食子儿茶素-3-O-没食子酸酯。
化合物9白色粉末;分子式为C14H16O10;1H NMR(600 MHz,CD3OD)δ:7.00(2H,s,H-2″,6″),5.28(1H,q,J= 6.4 Hz,H-3),4.16(1H,dt,J= 7.2,3.5 Hz, H-5),2.28(2H,dd,J= 12.7,3.6 Hz,H-2),2.15(1H,dd,J= 13.4,3.6 Hz,H-6a), 1.97(1H,dd,J= 13.0,8.5 Hz,H-6b)。以上数据与文献[17]报道一致,故鉴定化合物9为3-O-没食子酰基奎宁。
化合物10浅棕色粉末;分子式为C27H22O18;1H NMR(600 MHz,CD3OD)δ:7.14(2H,s,H-2″,6″),6.69(1H,s,HHDP-H),6.55(1H,s,HHDP-H),5.67(1H,d,J= 8.1 Hz,H-1),5.23(1H,dd,J= 13.3,6.4 Hz,H-6),4.88~4.82(1H,s,H-4),4.08~4.02(1H,m,H-5),3.82(1H,d,J= 12.7 Hz,H-3),3.75~3.69(1H,m,H-6),3.62(1H,d,J= 8.2 Hz,H-2)。以上数据与文献[18]报道一致,故鉴定化合物10为小木麻黄素。
化合物11淡黄色粉末;分子式为C27H24O18;1H NMR(600 MHz,CD3OD)δ:7.14(2H,s,H-2′′′,6′′′),7.09(2H,s,H-2′′,6′′),7.06(2H,s,H-2′,6′),5.78(1H,d,J= 8.2 Hz,H-4),5.22(1H,t,J= 9.7 Hz,H-4),4.43(1H,dd,J= 12.4,2.1 Hz,H-6),4.21(1H,dd,J= 12.4,4.8 Hz,H-1),4.05(1H,ddd,J= 10.0,4.8,2.2 Hz,H-3),3.83(1H,t,J= 9.3 Hz,H-5);13CNMR(150 MHz,CD3OD)δ:166.6(C-7′),166.0(C-7′′′),165.5(C-7′),145.1(C-5′),145.1(C-5′′′),145.0(C-5′′),139.0(C-4′′),138.6(C-4′),138.4(C-4′′′),119.7(C-1′′),119.5(C-1′),119.1(C-1′′′),109.1(C-2′,6′),108.9(C-2′′, 6′′),108.8(C-2′′′,6′′′),94.4(C-1),74.6(C-5),73.0(C-3),72.8(C-2),70.4(C-4),62.1(C-6)。以上数据与文献[19]报道一致,故鉴定化合物11为1,4,6-三-O-没食子酰基-β-D-葡萄糖。
化合物12白色粉末;分子式为C8H10N4O2;1H NMR(600 MHz,CD3OD)δ:7.76(1H,s),3.90(3H,s)。以上数据与文献[20]报道一致,故鉴定化合物12为咖啡因。
3.2 活性测定结果
3.2.1 抗炎活性测定结果
本实验运用脂多糖(LPS) 诱导的小鼠巨噬细胞生成的NO 细胞模型对紫娟茶粗提物、乙酸乙酯相、水相和聚合物进行了抗炎活性测定,以LPS为阳性对照,测试浓度为5和50 μg/L;同时,对化合物1~12进行了抗炎活性测定,以LPS为阳性对照,测试浓度为5和50 μmol/L,通过测定粗体物或化合物抑制NO的生成来评价其抗炎活性。
结果(见图2)显示,5或50 μg/L浓度下粗提物、乙酸乙酯相,50 μg/L的聚合物均有一定的抗炎活性。在5和50 μmol/L的浓度下,化合物1、3、4、6、8~11均对NO抑制率显著,表明其具有显著的抗炎活性。

图2 紫娟茶提取物和化合物1~12抗炎活性测定Fig.2 Anti-inflammatory activity of Zijuan tea extract and compounds 1-12
3.2.2 抗氧化活性测定结果
结果见图3,5 μg/L的粗提物、乙酸乙酯相,50 μg/L乙酸乙酯相、聚合物均具有显著的抗ROS活性,表明其具有明显的抗氧化活性。化合物1~3、11~12抗ROS活性均显著,表现出明显的抗氧化活性。其中化合物11的抗氧化活性最明显。
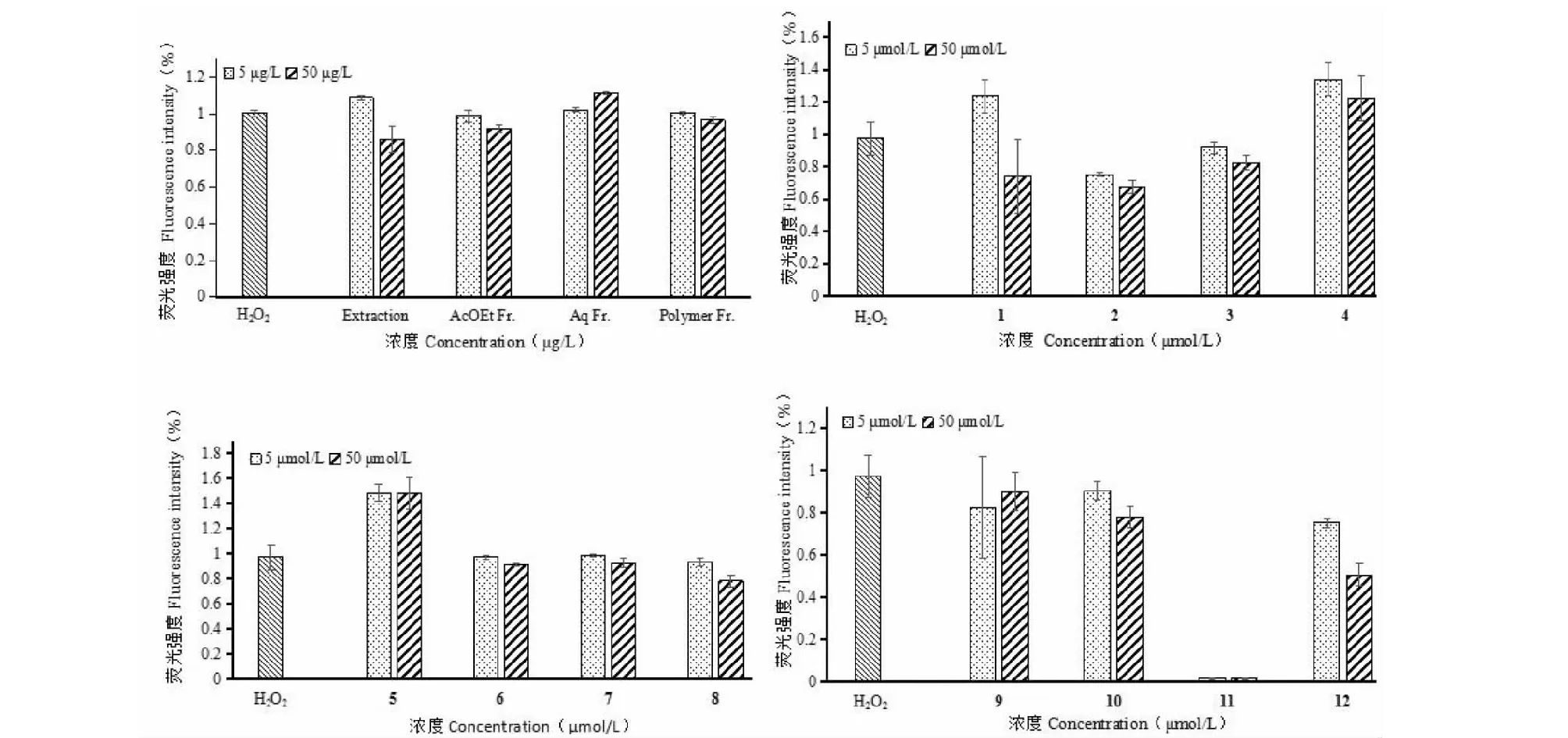
图3 紫娟茶提取物和化合物1~12抗氧化活性测定Fig.3 Determination of antioxidative activity of Zijuan tea extract and compounds 1-12
4 结论
目前,对紫娟茶中的功能性成分研究较少,因此本文对紫娟茶的化学成分进行了系统研究。从中共分离鉴定了12个化合物以及大量聚合物,其中3个黄酮类化合物(1、4、6)、4个儿茶素类化合物(2、3、5、8),2个单宁类化合物(10和11),1个奎宁类化合物(9),1个没食子酸(7)以及1个咖啡因(12)。通过抗炎、抗氧化活性实验发现化合物11表现出良好的抗氧化活性,化合物1、3、4、6、8~11均具有显著的抗炎活性。此外,从紫娟茶水相分离得到的聚合物中含有抗炎、抗氧化活性成分,今后可深入研究其组成及药理活性。本文为紫娟茶的综合开发和利用提供了一定理论基础和依据。

