应用腔内血管成形术更换血液透析长期导管
张继强 陈 峥 常保超 尹晓丽 刘 磊 陈卫东
目前,临床上仍有较多维持性血液透析(MHD)患者选择带隧道和涤纶套透析导管(tunnel-cuffed catheter,TCC)作为主要透析通路,研究显示长期留置导管明显增加导管相关中心静脉病变(CVD)如狭窄或闭塞并发症的发生率[1];且随着患者生存时间的延长,导管相关并发症如感染、破损、功能不良、上腔静脉综合征发生率也会越来越高;而长期留置TCC后发生的黏连、嵌顿也是拔管及再置管失败的主要原因[2],且处理上述并发症较初次置管更复杂困难且风险更大;既往治疗此类患者临床多采用拔除导管或保留残端同时另外建立血管通路或转为腹膜透析等手段,近几年工作中发现采用经皮腔内血管成形术(PTA)治疗能很好保留该透析通路,可以为导管嵌顿和再置管困难患者提供一种较好的治疗选择。现将我们采用DSA下腔内治疗在TCC患者更换术中的疗效及应用体会报道如下。
对象和方法
研究对象选取2017年10月至2019年10月蚌埠医学院第一附属医院肾内科收治的12例合并TCC导管并发症患者,病例选择条件:(1)导管留置时间较长,临床判断发生导管嵌顿及导管鞘形成可能性大者(如导管侧前臂水肿或胸壁静脉曲张等);(2)导管反复感染和多次更换者;(3)导管不能使用且能耐受手术者;(4)既往血管造影检查提示有中心静脉病变者。排除标准:(1)因基础疾病及并发症原因不能耐受手术者;(2)中心静脉完全闭塞者;(3)造影剂过敏者。本研究所有患者术前均签署知情同意书。
手术方法具体方法如下:患者摆好体位并行心电图、血压及血氧饱和度监护,暴露手术部位并充分消毒皮肤及外部导管,1%利多卡因局部浸润麻醉后切开皮肤游离涤纶套及导管,先尝试拔除导管,如在拔除过程中遇到阻力或放置撕脱鞘过程不顺利则判断需要腔内治疗。后续DSA下操作:先自一侧导管腔注入造影剂观察造影剂通过情况明确中心静脉有无病变,后沿一侧导管腔内送入超滑导丝(直径0.035英寸),导丝J形尖端送入中心静脉足够长度;沿导丝将直径4 mm高压球囊送至导管尖端超出1.0 cm左右,加压(泵压力约10 atm)球囊使管尖段与血管壁的黏连松解,球囊可选择由小到大直径并自管尖渐进式全程腔内扩张,一次扩张效果不好时可多次两腔轮换扩张,直至导管拔出顺利,对存在中心静脉狭窄病人的采用7~10 mm直径球囊继续行导管鞘及静脉狭窄处扩张,同时充分扩张导管入血管部分,使带撕脱鞘扩张器能更顺利进入血管,注意在导管入口处用血管钳钝性分离导管使拔管更顺利;撕脱鞘置入后拔出鞘芯置入导管,使管尖超越原导管管尖,抽吸血流并行造影后通畅予缝合包扎伤口。注意观察扩张后再造影以确认病变血管达到目标,导管置入后再次造影确认导管位置及通畅性。
导管型号12例患者原导管型号有Quinton Permcath顶端阶梯式导管、Palindrome顶端对称式开口导管及Able临时透析导管。再置管型号均为Palindrome导管,长度据患者身高及置管部位决定。
随访所有术后患者每月进行电话随访,内容包括患者临床症状、相关指标如血流量、动脉压、静脉压等指标。
PTA术后疗效评价评价指标:(1)技术成功率:术后能拔除原嵌顿导管;狭窄段血管内径扩张后大于正常直径50%[3]。(2)再置管成功率:术后再置管成功例数/总例数。(3)导管功能:术后导管血流量达250 ml/min为效果良好。(4)术后导管初级通畅率定义为置管与为恢复导管功能而首次进行干预的时间间隔。
统计学方法所有资料采用《SPSS 19.0》统计软件进行处理,计量资料用均数±标准差表示,两组间比较采用t检验。术后导管初级通畅率采用Kaplan-Meier生存分析法。P<0.05为差异有统计学意义。
结 果
基线资料12例患者中女性5例,男性7例,年龄57.75±15.49岁,透析时间6.33±3.31年,原发病因:1例狼疮性肾炎、1例多囊肾、2例高血压肾损害、6例慢性肾炎、2例糖尿病肾病。更换导管原因:1例因导管侧壁磨损漏气,2例因导管涤纶套暴露伴出口感染,9例导管血流不畅(1例长期使用左侧股静脉导管后髂静脉狭窄直接在DSA下更换,1例右侧颈内静脉置管因上腔静脉血栓形成改行右侧股静脉置TCC,4个月后再出现功能不良)。12例患者中2例有过3次同侧导管更换史,9例有2次导管更换史;12例中术前有5例伴有胸壁静脉曲张,3例伴有同侧前臂轻度水肿。术中发现6例导管嵌顿予腔内治疗后拔除并成功再置管;6例顺利拔除导管但再置管困难,予行PTA后成功更换导管。患者临床资料及操作过程见表 1、2及图1~3。

表1 患者临床基本资料
随访及预后术后所有患者狭窄段血管内径均达到良好标准并且能够重新置管,置管成功率100%;术后12 例患者即时透析均显示导管功能良好,5 例伴胸壁静脉曲张患者均明显好转,3 例伴前臂水肿患者2 例出现明显改善。术后随访3 个月导管血流量均达到250 ml/min,导管初级通畅率100%,随访6个月(截止随访时间2020年4月)导管初级通畅率75%(图4)。
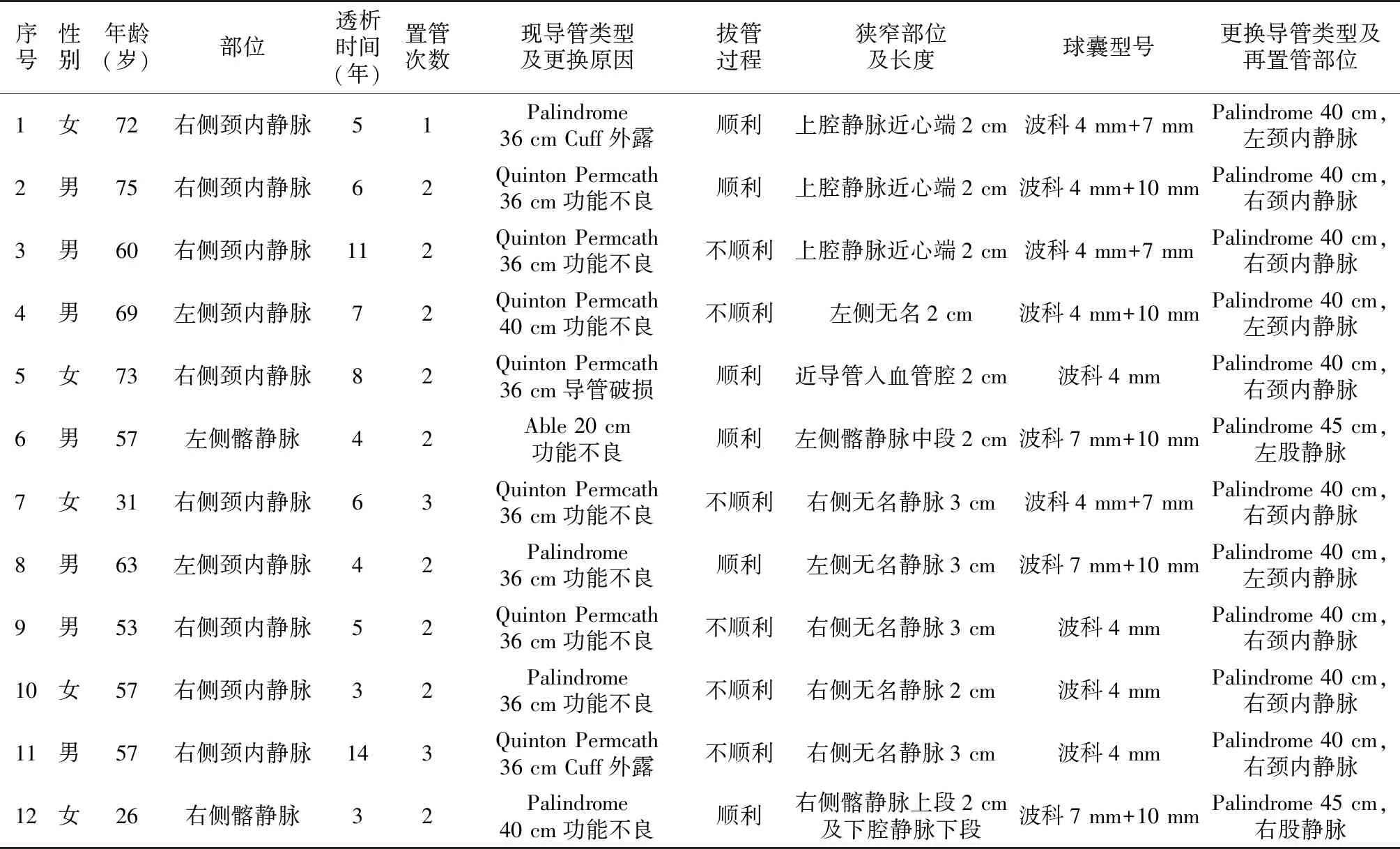
表2 患者行数字显影血管造影技术下导管更换手术相关临床资料
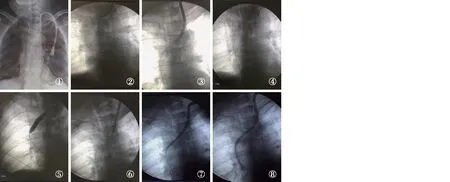
图1 左侧颈内静脉导管位置不良伴管周鞘形成患者行DSA下TCC置换术DSA:数字显影血管造影技术;TCC:涤纶套透析导管;①胸片提示导管全段位置不良;②DSA下拔出部分导管;③造影显示管尖端形成鞘样结构;④拔出导管后留置泥鳅导丝;⑤球囊扩张显示左无名静脉与上腔静脉交界处狭窄;⑥沿导丝进入导管带撕脱鞘扩张器进行血管入口扩张;⑦不拔出泥鳅导丝,沿导丝置入新导管;⑧新导管置入右心房,造影显示通畅
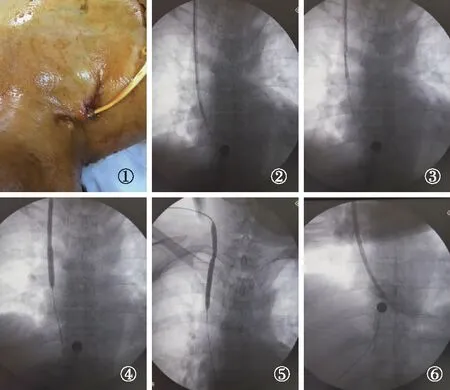
图2 右侧颈内静脉导管Cuff外露伴导管嵌顿患者行DSA下TCC置换术DSA:数字显影血管造影技术;TCC:涤纶套透析导管;①导管Cuff外露;②导管嵌顿拔出困难行球囊扩张;③造影显示管尖端形成鞘样结构;④拔出导管后再次7mm直径球囊全程扩张显示鞘形成;⑤球囊扩张血管出口段显示硬化狭窄;⑥新导管置入右心房,造影显示通畅
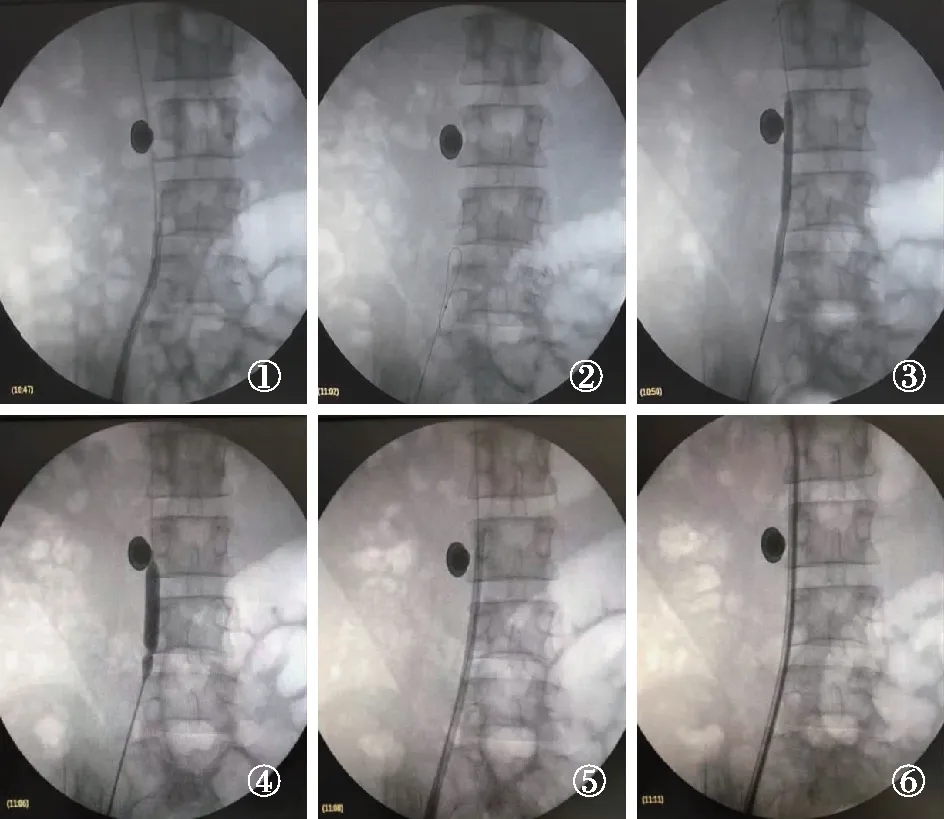
图3 右侧股静脉导管血流不畅患者行DSA下TCC置换术注DSA:数字显影血管造影技术;TCC:涤纶套透析导管;①原导管拔出顺利,新导管置入遇阻;②泥鳅导丝过狭窄段困难,予带球囊导丝进入下腔;③7mm直径球囊扩张髂静脉与下腔交界处显示狭窄;④10mm直径球囊再次全程扩张显示明显狭窄处;⑤带导丝顺利置入新导管进入下腔静脉;⑥新导管置入下腔静脉后造影显示通畅
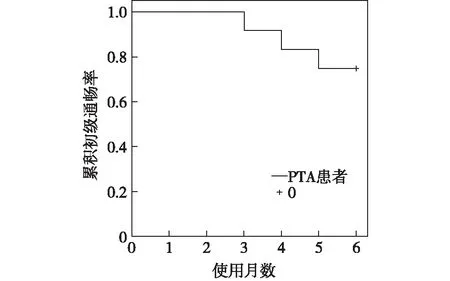
图4 初级通畅率Kaplan-Meier生存曲线PTA:腔内血管成形术
讨 论
MHD患者需要有高质量的血管通路才能进行充分的透析治疗,目前临床上无绝对理想血管通路类型[4],动静脉内瘘(AVF)仍是各类指南推荐的首选通路,但没有足够证据显示单纯为降低死亡率而让患者在透析第1年内将使用的中心静脉导管(CVC)转换成AVF或人造血管(AVG)[5]。调查发现TCC占我国患者通路类型第二位,且有近60%患者首次透析所采用的通路类型仍为CVC[6-7];美国2012年的调查数据也显示高达75%患者首次血液透析使用的是CVC[8]。实际在临床上大多数终末期肾病(ESRD)患者在透析生涯中都经历过中心静脉置管。而TCC的留置可明显增加中心静脉狭窄或闭塞风险,研究显示多次置管可使中心静脉狭窄发生率增加3倍[9],导管相关的感染也使CVD的发生率更高,比使用AVF和移植血管具有更高的风险[10-11]。
CVD是MHD患者严重的并发症,也是无法建立其他透析通路主要原因之一[12]。特别是导管与血管壁紧密黏连造成的导管嵌顿,给更换导管带来更大难度和风险。对已有导管功能不良及CVD患者,有研究建议通过纤维鞘剥离、更换导管或球囊扩张纤维鞘并更换新导管的方法来延长通路寿命[13]。既往也有采用开胸手术或直接离断皮下包埋等处理方法,但手术难度及风险大且代价过高,鲜有报道;而采取纤维鞘剥离或破坏手术操作成功率为78%~98%,无明显大的并发症,但费用较高及操作时间长[14];也有部分报道采用介入腔内治疗后沿导丝取出导管,用球囊破坏鞘后放置新导管也是一种有效方法[15-16]。对于以TCC导管作为通路的患者如何早期发现功能不良,指南定义为导管出现有效血流量<200 ml/min,或当血泵流速达到200 ml/min时动脉压<-250 mmHg和(或)静脉压>250 mmHg,或导管再循环>10%等情况[13,17];研究发现导管纤维鞘和血栓形成是其常见原因,而导管置入手术技巧和理想的导管位置可减少其发生率[18]。本研究大部分患者留置导管时间长,多数有多次置管及导管感染史,临床判断导管嵌顿可能性大,实际手术中发现多伴有中心静脉病变,再次验证导管留置时间、反复置管及感染是造成导管黏连嵌顿、功能不良的主要因素,针对此类患者尤其要提前预见手术中出现拔管困难和再置管失败可能。纳入研究的12例患者术前术中均充分评估可能出现的并发症,操作过程中严格按照相关规范均能够成功达到治疗目的,术后即时透析均显示导管功能良好,3个月后随访也有较好的预期,术后6个月初级通畅率达到75%,很好地达到临床治疗的目标[5],因此,对于预期生存时间和血管资源有限的患者,此法可明显延长带管时间和保证透析效果。
熟练的置管及腔内介入手术技术是保障此类患者安全和成功的关键,同时手术过程中细节的把握非常重要。术中在导丝进入血管不畅时,可顺导丝放置6Fr血管扩张导管或长期导管配套的扩张器再进行导丝的调整,以减少操作中的出血及操作中的风险,使导丝操作更容易;同时操作过程中注意避免导丝脱出原血管腔;手术过程严禁暴力操作,扩张器应在导丝的引导下沿着同一方向,导丝一旦打折即需要调整扩张器方向,使其沿导丝拐弯方向缓慢进入,特别需要关注颈部短、肥胖及颈部有瘢痕组织的患者,也可以通过更换导管自带的导丝或将泥鳅导丝置入到下腔或更深的位置以提供足够的支撑力,避免打折后扩张器损伤血管。对于在导管置入前撕脱鞘无法置入的情况,通常可以采用扩张入血管段皮肤切口和血管钳充分扩张皮下组织来解决,或使用7 mm球囊对原导管通道进行全程扩张,特别是靠近导管出血管段,作者认为通常导管拔出或撕脱鞘不能置入的情况多数为导管出入血管段位置的纤维化包裹造成。如果在撕脱鞘进入过程中遇到阻力建议停止操作,调整方向或判断是否需要再行扩张,在撕脱鞘完整进入血管后,建议去除扩张器保留导丝,再沿导丝置入导管;如在导管进入过程中有阻力,建议重复进行一次上述操作,操作过程须严密注意空气进入血管内。指南建议颈内静脉导管尖端最佳位置在右心房,对于股静脉导管尖端最佳位置一般认为在下腔静脉下段[5],但对更换导管位置没有明确规定,尖端位置至少要超越原导管鞘部位,而对于不同体型患者导管长度及尖端位置需要具体评估,作者倾向新导管长度原则上要长于原导管,建议术前做好全面评估。
本研究显示腔内治疗能很好地解决导管嵌顿和再置管问题,使得再置管成功率更高,同时手术较安全、创伤小,患者耐受性较好,可以作为血管资源不足患者的备选方案。需要注意的是PTA治疗可造成内膜拉伸及内皮破坏,进而加速内膜增生造成血管再狭窄及加速导管失功,可能影响治疗的远期获益[19],临床需要更多观察研究。本研究为单中心回顾性研究且样本量少、随访时间短,需要扩大样本及延长随访时间观察以进一步明确。

