3种酒精发酵工业废液厌氧消化特性研究
王建政, 朱玉霞, 夏伟民
(1.车用生物燃料技术国家重点实验室, 河南 南阳 4730000; 2.河南南阳天冠企业集团, 河南 南阳 473000;3.河南上延安全技术服务有限公司, 河南 鹤壁 458000)
酒糟液是含淀粉原料(如小麦、玉米、木薯等)经过酒精发酵(酵母为接种物)、蒸馏出乙醇后剩余的废液,它含有大量的有机物残渣,其干物质成分主要是粗蛋白、粗脂肪和粗纤维[1-4],粗纤维又包括纤维素、半纤维素和木质素等成分。酒糟液是酒精发酵工业的主要废水,混排量大,但可以采用沼气发酵厌氧消化处理。传统上的燃料乙醇生产企业一般采用单一的原料,如玉米、小麦或木薯,进行发酵。近年来,为了粮食战略安全,国家提倡原料多元化的燃料乙醇生产模式[5],因此国内部分企业开始实施将玉米、小麦和木薯等原料混合的乙醇发酵工艺[6-7]。由于发酵原料由单一到混合,酒糟废水的组成成分也发生了很大的改变,这种改变对后续沼气厌氧消化的影响,目前还没见到国内有研究文献报道。文章着重考察玉米、小麦和木薯3种原料混合酒精发酵模式对后续的废水处理程序—沼气发酵过程的影响。
1 主要实验仪器
箱式电阻炉(BW GWL558,东莞市博威仪器设备有限公司);沼气分析仪(Geotech GA2000,英国);万位天平(Sartorious BSA224S-CW,德国);水分测定仪(Sartorious MA160,德国);恒温培养箱(DHG 9626A,上海精宏试验设备有限公司);元素分析仪(Elementar Vario ELⅢ,德国);热分析仪(Setaram Setsys 16/18,法国);琼脂糖凝胶电泳仪(Invitrogen G8100/G8200,美国);超微量分光光度计(NanoDrop 2000,美国);DNA测序仪(Illumina Miseq PE250,美国)。
2 试验材料、装置和流程
2.1 试验材料
新鲜蒸馏后的酒糟样品来自豫南某乙醇生产企业的3个不同燃料乙醇厂,分别记为ZR,MR,CR,其中ZR代表玉米糟液(Zea fermentation alcohol distillation residue),MR代表复合糟液(Mixed material fermentation alcohol distillation residue),CR代表木薯糟液(Cassava material fermentation alcohol distillation residue)。ZR和CR的发酵原料分别为玉米和木薯,MR采用的是复合发酵原料,质量比分别为:玉米(40%)、小麦(40%)和木薯(20%)。
根据传统的沼气发酵分析方法[8],采用水分分析仪测量3种糟液中的总固体含量(Total solids)。将部分干物质(TS)粉碎过筛(60目),按照国家标准方法测定粗蛋白(CP)(GB/T6432-1994)、粗灰分(Ash)(GB/T6438-2007)、粗脂肪(EE)(GB/T6433-2006)和中性洗涤纤维(NDF)(GB/T 20806-2006)的含量。结果如表1所示。
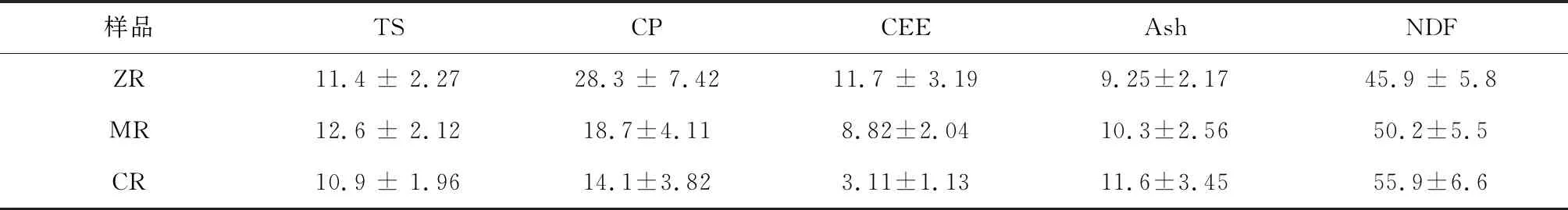
表1 3种糟液的干物质含量和化学成分 (%)
采用元素分析仪测定样品的C,H,O,N含量。采用热分析仪测定样品的热失重(Thermogravimetry,TG)和微商热失重(Derivative Thermogravimetry,DTG)。热失重(TG)表示的是样品的总质量减少量随温度的变化曲线,微商热失重(DTG)表示的是总质量减少率随温度的变化曲线[9]。
2.2 沼气发酵装置和流程
本实验采用自制的发酵装置(见图1)进行厌氧消化试验(沼气发酵)。该装置主要由厌氧发酵装置、温度控制装置和集气装置3部分组成。发酵装置为2 L发酵瓶,集气装置为1 L宽口瓶,用橡胶塞密封。发酵瓶与集气装置之间采用胶管与玻璃管连接,瓶盖与管道严格密封,保证厌氧环境。将发酵瓶置于恒温培养箱中进行恒温发酵。整个实验装置的产气量采用向下排水(饱和盐水)集气法测量。根据理想气体定律和测量温度,将产气量换算为标准条件下的气体体积,除以基质干物质质量(TS质量),即当日甲烷产量(单位质量干物质日产气量)。采用便携式沼气分析仪测定沼气中CH4的含量。以上数据在每天定时测量。
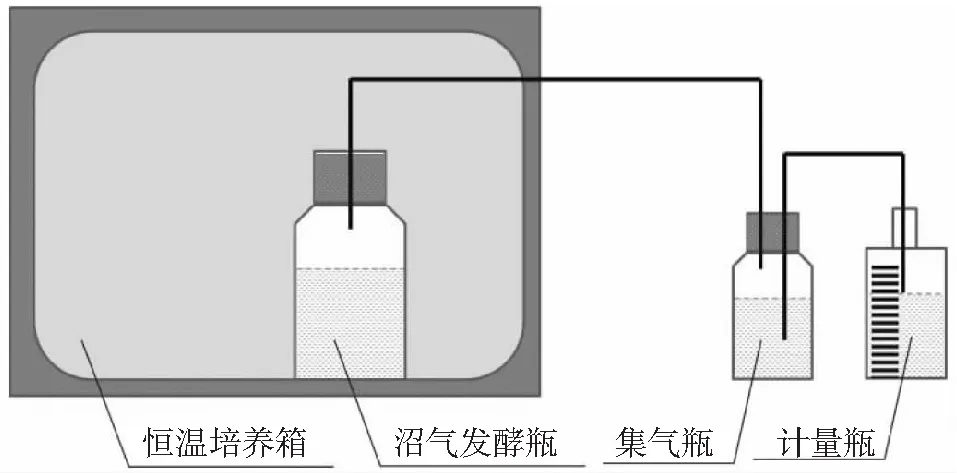
图1 沼气发酵装置示意图
本研究以ZR,MR和CR全糟液为底物,采用序批式单相厌氧发酵模式进行沼气发酵试验。以河南省南阳市某沼气公司的厌氧活性污泥为沼气发酵接种物。将培养料(ZR,MR或CR)放入发酵瓶中,接好活性污泥,加水定容至1 L,关闭发酵装置,放入恒温生化培养箱进行恒温发酵,然后以沼气产量和甲烷含量作为考核指标。沼气发酵液初始固形物含量(TS%)控制在8 %(含活性污泥干重),活性污泥量(干质量)控制在每瓶8 g,发酵温度控制在35℃±1℃。按规定时间每天搅拌1次,每次搅拌1分钟,发酵60 d。每种原料(ZR,MR或CR)重复5次。
2.3 DNA测序和菌谱分析
在无菌条件下,用改进的氯苯法从产甲烷高峰期的发酵液中提取总DNA[10]。经紫外分光光度计和琼脂糖凝胶电泳,选择DNA样品(浓度>10 ng·μL-1;OD260/280在 1.8~2.2 之间;琼脂糖凝胶电泳主带清晰、杂质较少且无严重拖尾现象),用引物515F Modified[11]和806R Modified[12](见表2)进行16S rRNA 基因的扩增。扩增后的产物进行纯化和定量。

表2 基因扩增引物
利用Illumina miseq PE250平台,对纯化的扩增样品进行高通量测序。使用软件Flash v1.2.7 (http://ccb.jhu.edu/software/FLASH/)拼接每个样本两端的序列,得到原始序列。使用软件Qiime v1.9.0 (http://qiime.org/)过滤原始序列以获得高质量的序列。使用软件Usearch v8.0 (http://www.drive5.com/usearch/)检测嵌合序列,剔除后获得有效序列。根据16S rRNA基因数据库-Silva数据库(Release115,http://www.arb-silva.de),注释所有OTUs对应的细菌和古细菌分类信息。利用Origin Pro 2017对丰度比大于2%的门、属进行统计,并用百分率直方图直观地显示细菌谱信息。
用SPSS v18.0软件对实验数据进行单因素方差分析(p<0.05表示差异显著),结果以“均值±标准差”的方式表示。
3 实验结果与讨论
3.1 产气速率和甲烷含量测定
本文分别采用玉米酒糟液(ZR)、混合原料酒糟液(MR)和木薯酒糟液(CR)作为培养底物进行沼气厌氧发酵试验,各试验组在发酵初期产气量很小;随着发酵时间的延长,产气量逐渐增加(见图2~图4),分别在第8天(ZR),第14天(MR)和第20天(CR)达到高峰,最高日产气量分别为24.77,14.69和12.96 mL·g-1d-1。此后产气量呈下降趋势。各实验组的累积产气量由小到大依次为CR < ZR < MR,分别为177.11,211.44和223.8 mL·g-1。若将累积产气量达到总产气量的90%作为发酵周期,则发酵周期由长到短依次为CR > MR > ZR,分别为37 d,35 d和26 d。
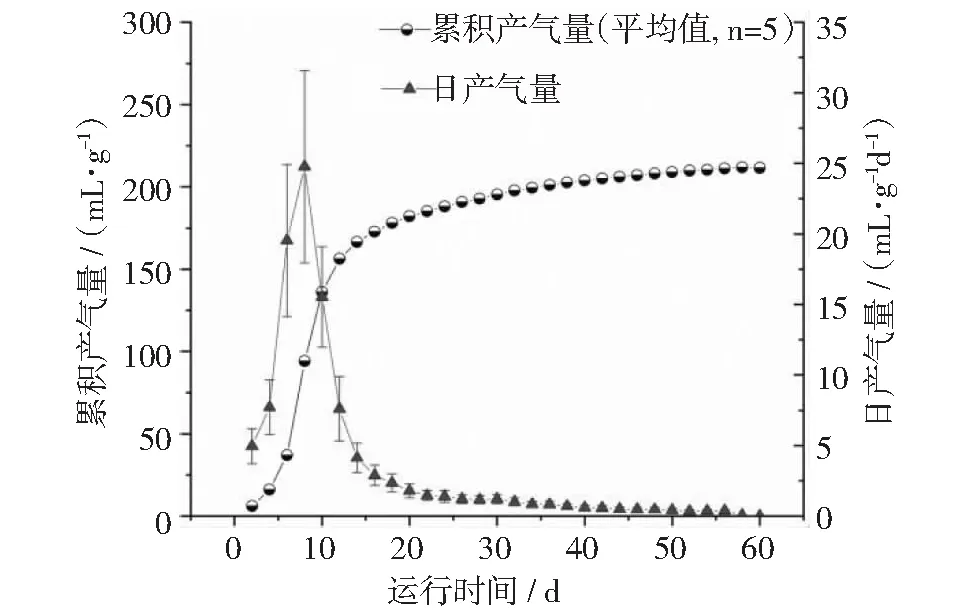
图2 玉米糟液ZR的产气曲线
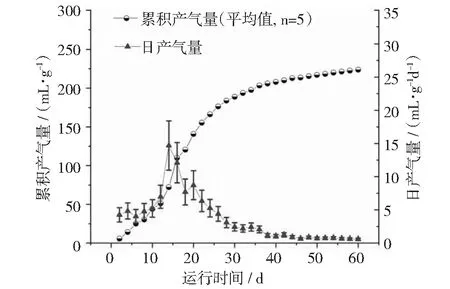
图3 混合原料发酵糟液MR的产气曲线
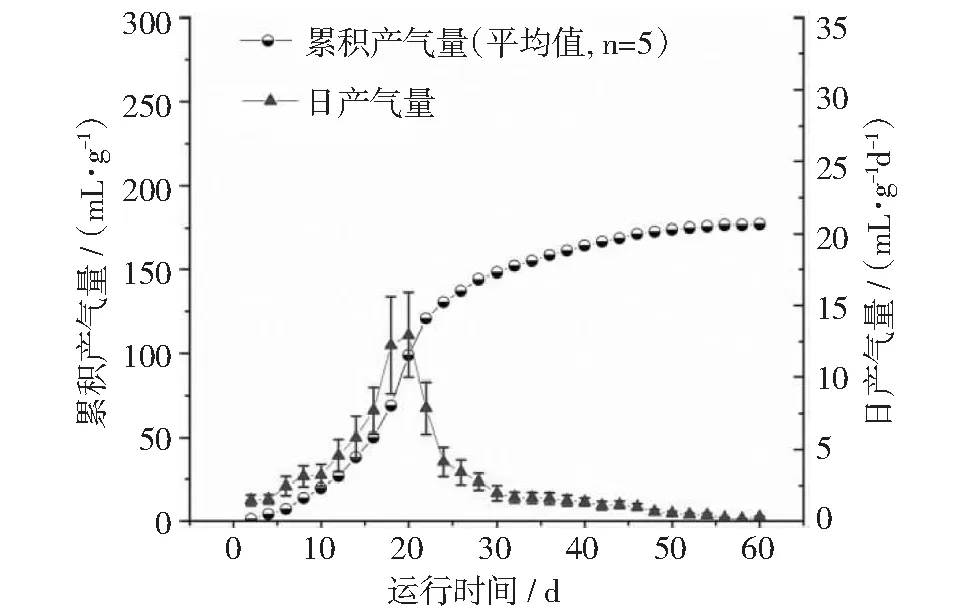
图4 木薯糟液CR的产气曲线
对产气量最高日的沼气甲烷含量进行统计分析,与ZR,MR,CR这3个试验组相对应的甲烷含量分别为64.33%±15.27%%,67.98%±14.78%和58.79%±11.23%(见表3)。
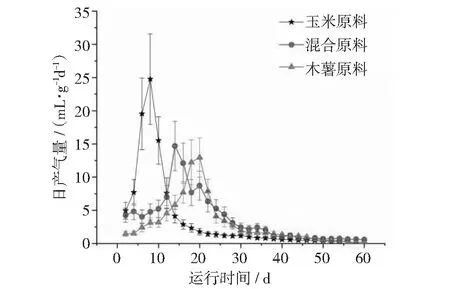
图5 3种糟液日产气量比较
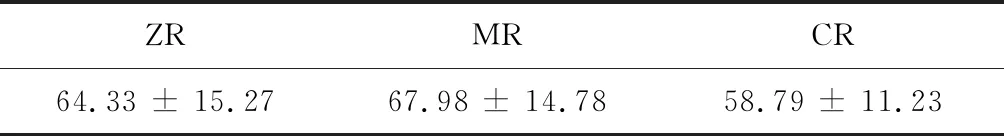
表3 沼气中的甲烷含量(最高产气日) (%)
3.2 微生物群落分析
笔者对3组底物的沼气厌氧发酵菌群结构进行了考察。引物515F Modified和806R Modified能够同时对细菌和古菌的16S rRNA基因进行扩增[13-14]。根据高通量测序结果进行分类统计,得到的门、纲、目、科、属等分类水平的菌群谱,能够反映分类学水平上沼气发酵料液中细菌和古菌的群落结构。
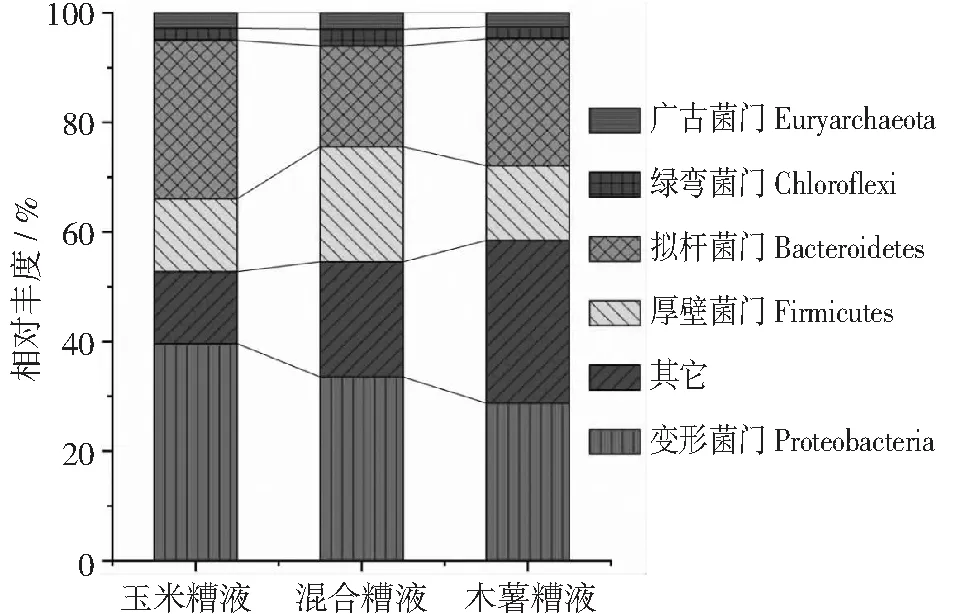
图6 微生物菌谱丰度柱形图(门级分类)
如图6所示,在微生物群落结构的门级上,ZR实验组厌氧消化水中相对丰度排名前3位的分别是变形菌门(Proteobacteria,39.63%)、拟杆菌门(Bacteroidetes,28.88 %)和厚壁菌门(Firmicutes,13.29%);MR实验组排名前3的分别是变形菌门(Proteobacteria,33.53 %)、厚壁菌门(Firmicutes,20.95%)和拟杆菌门(Bacteroidetes,18.42 %);CR实验组占比前3位的分别是变形菌门(Proteobacteria,28.78 %)、拟杆菌门(Bacteroidetes,23.16%)和厚壁菌门(Firmicutes,13.64 %);在3种厌氧消化体系中,还发现有绿弯菌门细菌(Chloroflexi),其相对丰度分别为2.23,%,3.06%和2.16%。细菌中的厚壁菌门、变形菌门和拟杆菌门,以及古菌中的产甲烷微菌属都是常见的沼气发酵优势菌群[15-18]。变形菌门(Proteobacteria)包括许多互营共生菌,具有降解长链脂肪酸的作用[19],能够水解氨基酸、长链脂肪酸及淀粉等物质,部分细菌具有脱氮作用[20],它们大多数营兼性或者专性厌氧,尤其是其中的β-变形菌纲(Betaproteobacteria),在工业污水处理厂和市政污水处理厂的污泥中,均为优势菌群[21-22]。拟杆菌门(Bacteroidetes)的菌群能将大的有机化合物(如多糖、脂肪和蛋白质)水解成小的有机酸、单糖、低级醇和氨基酸[23-24]。厚壁菌门(Firmicutes)可以降解碳水化合物、脂肪和蛋白质,也是降解挥发性脂肪酸的主要菌群[25]。类杆菌和硬壁菌是产氢/产酸细菌。绿弯菌门(Chloroflexi)是一种重要的葡萄糖降解菌,能与产甲烷菌竞争,并能利用氢气[26]。
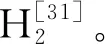

图7 微生物菌谱丰度柱形图(细菌属级分类)
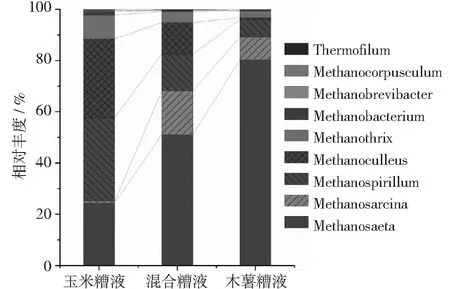
图8 微生物菌谱丰度柱形图(古菌属级分类)
广古菌门包含了古细菌中的大多数种类,是主要的产甲烷菌[36],其中的甲烷髦毛菌属(Methanosaeta)和产甲烷杆菌属(Methanobacterium)是分布最广泛的古菌属[37]。如图8所示,在本论文中,ZR实验组厌氧消化的水体中,相对丰度占比前3位的古菌属分别是甲烷螺菌属(Methanospirillum,32.64%)、甲烷囊菌属(Methanoculleus,30.72%)和甲烷鬃菌属(Methanosaeta,24.34%);MR实验组的前3位分别是甲烷鬃菌属(Methanosaeta,50.04%)、甲烷八叠球菌属(Methanosarcina,17.02%)和甲烷螺菌属(Methanospirillum,14.48%);CR实验组的前3位分别是甲烷鬃菌属(Methanosaeta,80.30%)、甲烷八叠球菌属(Methanosarcina,8.84%)和甲烷螺菌属(Methanospirillum,6.81%),甲烷囊菌属(Methanoculleus,30.72%)的相对丰度降低到了0.80%。Methanosaeta能够利用醋酸盐等酸类物质生成甲烷和CO2,是乙酸营养型产甲烷菌[38-40]。Methanobacterium常分布在高温污泥、中温污泥中,主要代谢的底物是H2,CO2,甲酸盐和甲醇[41]。此外,甲烷八叠球菌属(Methanosarcina)也属于优势产甲烷菌,该菌可以通过食氢甲烷途径和食乙酸产甲烷途径进行甲烷合成[42],有些菌种还能够以甲酸或甲醇为发酵底物进行甲烷合成[43],是低温环境下维持沼气池正常产气的关键菌属[44]。甲烷螺菌属(Methanospirillum)和甲烷囊菌属(Methanoculleus)也都是严格的氢营养型产甲烷菌群。
沼气发酵过程中,产甲烷菌与非产甲烷菌相互依存、相互制约,维持厌氧消化环境的动态平衡。整个沼气发酵过程的产气量取决于各菌群的协调性。以Clostridiumsensustricto为代表的初级发酵菌在原核生物群落中所占比例很高,但并不是影响甲烷生产效率的决定性因素[45-46]。MR实验组的沼气发酵产量较高,甲烷含量也较高,这可能是由于MR糟液的生物质组成更适合于相关菌群之间协调的缘故。
3.3 元素分析
玉米糟液(ZR)、混合原料糟液(MR)和木薯糟液(CR)的干物质(TS)元素分析结果见表4所示。其中,木薯糟液干物质中N元素含量较低,仅为1.04%±0.19%,其C/N值高达48.17,这可能是由于原料木薯中的蛋白质含量较低的缘故(见表1)。
沼气发酵原料的碳氮比一般维持在25~30∶1左右,才能获得持久均衡的产沼气能力[47-48],3种糟液的干物质化学组成(见表1)和元素比例(见表4)的差异,可能影响到它们在厌氧消化过程中的产甲烷特性,例如产气速率、累积产气量和沼气成分等。
3.4 热分解谱分析
自然状态下的生物质大分子常常具有独特的晶型结构,例如纤维素即是一种高结晶度纤维结构,其晶胞类型可以分为纤维素Ⅰ,Ⅱ,Ⅲ和Ⅳ[49];这些晶型结构阻碍了微生物胞外水解酶与底物大分子的微观空间接触[50],降低了酶的水解效果,增强了底物的抗微生物降解的能力[51]。因此常须借助汽爆[49]、表面活性剂和离子液体[52]、微波和化学处理(酸或碱)[53]等方法对纤维质原料进行预处理,以期改变其超微结构和结晶度,提高酶解效果。生物质热裂解是指生物质在受热过程中,其物理结构和化学性质发生变化,包括结晶区的破坏[54]、挥发性成分溢出、糖苷键断裂和聚合度下降,以及游离糖单元的分解等过程。借助热裂解分析技术,如热重分析(TG)和微商热重分析(DTG),可以研究纤维素等生物质大分子晶型结构的稳定性[55-56]。
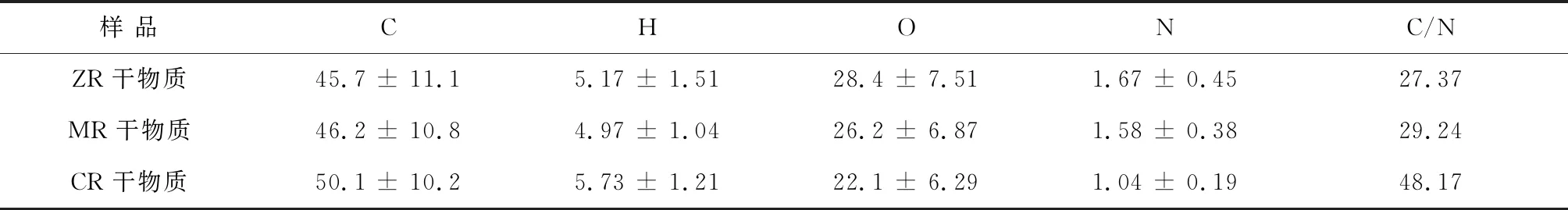
表4 糟液干物质的元素分析
本文研究了ZR,MR和CR这3种糟液干物质在不同加热阶段的热失重(TG)和微商热失重(DTG)曲线。从图9~图12可以清楚地看出,3种样品在TG和DTG曲线上的失重明显表现为文献[57-58]所描述的4个热降解阶段:第1阶段发生在温度从室温上升到250℃左右时,质量损失是由水和二氧化碳的受热释放引起的,这可能涉及重排反应,如物质内部结构的脱水、化学键断裂和过氧化氢基团的形成等[59-60]。第2阶段发生在250℃~450℃之间。在这一阶段,DTG曲线上有一个明显的失重峰,其质量损失是由纤维素、半纤维素、部分木质素和非纤维素组分的分解引起的:半纤维素在200℃~300℃左右分解;纤维素在310℃~400℃左右分解[61];木质素在半纤维素和纤维素降解的整个过程中降解[62]。第3阶段发生在450℃~600℃之间。这一阶段的质量损失与木质素的分解和灰分的形成有关,这可能涉及C-C键和C-H键的进一步断裂以及残余固体中碳的富集[63]。之后,炭化样品的分解速率趋于平缓,质量不再发生显著变化。
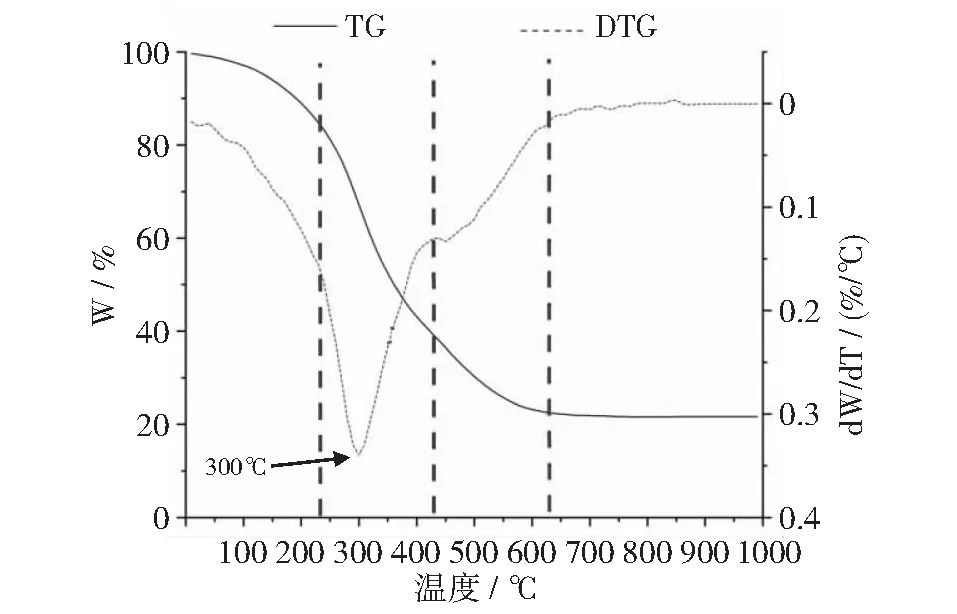
图9 ZR干物质热分解曲线
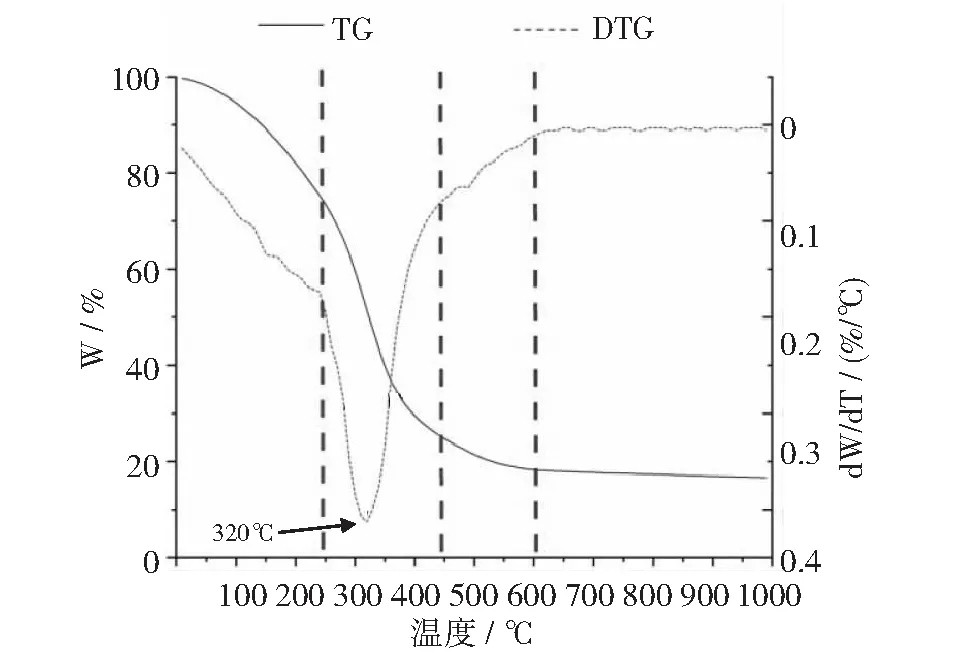
图10 MR干物质热分解曲线
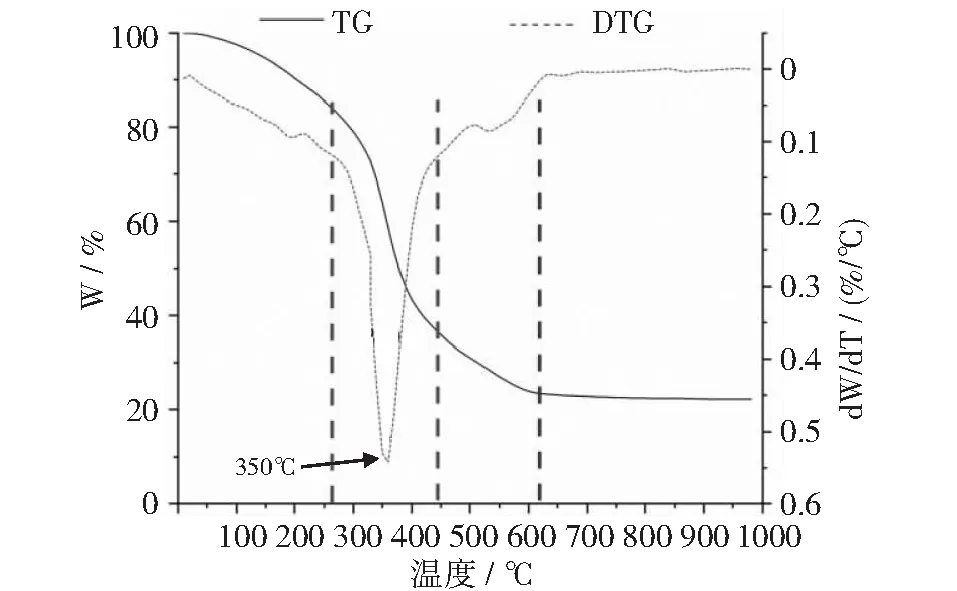
图11 CR干物质热分解曲线
此外,上述热分解曲线显示,ZR,MR和CR这3种酒糟干物质样品的Tmax值分别为300℃,320℃和350℃(如图12所示)。Tmax值表示样品达到最大降解速率时的温度,此时分子结构变化最剧烈、样品失重速度最快。CR干物质的Tmax值最高,说明其所含大分子的晶型结构更稳定,更不容易降解。生物质大分子常以共价键的形式,彼此之间形成诸如蛋白聚糖[64]、糖蛋白[65]和糖脂[66]等复合物,这些复合物在不同来源的原料中,其分子晶型结构(如晶胞类型,结晶区、非结晶区的比例)和相对含量也千差万别[49,67-71],因而它们抵抗微生物降解的能力也有很大差异[51],这种差异对其厌氧发酵产甲烷等生化过程产生重大影响[72]。本试验中Tmax值的差异显示了ZR,MR和CR这3个试验组之间发酵底物的分子组成和晶型结构的差异,这可能是导致它们在沼气消化阶段表现出不同的发酵特性的原因。
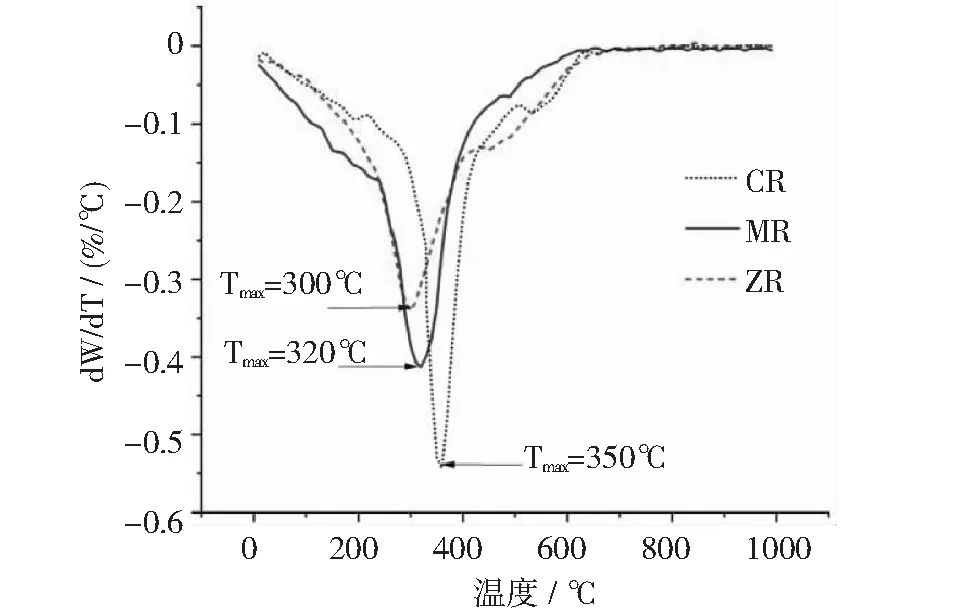
图12 3种干物质样品的Tmax值比较
4 结论
(1)以复合糟液(MR)为底物的厌氧消化产气量最高(223.8 mL·g-1);以玉米糟液(ZR)为底物的厌氧消化发酵周期最短(26天);以木薯糟液(ZR)为底物的厌氧消化的沼气中甲烷含量最低(58.79%)。
(2)在厌氧消化微生物群落中,ZR试验组相对丰度排名前3位的依次是变形菌门(39.63%)、拟杆菌门(28.88 %)和厚壁菌门(13.29%);MR试验组排名前3的依次是变形菌门(33.53 %)、厚壁菌门(20.95%)和拟杆菌门(18.42 %);CR试验组占比前3位的依次是变形菌门(28.78 %)、拟杆菌门(23.16%)和厚壁菌门(13.64 %)。
(3)在3种糟液干物质中,ZR试验组的碳氮比(C/N)最高,达到48.17,其干物质热分解Tmax值也最高,达到了350℃。

