阿尔茨海默病患者外周血microRNA-146a、Aβ1-42蛋白、tau蛋白的表达及临床意义①
黄 攀 徐 敏 何晓英 易兴阳
(德阳市人民医院,德阳 618000)
阿尔茨海默病(Alzheimer′s disease,AD)是一种发生在老年期或者老年前期的慢性中枢神经退行性疾病,主要以进行性认知功能障碍、记忆力下降、日常生活能力下降、精神行为异常为主要临床表现[1]。据估算,我国现有AD患者600万~800万,面对如此庞大的患病群体,AD治疗的选择方案极少,究其原因是由于AD的发病机制尚不完全明确[2,3],而随着家族性AD的发现,基因学说参与AD的致病逐渐受到人们的关注。microRNA是一类长17~23个核苷酸长度的非编码小分子物质,广泛参与机体生长、发育以及疾病发生发展的调控。研究发现microRNA-146a在术后认知功能障碍、孤独症等疾病中存在着差异表达谱,并且与这些疾病的发生密切相关[4-6]。为了解microRNA-146a在AD患者中是否也存在着差异表达以及在AD的发病中发挥着何种机制,特设计此研究,现报道如下。
1 资料与方法
1.1资料
1.1.1临床资料 选取我院2015年7月至2018年7月住院治疗的AD患者98例作为试验组(experiment group,exp group),其中男性54例,女性44例,年龄66~81岁,平均(67.18±6.53)岁。另选取健康者50例作为对照组(control group),其中男性26例,女性24例,年龄65~80岁,平均(68.74±6.62)岁。试验组纳入标准:①符合《精神障碍诊断与统计手册》[7]中有关于阿尔茨海默病的疾病诊断标准的患者;②年龄>60岁的患者;③简易智能精神状态量表(mini-mentai state examination,MMSE)评分提示存在认知功能障碍的患者,即文盲患者MMSE≤17分,小学患者≤20分,中学及以上文化程度患者≤24分;④能完成本研究的患者;⑤头颅CT或MRI、临床表现、实验室检查提示无脑出血、脑梗死、颅内占位的患者。试验组排除标准:①其他类型痴呆患者如血管性痴呆、晚期帕金森病患者、颅内感染患者、精神分裂症、抑郁症患者;②伴有严重的心、肝、肺、肾功能不全患者;③明显衰竭患者;④已使用过治疗痴呆药物;⑤MMSE评分大于24分的AD患者。对照组纳入标准:无中枢神经系统疾病、无痴呆的非神经系统疾病者、无严重心肝肾肺疾病。本研究通过医院伦理委员会批准,所有患者或法定授权人签署知情同意书。两组在年龄、性别等一般资料方面差异无统计学意义。
1.1.2仪器 离心机(上海安亭科学仪器厂,TGL-16c),Trizol试剂盒(InvitroggenTM,15596-026),核酸蛋白测定仪(上海琪特,WXJ-9388),PCR扩增仪(杭州博日科技,TC-XP)。
1.2方法
1.2.1样本采集 清晨抽取所有纳入者空腹外周静脉血样本5 ml,放置于室温下自然凝固15 min,然后将凝固的血液样本在3 000 r/min的离心机中离心30 min,离心后仔细分离收集上层血清并储存在-80℃超低温冰箱,用于血清总RNA 的提取及RT-PCR、ELISA、Aβ1-42蛋白、tau蛋白的检测。
1.2.2RT-PCR检测 按照Trizol试剂盒提取血清总RNA后以核酸蛋白测定仪测定的OD260/OD280的值在1.8~2.0视为合格RNA,然后采用M-MLV 逆转录酶试剂盒合成cDNA(InvitrogenTM,C-28025),第一链cDNA合成后将RT-PCR反应混合液置于PCR扩增仪的96孔反应板中,2×PCR Mix 5.0 μl,引物工作液(2.5 μmol/L)1.0 μl,Template 1.0 μl,ddH2O 2.8 μl,Rox0.2 μl,总体积10 μl,每个样本均做3复孔,扩增循环条件:95℃,1 min;95℃、15 s,58℃、20 s,72℃、45 s,共 40 个循环。microRNA-146a引物序列为:Forward:5′-CCTGAGAAGTGAATTCCATGGG-3′;reverse:5′-CTCAACTGGTGTCGTGG-AGTC-3′;内参基因U6引物序列为:Forward:5′-CTCGCTTCGGCAGCACAT-3′;reverse:5′-AACGCTTCACGAATTTGCGT-3′。因RT-PCR中Ct值不能作为原始数据进行统计学分析,本研究采用2-ΔΔCt代表microRNA的相对表达量。ΔCt=(目标microRNA Ct值-内参基因U6 Ct值)。
1.2.3Aβ1-42蛋白、tau蛋白浓度检测 采用双抗体夹心酶联免疫吸附法(ELISA)测定两组患者外周血清中Aβ1-42蛋白、tau蛋白浓度,试剂盒由武汉拜意尔生物科技有限公司提供,酶标仪由北京普朗新技术有限公司,型号DNM-9602。严格按照说明书步骤建立标准曲线后根据各孔的吸光度计算Aβ1-42蛋白、tau蛋白浓度。

2 结果
2.1两组基线资料比较 两组患者基线资料比较,差异无统计学意义,提示二者具有可比性(P>0.05)。见表1。
2.2microRNA-146a在人类基因组中位置及保守性分析 采用加州大学圣克鲁斯分校研制的UCSC基因组在线工具(http://genome-asia.ucsc.edu)对microRNA-146a在人类基因组中的位置及保守性分析发现,microRNA-146a定位于5q33.3人染色体上160485325-160485450位置,长度为99 bp,并且其核苷酸序列在人、恒河猴、小鼠、狗、大象、鸡6个物种中高度保守。见图1。
2.3两组患者外周血清microRNA-146a、Aβ1-42、tau蛋白比较 试验组患者外周血清中microRNA-146a的相对表达量明显高于对照组,差异有统计学意义(P<0.05);而试验组患者外周血清中Aβ1-42浓度明显低于对照组,tau浓度高于对照组,差异均有统计学意义(P<0.05)。见表2。

图1 microRNA-146a在人类基因组中的位置及保守性分析Fig.1 Location and conservation of microRNA-146a in human genome
表1 两组患者基线资料比较
Tab.1 Comparison of baseline data between two groups

ItemExp group(n=98)Control group(n=50)t/χ2PSex(Male/Female)54/4426/240.120.72Age(year)67.18±6.5368.74±6.621.360.17BMI(kg/m2)22.87±3.2323.65±3.411.340.18Hypertension[n(%)]33(33.67%)14(28.00%)0.490.48 Diabetes[n(%)]18(18.36%)6(12.00%)0.980.32TG(mmol/L)1.42±0.211.46±0.220.590.55TC(mmol/L)4.17±0.854.10±0.920.520.60HDL-C(mmol/L)0.93±0.350.84±0.321.550.12LDL-C(mmol/L)2.71±0.852.92±0.911.490.14
表2 两组患者外周血清microRNA-146a、Aβ1-42、tau蛋白比较
Tab.2 Comparison of microRNA-146a,Aβ1-42,tau protein between two groups

ItemExp groupControl grouptPmicroRNA-146a2.45±0.430.98±0.1231.520.00Aβ1-42(pg/ml)37.43±6.7551.26±9.249.380.00tau(pg/ml)22.87±4.5113.64±2.9115.030.00
2.4microRNA-146a与Aβ1-42、tau蛋白相关性分析 试验组患者外周血microRNA-146a与Aβ1-42蛋白呈负相关性(r=-0.882,P=0.000),与tau蛋白无相关性(r=0.129,P=0.205),差异均有统计学意义(P<0.05)。见图2。
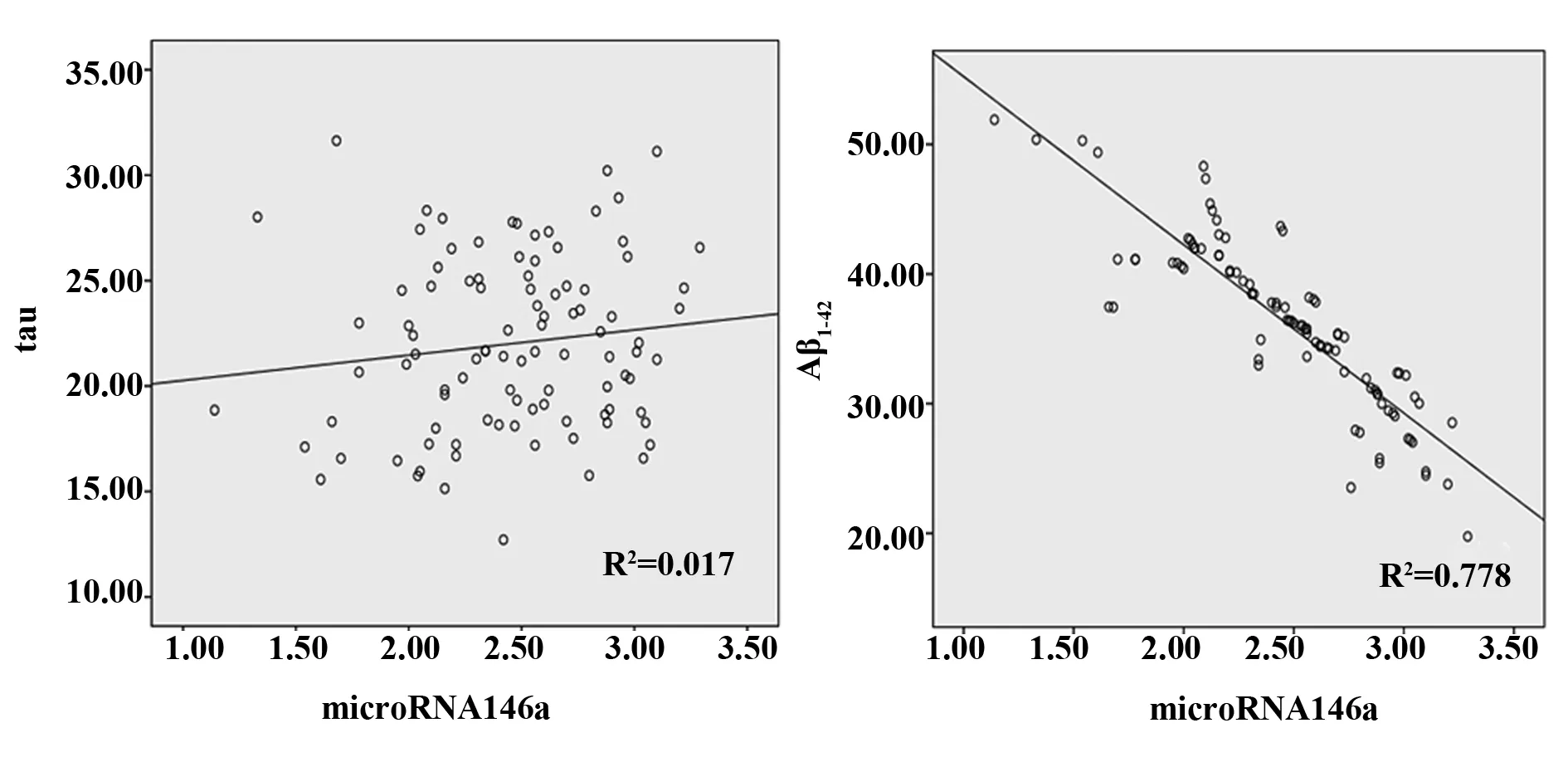
图2 microNRA-146a与Aβ1-42、tau蛋白相关性分析Fig.2 Correlation analysis between microNRA-146a and Aβ1-42,tau protein
3 讨论
AD的组织病理学改变为神经炎性斑(嗜银神经轴索突起包绕Aβ而形成)、神经原纤维缠结(由过度磷酸化的微管tau蛋白于神经元内高度螺旋化形成)以及神经元缺失和胶质增生[8]。在机体中β水解酶和γ水解酶通过水解淀粉样前体蛋白形成Aβ1-40和Aβ1-42蛋白,研究显示单体的Aβ蛋白并无神经毒性,而当单体水解后产生可溶性Aβ聚集体才是导致AD发病的关键因素[9]。Aβ寡聚体可与中枢神经系统中的多种受体识别结合,引起神经元细胞钙超载、小胶质细胞膜电位下降、谷氨酸水平升高进而导致AD的发生[10]。虽然机体内Aβ1-42的表达量远不及Aβ1-40,但Aβ1-42的神经毒性却远强于Aβ1-40且更容易形成淀粉样蛋白从而导致神经炎性斑的形成[11]。tau蛋白分布于神经元内,与微管蛋白结合后形成微管,这种复合物对于维持神经细胞的轴突运输以及细胞骨架的稳定性具有重要作用[12]。tau蛋白分子结构上具有很多磷酸化位点,病理状态下tau蛋白被过度磷酸化,这种过度磷酸化的tau蛋白不再具有结合微观蛋白的能力,反而具有促进tau蛋白相互聚合缠绕形成神经元纤维缠结(neurofibrillary tangles,NFTs)[13],tau蛋白的聚合被认为是AD形成的基础[14,15]。既往对于Aβ1-42蛋白及tau蛋白的研究主要集中于脑脊液中,然而脑脊液获取标本较难,外周血取材方便,积极探索外周血中Aβ1-42蛋白及tau蛋白对于AD的诊断具有重要意义,然而由于血脑屏障的存在且外周血容量较大,相关蛋白浓度被大大稀释,因此必须采用灵敏度高的检测手段。酶联免疫吸附法(ELISA)相对于其他检测方法灵敏度大大提高,其原理为酶是一种有机催化剂,极少量的酶即可诱导大量的催化反应 ,产生可供观察的显色反应现象,因此该体系常被称为酶放大体系,其精确程度达到可以在细胞或亚细胞水平上示踪抗原或抗体的所在部位,甚至在微克、甚至纳克水平上对其进行定量[16]。在本研究中运用ELISA技术对试验组与对照组患者外周血清中的Aβ1-42蛋白浓度及tau蛋白浓度进行定量检测,结果显示AD患者外周血清中Aβ1-42蛋白浓度明显低于对照组,提示AD患者外周血Aβ1-42蛋白水平可以作为AD潜在的生物学标志物。目前关于AD患者外周血Aβ1-42蛋白表达趋势尚未统一,部分文献与本文结果不一致,经查阅相关文献推测可能有以下几种原因:①AD发生时,脑脊液中大量的Aβ1-42蛋白在脑内缠绕形成神经元炎性斑,进而导致分泌外周血中的Aβ1-42蛋白减少;②外周血中Aβ1-42蛋白还可由血小板及骨骼肌分泌,其代谢受到肝肾功能的影响;③Aβ1-42蛋白分子结构决定其疏水活性,与外周血中的脂蛋白、清蛋白结合使得其检测结果也会受到影响。此外,本研究还发现AD患者tau蛋白浓度明显高于对照组,与其他研究结论类似,目前认为脑脊液中tau蛋白浓度可以较好地识别AD患者稳定期与进展期,而外周血tau蛋白则可以区分AD患者与认知功能正常者[17]。
microRNA是一类可调节蛋白表达转录的小分子RNA,广泛参与疾病发生、发展的调控,其在外周血中表达稳定,可被稳定的检测,已成为多种疾病的生物学标志物[18]。microRNA功能多样,同一种microRNA在不同物种之间可能表达不同,也具有不同的功能[19]。microRNA-146a是众多RNA分子家族成员中的一员,为进一步探究AD患者外周血清中microRNA-146a的表达谱,本研究先通过生物信息学方法显示microRNA-146a在人体中具有高度保守性,这为设计microRNA-146a引物序列以及后续试验奠定了基础,而RT-PCR检测结果也表明AD患者外周血清中microRNA-146a相对表达水平高于对照组,提示microRNA-146a可以与AD的发病有关。为进一步探讨其在AD中的可能机制,本研究采用相关性分析发现microRNA-146a与Aβ1-42蛋白存在负相关性,而与tau蛋白无相关性。中枢神经系统炎症也是引起AD的原因之一[20],其中重要的机制便是AD患者脑内小胶质细胞诱导分泌的炎症因子可以降低降解Aβ蛋白的关键酶-胰岛素降解酶,导致Aβ清除减少而沉积于脑内形成炎性斑块[21,22],而研究发现microRNA-146a可以通过多种途径参与炎症反应,起到抑制炎症的作用,包括负性调节重要的炎症信号通路TLR通路、MAPK信号通路、NF-κB信号通路[23-26]等,提示在AD患者中microRNA-146a的表达升高可能通过负性调控炎症反应进而参与Aβ1-42蛋白的清除。此外,研究也发现炎症反应不仅可以影响tau蛋白的转录和转录后修饰,还进而以影响寡聚tau蛋白的传播进而参与AD的发病[27,28],但本研究并未发现microRNA-146a与tau蛋白的相关性,推测炎症虽然参与AD的发病,但在AD患者microRNA-146a并未通过调控影响tau蛋白代谢的炎症反应,其具体机制还需进一步研究证实。
综上所述,AD患者外周血清中存在microRNA-146a、Aβ1-42蛋白、tau蛋白的差异表达,且microRNA-146a在AD的发病中可能是通过调控Aβ1-42蛋白而不是tau蛋白,microRNA-146a可能是潜在治疗AD的靶点。然而,本研究样本量较小、单中心研究、仅进行了相关性分析,未对其机制进入研究,其结论尚需更多的研究补充验证。

