靶向沉默c-Met基因对膀胱癌T24细胞放射敏感性的影响及其机制研究
李建伟 田文静 刘 民
(沧州市中心医院泌尿外二科,沧州 061001)
膀胱癌又称膀胱尿路上皮癌,是发生在膀胱黏膜上常见的泌尿系统恶性肿瘤,也是全球第九大常见肿瘤[1]。目前治疗膀胱癌的主要方式是手术联合放射治疗,但由于膀胱癌患者对放疗不敏感导致患者预后不良[2]。因此,有效提高膀胱癌患者的放射敏感性变得十分迫切。c-Met是肝细胞生长因子受体,在多数恶性肿瘤中呈高表达[3-5]。临床研究发现,c-Met的高表达与肿瘤患者预后不良密切相关[6]。目前,c-Met在调控肿瘤细胞放射敏感性的研究备受人们关注[7,8]。近期研究发现,c-Met在膀胱癌组织亦呈高表达,可能与膀胱癌的临床分期、病理分级及淋巴结转移有关[9]。但c-Met是否参与膀胱癌患者放射敏感性的研究目前尚未见报道。因此本实验通过小干扰RNA技术靶向沉默c-Met基因表达,旨在观察c-Met siRNA对膀胱癌T24细胞放射敏感性的影响,并探讨其作用机制,以期为膀胱癌的放射治疗提供理论依据。
1 材料与方法
1.1材料 人膀胱癌T24细胞(武汉大学中国典型培养物保藏中心);RPIM1640培养基、胎牛血清(美国HyClone公司);噻唑蓝(Methylthiazolyl-diphenyl-tetrazolium bromide,MTT)试剂(美国Invitrogen公司);胰蛋白酶(杭州四季青生物工程材料有限公司);Trizol试剂、Lipofectamine 2000转染试剂(美国Invitrogen公司);特异性c-Met siRNA1、c-Met siRNA2及非特异性c-Met siRNA(上海吉玛制药技术有限公司);Cleaved Caspase-3抗体、Bax抗体、PI3K抗体和p-AKT抗体及二抗(美国CST公司);逆转录试剂盒(北京康为试剂有限公司);SYBR premix Ex Taq PCR Kit荧光定量PCR检测试剂盒(日本TaKaRa公司);细胞裂解液、BCA蛋白浓度检测试剂盒(上海碧云天生物技术研究所);Annexin-Ⅴ/PI细胞凋亡检测试剂盒(美国BD公司)。
1.2方法
1.2.1细胞培养和转染 人膀胱癌T24细胞培养条件为:含10%胎牛血清的RPIM1640培养基(内含有100 U/ml青霉素和链霉素),5%CO2、37℃恒温培养箱中培养。取生长状态良好的T24细胞接种到96孔板中,待细胞生长汇合至40%左右时,按照Lipofectamine 2000转染试剂说明书进行转染操作,以转染特异性c-Met siRNA1的T24细胞为si-c-Met1组,以转染特异性c-Met siRNA2的T24细胞为si-c-Met2组,以转染非特异性c-Met siRNA的T24细胞为NC组,同时设置空白对照组(Blank组)。转染后将各组细胞置37℃培养箱继续培养。
1.2.2qRT-PCR检测各组T24细胞中c-Met基因mRNA表达情况 收集转染48 h后的各组T24细胞,Trizol法提取RNA,按照逆转录试剂盒说明书合成cDNA,以SYBR premix Ex Taq PCR Kit荧光定量PCR检测试剂盒进行扩增,采用20 μl反应体系:cDNA 1 μl,上下游引物各0.8 μl,2×SYBR premix Ex Taq PCR Mix 10 μl,由ddH2O补齐20 μl。反应条件为:95℃ 5 min,95℃ 15 s,58℃ 30 s,72℃ 20 s,共40个循环。以β-actin为内参,实验重复3次,采用2-ΔΔCT法检测各组T24细胞中c-Met mRNA相对表达量。
1.2.3Western blot检测各组T24细胞中c-Met蛋白表达情况 收集转染48 h后的各组T24细胞,加入蛋白裂解液置冰上提取细胞中总蛋白,采用BCA蛋白浓度检测试剂盒对蛋白定量测定,取等量变性蛋白样品行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,通过电转法转膜至PVDF膜上,置5%脱脂奶粉中封闭2 h,加入一抗(c-Met一抗稀释比为1∶1 000)杂交,4℃杂交过夜,TBST洗膜3次,加入二抗(二抗稀释比为1∶3 000)杂交,室温杂交2 h,TBST洗膜3次,ECL化学发光,以GAPDH标定,使用Image J软件分析图像,计算各组T24细胞中c-Met蛋白相对表达量。
1.2.4MTT检测各组T24细胞增殖情况 各组T24细胞在转染24、48、72 h,分别向细胞中加入20 μl MTT溶液,37℃孵育4 h,取出细胞培养板,取上清,再向细胞中添加100 μl二甲基亚砜,振荡反应10 min,沉淀完全溶解后,使用全自动酶标仪测定细胞在450 nm波长处吸光度值(A值)。
1.2.5克隆形成实验检测T24细胞克隆形成能力 各组T24细胞以胰蛋白酶消化成单个细胞,计数后稀释备用。在6孔板中种植200个细胞,置37℃培养箱继续培养24 h,室温下给予6 MeV电子线照射,照射剂量分别为0、2、4、6、8 Gy,照射后继续培养14 d,以甲醇固定15 min,结晶紫染色30 min,洗去染液后,在显微镜下计数>50个细胞克隆数。克隆形成率(%)=克隆形成数/接种细胞数×100%,存活分数(SF)=照射克隆形成率/对照克隆形成率,采用线性二次模型计算发射生物学参数,并拟合剂量存活曲线,实验进行3次独立重复实验,取均值。
1.2.6流式细胞术检测照射后各组T24细胞凋亡情况 分别收集经0 Gy和4 Gy照射后的各组T24细胞,用胰蛋白酶消化成单个细胞,收集细胞,PBS洗涤细胞2次,以Binding Buffer重悬细胞,在细胞悬液中依次加入Annexin-Ⅴ和PI各5 μl,轻轻混匀,室温下避光孵育15 min,立即上流式细胞仪检测细胞凋亡情况。
1.2.7Western blot检测照射后各组T24细胞Cleaved Caspase-3、Bax、PI3K和p-AKT蛋白表达情况 收集经4 Gy照射后的各组T24细胞,加入细胞裂解液提取蛋白,其中Cleaved Caspase-3一抗稀释比为1∶800,Bax一抗稀释比为1∶800,PI3K一抗稀释比为1∶1 000,p-AKT一抗稀释比为1∶1 000,其余步骤同1.2.3。

2 结果
2.1转染特异性c-Met siRNA对膀胱癌T24细胞中c-Met表达的影响 qRT-PCR检测结果显示,转染c-Met siRNA1和c-Met siRNA2的T24细胞中c-Met mRNA相对表达量较Blank组均有不同程度的降低(P<0.05),si-c-Met2组下降尤为明显,NC组和Blank组间c-Met mRNA相对表达量差异无统计学意义(P>0.05)。Western blot检测同样显示,与Blank组比,si-c-Met1组和si-c-Met2组c-Met蛋白表达水平均显著下调(P<0.05),si-c-Met2组c-Met蛋白表达水平下调较明显,而NC组和Blank组相比,c-Met蛋白表达水平差异无统计学意义(P>0.05)。见图1和表1。si-c-Met2对膀胱癌T24细胞中c-Met的靶向沉默作用更显著,因此选择si-c-Met2进行后续研究。
2.2沉默c-Met基因对T24细胞增殖能力的影响 MTT法检测Blank组、NC组和si-c-Met2组T24细胞转染24、48、72 h的A值,结果见表2所示,3组间相同时间点的A值比较,差异无统计学意义(P>0.05)。说明靶向沉默c-Met基因对膀胱癌T24细胞的增殖能力无较大影响。

图1 Western blot检测各组膀胱癌T24细胞中c-Met蛋白表达情况Fig.1 Western blot analysis of c-Met protein expression in bladder cancer T24 cells
2.3沉默c-Met基因增强T24细胞对放射的敏感性 克隆形成实验结果所示,与Blank组相比,4、6、8、10 Gy剂量照射后si-c-Met2组T24细胞克隆形成数明显减少(P<0.05)。而Blank组和NC组间细胞克隆形成数无明显改变(P>0.05)。Blank组、NC组和si-c-Met2组D0值分别为:5.91、5.89和3.65,SF2值分别为:0.85、0.84和0.61。与Blank组相比,si-c-Met2组T24细胞D0值和SF2值均明显降低,而Blank组和NC组相比,D0值和SF2值均无明显改变(P>0.05)。以线性二次模型拟合各组T24细胞剂量存活曲线,见表3和图2。表明靶向沉默c-Met基因能够增强膀胱癌T24细胞的放射敏感性。
2.4沉默c-Met基因提高照射条件下T24细胞的凋亡率 各组T24细胞接受0 Gy和4 Gy照射后,使用流式细胞仪检测细胞凋亡率,结果显示,Blank组、NC组和si-c-Met2组接受0 Gy时细胞凋亡率分别为:(3.01±1.38)%、(3.22±2.40)%、(8.08±3.83)%,各组细胞凋亡率比较无显著差异(P>0.05)。接受4 Gy时细胞凋亡率分别为:(20.36±2.08)%、 (21.17±2.98)%、 (48.79±6.11)%,si-c-Met2组细胞凋亡率明显高于Blank组(P<0.05),而Blank组和NC组比较差异不显著(P>0.05)。提示放射时靶向沉默c-Met2基因可促进T24细胞凋亡。见图3和表4。

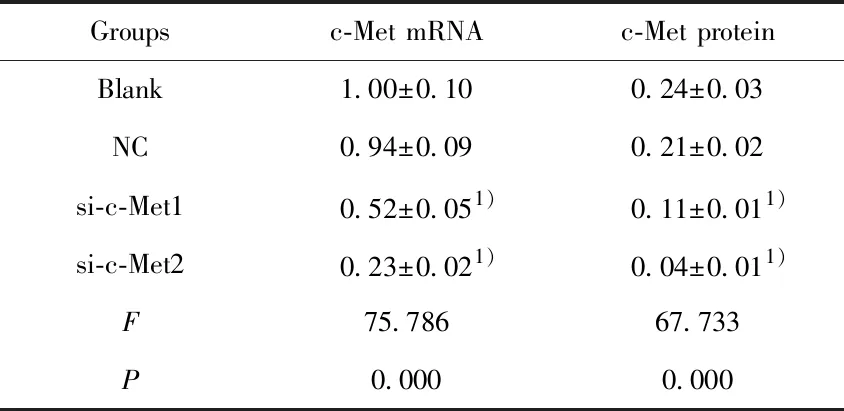
Groupsc-Met mRNAc-Met proteinBlank1.00±0.100.24±0.03NC0.94±0.090.21±0.02si-c-Met10.52±0.051)0.11±0.011)si-c-Met20.23±0.021)0.04±0.011)F75.78667.733P0.0000.000
Note:Compared with the blank group,1)P<0.05.
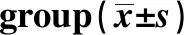

GroupsA value(λ=450)24 h48 h72 hBlank0.45±0.040.64±0.060.81±0.08NC0.43±0.040.62±0.050.80±0.08si-c-Met20.42±0.040.59±0.060.76±0.07F0.4380.5880.356P0.6650.5850.714
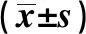

Note:Compared with the blank group,1)P<0.05.
图3 流式细胞仪检测各组T24细胞凋亡率Fig.3 Flow cytometry to detect apoptosis rate of T24 cells in each group
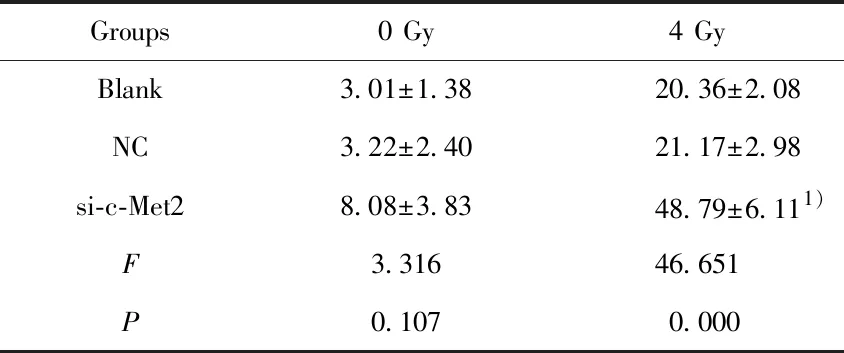
Groups0 Gy4 GyBlank3.01±1.3820.36±2.08NC3.22±2.4021.17±2.98si-c-Met28.08±3.8348.79±6.111)F3.31646.651P0.1070.000
Note:Compared with the blank group,1)P<0.05.

图4 Western blot检测T24细胞中蛋白表达情况Fig.4 Western blot analysis of protein expression in T24 cells
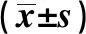


GroupsCleaved Caspase-3BaxPI3Kp-AKTBlank0.21±0.020.15±0.021.50±0.161.28±0.14NC0.20±0.020.14±0.021.47±0.151.25±0.13si-c-Met20.79±0.081)0.47±0.051)0.42±0.041)0.31±0.041)F142.62596.09168.50571.866P0.0000.0000.0000.000
Note:Compared with the blank group,1)P<0.05.
2.5沉默c-Met基因对照射条件下T24细胞中蛋白表达的影响 Western blot检测接受4 Gy放射后各组T24细胞中Cleaved Caspase-3、Bax、PI3K和p-AKT,结果如图4和表5所示,与Blank组比,si-c-Met2组T24细胞中Cleaved Caspase-3和Bax蛋白表达显著上调(P<0.05),PI3K和p-AKT蛋白表达显著下调(P<0.05),而Blank组和NC组各蛋白表达量比较差异不显著(P>0.05)。提示放射条件下靶向沉默c-Met2基因可上调T24细胞中Cleaved Caspase-3和Bax的表达,下调PI3K和p-AKT的表达。
3 讨论
膀胱癌的发病率在我国一直高居泌尿系统恶性肿瘤首位,严重影响着人们的身心健康[10]。膀胱癌患者术后易出现复发,导致患者预后不良,放射治疗作为术后防治肿瘤复发常用的辅助治疗手段而备受关注。但是,部分患者对放疗不敏感大大限制了其效果,因此增强膀胱癌的放射敏感性对膀胱癌的临床治疗尤为重要。c-Met基因编码的肝细胞生长因子受体是一种酪氨酸激酶,是酪氨酸激酶受体家族重要成员之一,能够通过招募下游信号分子激活磷酸化级联反应,引起一系列生物学效应[11,12]。研究发现,c-Met在多种癌组织中呈过表达,如食管癌、骨肉瘤和前列腺癌等,且可以调节癌症中的肿瘤生长、转移和存活[13-15]。前期研究检测到c-Met在膀胱癌组织中亦呈高表达。因此本实验在膀胱癌T24细胞中转染c-Met siRNA靶向沉默c-Met基因,经qRT-PCR和Western blot检测转染效果,发现转染c-Met siRNA能够有效靶向沉默c-Met基因。报道显示,c-Met还与各种肿瘤中的放射抗性有关[16,17]。关于肿瘤放射敏感性的具体机制目前尚不完全清楚,但研究显示,抑制细胞增殖、诱导细胞凋亡与增强放射敏感性紧密相关[18,19]。例如,c-Met敲低可通过破坏端粒稳态和抑制DNA损伤的修复来促进乳腺癌细胞的放射敏感性[20]。然而,c-Met基因是否参与膀胱癌细胞对放疗敏感性的研究尚无相关报道。因此本实验通过沉默c-Met基因探讨对膀胱癌放射敏感性的影响和潜在机制。
本实验结果表明,靶向沉默c-Met基因对T24细胞增殖能力无显著影响,而经放射线照射后,沉默c-Met基因的T24细胞克隆形成数目显著降低,细胞存活数减少。细胞凋亡是由一系列凋亡相关基因诱导的细胞自主有序的细胞过程。其中Bax是Bcl-2基因家族促进细胞凋亡的基因,其过度激活可促进细胞趋于死亡[21]。Caspase-3是细胞凋亡过程中关键蛋白酶,其激活形式Cleaved Caspase-3可促进细胞发生凋亡[22]。流式细胞仪检测结果显示,经4 Gy照射后沉默c-Met基因的细胞凋亡率显著高于对照组细胞。Western blot检测结果显示,经放射后各组细胞中Cleaved Caspase-3和Bax蛋白表达明显上调,提示沉默c-Met基因诱导的细胞凋亡与上调Cleaved Caspase-3和Bax的表达有关。本实验结果提示,沉默c-Met基因可通过促进放射诱导的细胞增殖抑制,增加放射诱导的细胞凋亡来增强膀胱癌T24细胞放射敏感性。为进一步探讨沉默c-Met基因调节膀胱癌的放射敏感性的机制,本实验通过Western blot检测了经放射后各组细胞中PI3K和p-AKT蛋白表达情况,结果显示,沉默c-Met基因的T24细胞中PI3K和p-AKT蛋白表达显著下调。PI3K是磷脂酰肌醇激酶,其激活可促进AKT的激活和转位,而PI3K和AKT异常表达可过度激活PI3K/AKT信号通路。研究表明,PI3K/AKT信号通路的过度激活降低肿瘤细胞放射敏感性[23,24]。通过阻断PI3K/AKT信号通路的活化来增强肿瘤细胞对放射的敏感性。Chen等[25]研究发现,Foretinib通过抑制c-Met的磷酸化并激活下游PI3K/AKT等信号传导途径来增强食管鳞状细胞癌的放射敏感性。据此提示靶向沉默c-Met基因可能通过抑制PI3K/AKT信号通路的激活增强膀胱癌T24细胞对放射的敏感性。
综上,本研究表明靶向沉默c-Met基因可增加膀胱癌T24细胞放射敏感性,其可能的作用机制与抑制PI3K/AKT信号通路的激活有关,本实验为膀胱癌放射治疗提供新的作用靶点。

