帕金森病模型细胞中p53、增殖细胞核抗原表达与细胞增殖和凋亡①
李 季 郭继东 张晓杰 杨 宏 李尊严 宋天琦 孙 微 冯 伟 李大伟
(北华大学第一临床医院,吉林 132011)
帕金森病(Parkinson′s disease,PD)是神经系统常见变性疾病,其主要病理变化为中脑黑质多巴胺能神经元逐渐变性凋亡,进而递质失衡而出现运动障碍为主的临床症状[1]。国内外文献证明外源性及内源性神经毒素诱导多巴胺能神经细胞变性凋亡在PD发病机制中发挥重要作用,而氧化应激在PD病理过程中起重要作用[2,3]。1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)是诱发PD的常见环境毒素。MPTP通过血脑屏障后代谢生成毒性1-甲基-4-苯基吡啶离子(MPP+),进入线粒体抑制呼吸链进而生成大量活性氧(reactive osygen species,ROS),最终导致多巴胺能神经细胞变性凋亡[4]。氧化应激导致多巴胺能神经细胞变性凋亡的分子机制至今未完全阐明,但DNA氧化损伤在PD病理过程中具有重要作用[5]。
目前,体外培养黑质多巴胺能神经元非常困难,因此可行的方案是以能大量增殖的类神经细胞作为对象来探讨MPP+细胞毒作用机制。PC12 细胞系是一种分化程度较低的肿瘤细胞,从大鼠肾上腺嗜铬细胞瘤分离得到,在形态、生理和生化功能等方面相似于正常神经细胞,且具有中等水平的多巴胺β-羟化酶活性。诱导PC12 细胞损伤模型,模拟体内自由基诱导细胞凋亡的过程,可作为多种神经性疾病的体外细胞模型[6]。
本研究建立了MPP+诱导的PC12细胞PD模型,探讨p53、PCNA表达与细胞增殖、凋亡及病理变化特征,探索多巴胺能神经元在氧化应激病理条件下变性凋亡的分子机制,为PD治疗提供新靶点及策略。
1 材料与方法
1.1材料
1.1.1主要试剂 DMEM高糖培养液及胎牛血清购于美国Gibco 公司;胰蛋白酶购于瑞士 LONZA 公司;MPP+、2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)、二甲基亚砜(DMSO)购于美国Sigma 公司;小鼠抗大鼠PCNA单克隆抗体和p53抗体购于美国BD公司;辣根过氧化物酶包被抗小鼠二抗购于美国Pierce公司;单链DNA试剂盒购于美国Chemicon Int公司。
1.1.2细胞株 PC12 细胞(大鼠肾上腺嗜铬细胞瘤细胞)购于中科院上海细胞库。
1.1.3主要仪器 CO2培养箱购于美国 Cellstar公司;超净工作台购于北京亚泰科隆公司;2S-1 型紫外线消毒车购于上海跃进医疗器械厂;液氮生物容器购于上海跃进医疗器械厂;电热恒温水浴箱购于上海跃进医疗器械厂;4℃冰箱购于中国西门子公司;荧光倒置显微镜购于日本欧林帕斯公司;550 型酶标仪购于美国 Bio-Rad公司;流式细胞仪购于美国BD公司,FACSCantoⅡ。
1.2方法
1.2.1PC12细胞复苏与传代 从液氮罐中取出PC12细胞冻存管,常规消毒。无菌条件下稍松动瓶盖后拧紧,封口膜封闭,快速置于37℃水浴箱中摇动融化。细胞解冻后取出冻存管,超净台中常规消毒后取出细胞悬液,经离心处理后弃上清,重悬细胞并接种于25 cm2培养瓶中,放置于37℃、5%CO2、90%湿度培养箱中进行培养。倒置显微镜观察细胞生长状态,细胞增殖达80%左右汇合进行传代。弃培养液并用PBS清洗细胞,然后用0.25%胰蛋白酶消化贴壁细胞、细胞计数。将细胞悬液在1 000 r/min、18℃的条件下离心5 min。根据计数结果调整细胞密度为1×105个/ml接种传代培养。传至3代细胞状态良好时选取对数生长期的细胞进行试验。
1.2.2MPTP诱发PC12损伤模型的建立 参考文献[6]建立MPTP诱发PC12损伤模型。取对数生长期PC12 细胞,调整至1×105个/ml,吸取0.2 ml 接种于96 孔板中,放入37℃、5%CO2培养箱中孵育24 h,弃去培养液,加入浓度为0(空白)、0.5、1、2 mmol/L 的MPP+的DMEM 培养基200 μl/孔,37℃、5%CO2培养箱中继续孵育24 h,每孔加入10 μl MTT(5 mg/ml),37℃、5%CO2培养箱培养 4 h,弃掉孔内液体,每孔加入 150 μl DMSO 并轻轻振荡以充分溶解甲臜颗粒,在酶标仪 570 nm处测量各孔的吸光度(OD)值,观察 MPP+对 PC12 细胞的毒性损伤作用。
1.2.3细胞内ROS检测 取对数生长期PC12 细胞,按损伤模型进行分组,加入无胎牛血清稀释的DCFH-DA(终浓度20 μmol/L),37℃继续培养30 min。收集各组细胞,流式细胞仪530 nm波长处检测ROS。
1.2.4细胞凋亡检测 DNA氧化应激损伤使用AO/EB凋亡染色进行检测。PC12细胞处理完成后加入荧光染料AO/EB,在荧光显微镜下观察细胞核形态。细胞核完整且被染成绿色的为存活细胞,核浓缩的为早期凋亡细胞,浓缩和碎裂且染成橘红色的为晚期凋亡细胞。同时,采用酶联免疫单链DNA试剂盒检测各组细胞DNA损伤,加入抗单链DNA单克隆抗体和过氧化物酶标记的二抗,在酶标仪405 nm处测各孔吸光值。
1.2.5Western blot检测p53和PCNA表达 各组细胞经相应处理培养结束后,收集细胞并裂解提取蛋白,测定浓度。参考文献[6]方法,进行各组蛋白电泳分离、转膜、洗膜。β-actin作为内参。小鼠抗大鼠PCNA单克隆抗体孵育过夜,经TBST洗涤,加入二抗室温孵育2 h显影。

2 结果
2.1不同浓度MPP+对细胞存活率影响 采用不同浓度MPP+(0、0.5、1、2 mmol/L)处理PC12细胞,反应48 h后,使用MTT法检测细胞活力,结果显示细胞活力随MPP+浓度增加而相应减少,呈剂量依赖性,与对照组比较,差异具有统计学意义(P<0.05,P<0.01),见图1。
2.2细胞ROS测定 MPP+诱导PC12细胞产生ROS,可以通过荧光染料DCFH-DA由流式细胞仪测定。DCFH-DA可通过细胞膜并在细胞内酯酶作用下生成DCFH。在细胞内ROS作用下,DCFH生成具有较强荧光性的DCF。结果显示随着MPP+浓度增强,荧光强度逐渐增强,与对照组比较,差异具有统计学意义(P<0.01),见图2。
2.3A0/EB凋亡染色检测细胞凋亡 单链DNA测定进一步证实随着MPP+浓度增加,PC12细胞变性凋亡亦随之增加,与对照组比较,差异具有统计学意义(P<0.05,P<0.01),见图3、4。

图1 不同浓度MPP+对PC12细胞存活率影响Fig.1 Effects of different concerntration of MPP+ on viability of PC12 cellsNote:Compared with control,*.P<0.05,**.P<0.01.

图2 不同浓度MPP+对PC12细胞产生ROS的影响Fig.2 Effects of different concentration of MPP+ on ROS productionNote:Compared with control,**.P<0.01.
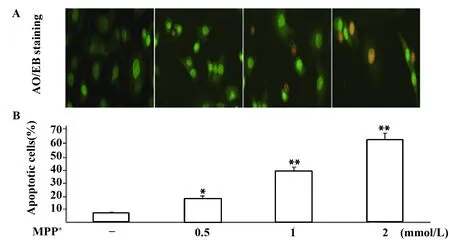
图3 A0/EB染色观察不同浓度MPP+对PC12细胞凋亡影响(×200)Fig.3 Effects of MPP+ on apoptosis of PC12 cells(×200)Note:Compared with control,*.P<0.05,**.P<0.01.
2.4MPP+对PCNA和p53蛋白表达的影响 采用Western blot检测了PD细胞模型中PCNA和p53蛋白的表达变化。结果表明当使用1 mmol/L MPP+处理PC12细胞后,在12、24、48 h MTT测得的细胞活力分别为87%、77%、61%,而PCNA蛋白表达水平亦逐渐降低。随着MPP+浓度增加,p53蛋白表达水平逐渐增加PCNA蛋白表达水平逐渐降低,见图5、6。
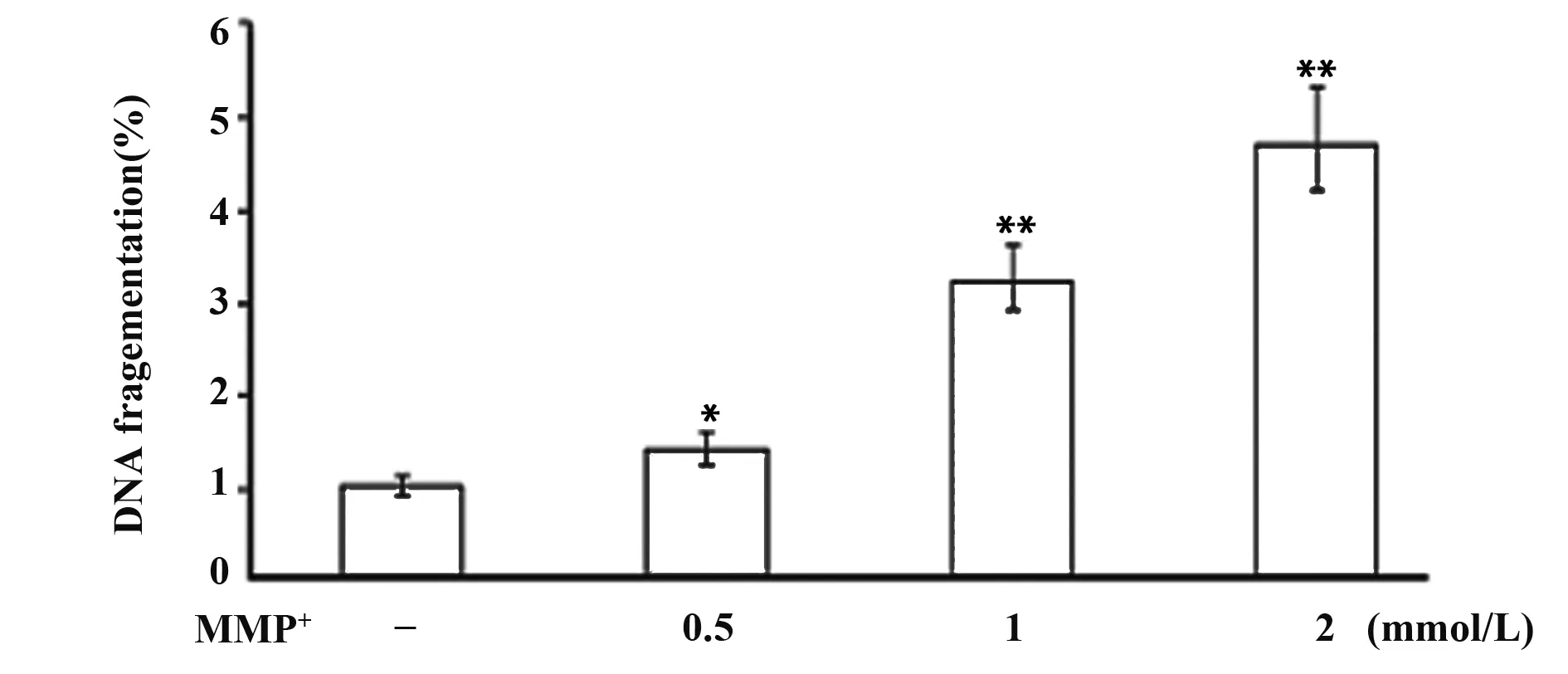
图4 不同浓度MPP+对PC12变性凋亡DNA变化的影响Fig.4 Effects of MPP+ on DNA fragments of apoptosis of PC12 cell linesNote:Compared with control,*.P<0.05,**.P<0.01.

图6 不同浓度MPP+对p53和PCNA蛋白表达影响Fig.6 Effects of different concentration of MPP+ on expr-ession of p53 and PCNANote:Compared with control,*.P<0.05,**.P<0.01.
3 讨论
PD临床主要特征为肌肉强直、运动减少、震颤及姿势步态异常,主要由中脑黑质多巴胺能神经元变性凋亡导致,其机制至今未明[7]。但更多证据表明,氧化应激促发了一系列凋亡信号,参与了PD多巴胺能神经元变性凋亡过程[8]。多巴胺能神经元因富含铁和脂质以及多巴胺自身代谢的原因,更易受氧化攻击[9,10]。PD尸检和动物实验均证实DNA氧化损伤更易出现在中脑黑质多巴胺能神经元,也证实了DNA氧化损伤是PD的重要病理机制[7]。DNA对细胞死亡和存活具有决定作用,因常遭受体内外有害物质攻击,因此DNA修复对于保持完整性极为重要。本研究在PD细胞模型中显示随MPP+浓度增加,ROS生成增多,呈剂量依赖性,多巴胺能神经元凋亡随之增加,进一步证实氧化应激与细胞凋亡关系密切,以及氧化应激参与PD病理过程,与国外报道一致[6,10]。
PCNA作为多功能蛋白,在染色体重组及DNA修复和细胞周期调控中具有重要作用[8]。PCNA无内在酶活性,可通过调节多种蛋白如周期蛋白依赖性激酶、周期蛋白依赖性激酶抑制因子p21等发挥其调节功能。PCNA在DNA氧化损伤修复中亦有重要作用[9]。实验证实随MPP+浓度和剂量增加,PCNA蛋白表达呈剂量依赖性减少,支持此蛋白参与了MPP+对多巴胺能神经元毒性损伤过程。另一方面,PCNA对维持DNA稳定性,抵御各种致病因素包括氧化应激对DNA的损伤具有重要作用,表达较少加重DNA在病理条件下损伤[10]。酶联免疫单链DNA测定同样证实了随着MPP+浓度增加,DNA损伤逐渐加重。提示PCNA表达降低与DNA氧化损伤程度具有相关性。
转录因子p53调节一系列靶基因,参与细胞生物过程,包括细胞周期、DNA修复、细胞凋亡和细胞应激反应[11]。在神经组织,p53介导细胞凋亡主要通过DNA损伤途径实现。氧化应激激活转录因子p53,引起DNA在氧化应激状态下损伤,其损伤机制在PD中未见报道。p53是PCNA上游信号蛋白,与特定序列结合后,调节此蛋白表达。高浓度野生型p53抑制PCNA启动子,减少PCNA蛋白生成[12]。在PD动物模型中已证实p53高表达与多巴胺能神经元变性凋亡密切相关,p53抑制因子可有效阻止PD模型中多巴胺能神经元在氧化应激状态下损伤[13]。本实验在PD细胞模型中,MPP+增加ROS生成和p53表达,证实氧化应激激活p53使其高表达,及p53参与PD病理多巴胺能神经元变性凋亡过程,与文献报道一致[14,15]。
本实验同样证实了随着MPP+增加PCNA表达减少,且与p53表达量呈负相关;随着PCNA表达减少,DNA氧化损伤逐渐加重,多巴胺神经元凋亡逐渐增加。这些实验提示在PD模型中,PCNA介导细胞凋亡可能是PD多巴胺能神经元变性凋亡分子机制之一,且ROS/p53/PCNA信号途径参与这一过程。
通过PC12细胞建立的PD模型病理变化特征,我们推测MPP+介导多巴胺能神经元氧化损伤可能机制之一是通过p53/PCNA信号途径实现的。氧化应激激活p53,减少下游信号蛋白PCNA生成,加重DNA氧化损伤,导致多巴胺能神经元变性凋亡。这一分子机制需进一步证实,可为PD治疗提供新分子靶点和策略。

