三氢化铝释氢改性调控方法及机理研究进展*
袁雪玲,李和平,,庞爱民,刘建忠,唐 根,徐星星,黄雪峰
(1.浙江大学 能源清洁利用国家重点实验室, 杭州 310027;2.杭州电子科技大学 能源研究所,杭州 310018;3.航天化学动力技术重点实验室,湖北航天化学技术研究所,襄阳 441003)
0 引言
AlH3,二元共价氢化物,室温下为亚稳态结晶固体,理论质量储氢密度高达10.1%,体积储氢密度高达0.148 kg H2/L,远高于目前大多数金属氢化物,是极具潜力的储氢材料,能够用作还原剂、催化剂、燃料电池、固体推进剂、炸药等。AlH3有α、α′、β、γ、δ、ε、ζ七种晶型,其中α态具有最高的热稳定性[1],在实际应用中是最理想的相态。没有特别说明的话,AlH3均指α-AlH3。AlH3作为固体推进剂的高能添加剂,由于其具有燃烧产物平均相对分子质量小和吸热释氢降低燃烧温度的性能,不仅可以提高推进剂的比冲,还可以有效减少高温燃气对发动机喷管的侵蚀,是固体复合推进剂中替代铝粉的理想燃料[2-6]。NASA CEA结果表明,与目前的AP/HTPB火箭推进剂相比,用AlH3替代铝将使比冲增加10%[7],并使火焰温度降低5%[8]。目前AlH3用于推进剂的首要问题是必须合成出本身水解稳定性好、热稳定性好、可长期储存及感度低的AlH3,并形成批量稳定产品;然后进一步对AlH3进行改性、降感、包覆,得到适合HTPB(端羟基聚丁二烯)、NEPE(硝酸酯增塑聚醚)、GAP(聚叠氮缩水甘油醚)及高能炸药等应用需求的AlH3,并提供专用降感剂、包覆剂及工艺助剂;针对AlH3开发更具针对性的推进剂体系(固液、铝冰(ALICE)、凝胶)[9]。
由于氢气的单位能量为33 000 Wh/kg,是所有燃料中最高的,因此常作为燃料电池的燃料。AlH3能够在相对低的温度范围(100~200 ℃)解吸[10],且具有轻质、高能量、无毒、可回收、易于运输等优点,可以作为储氢材料用于燃料电池,提供氢源[11]。目前常用的质子交换膜燃料电池一般在85~100 ℃工作,还需要对AlH3进行改性处理,降低其释氢温度范围[12-13]。无论是加速还是稳定释氢,都需要深入研究AlH3的释氢机理,从而得到调控释氢速率的方法。
本文综述了目前国内外AlH3稳定化和加速AlH3分解的方法,总结AlH3释氢改性和调控机理,并提出未来AlH3用于推进剂和燃料电池的重点研究方向。
1 AlH3释氢机理
AlH3受热分解为金属Al和氢气,为吸热反应,图1为AlH3释氢前后的扫描电子显微镜(SEM)照片[14]。可见,AlH3颗粒为多面立方体,对比发现释氢后样品表面出现明显的孔洞。1981年,Herley等[14-16]进行了AlH3分解过程的研究,实验结果表明热分解曲线为S型,可将曲线划分为诱导期,加速期,衰变期,如图2所示[17]。图2中,(Ⅰ)诱导期释氢速率较慢,对应于铝核的形成;(Ⅱ)加速期的释氢速率显著提高,释放总量60%的氢气;(Ⅲ)衰变期的释氢速率下降,直到释氢完成。

(a)Before (b)After
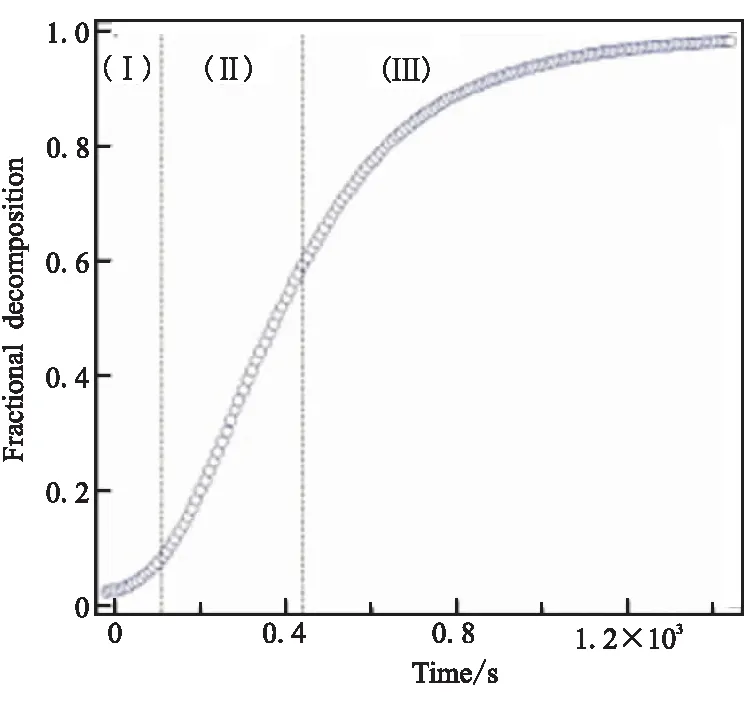
图2 180 ℃下AlH3等温分解曲线图Fig.2 Isothermal decomposition curve of AlH3 at 180 ℃
2005年,Ismail等[18]使用热重分析(TGA)研究了AlH3在氩气中的热分解机理,通过固态转化动力学中的成核和生长机理来解释AlH3的热分解包括2个连续的步骤:步骤1是缓慢的成核反应,在AlH3颗粒的外表面形成铝核;步骤2是铝核增多形成的铝层后,向颗粒中心生长。
图3给出了AlH3在100 ℃下成核速率和生长速率的对比,生长速率远高于成核速率,因此说明成核反应是控制AlH3整体分解速率的决定步骤。
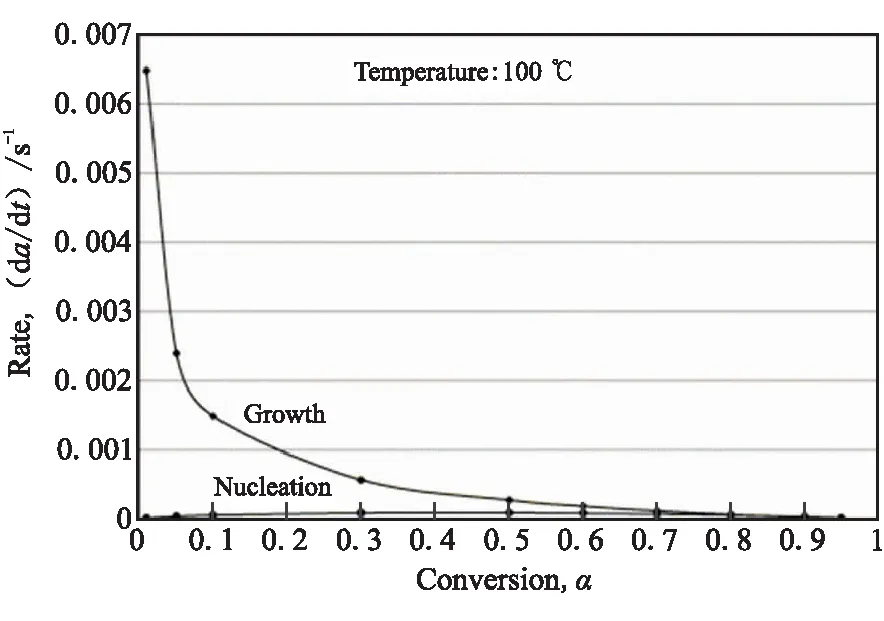
图3 AlH3在100 ℃下成核速率和生长速率的对比Fig.3 Comparison of nucleation rate and growth rate of AlH3 at 100 ℃
Graetz等[19-20]在60~140 ℃之间进行AlH3等温释氢研究,同样得到释氢曲线为S型,表明AlH3的分解为自催化反应,由金属Al相的成核和生长来控制分解过程,并不受到通过表面氧化物的氢气扩散的限制。但表面氧化物的存在可以阻止AlH3开始释氢,即抑制成核反应的发生,增加材料的稳定性。Kato等[21]利用原位X射线光电子能谱仪(XPS)结合热解吸光谱仪研究释氢过程中AlH3表面的变化,室温下,AlH3的释氢被表面的氧化层所阻止,并由于AlH3的热膨胀系数(5×10-5K-1)远大于Al2O3的热膨胀系数(0.9×10-5~2×10-5K-1),所以在受热膨胀时,氧化膜发生破裂使得AlH3表面暴露于气相,只有AlH3表面与气相接触才能够开始释氢,如图4所示。
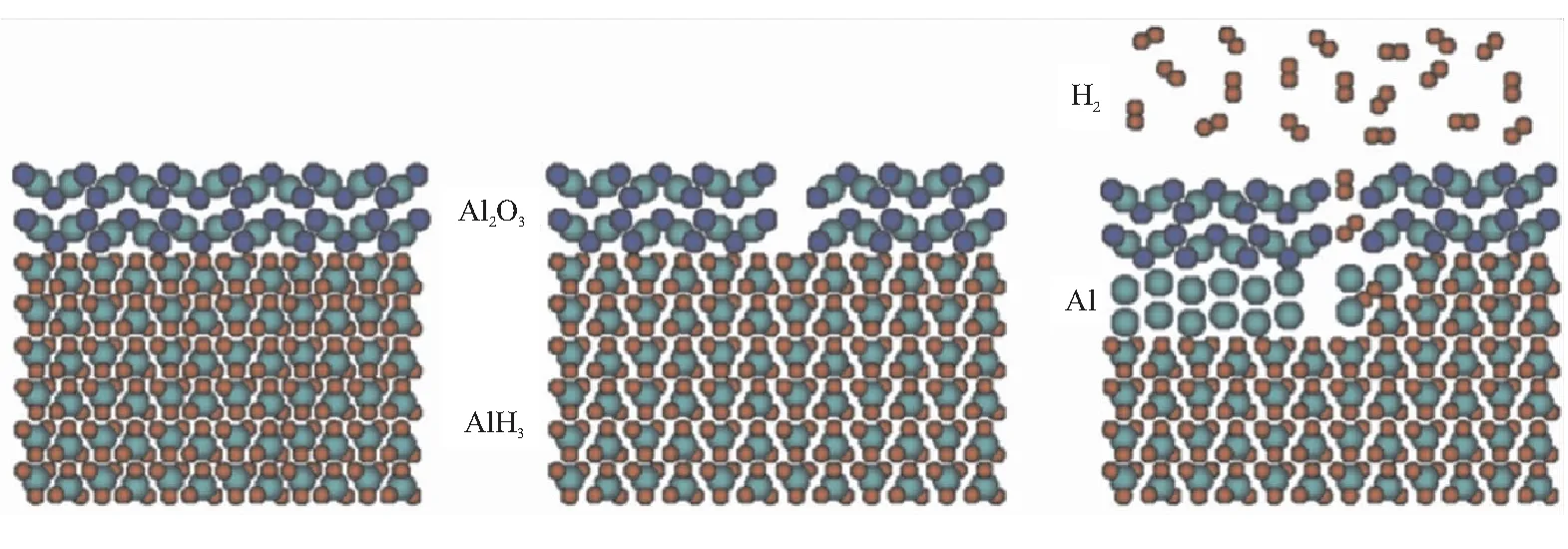
(a)Surface oxide layer inhibits hydrogen desorption (b)Surface oxide layer fragmentation (c)Hydrogen formation and metal Al growth
Feng等[22]通过反作用力场分子动力学模拟研究了AlH3热分解和氧化的基本反应机理,模拟出AlH3核-Al2O3壳纳米颗粒,发现其结构演变主要分为三个阶段:
(1)预扩散,核内H原子向外扩散遍及整个壳层表面,并且壳外O原子向内移动;
(2)核-壳结合,核内和壳外Al原子交换和混合,并伴随核-壳边界缩小;
(3)后扩散,核壳结构完全消失,所有混合的原子在周围稳定扩散。这与Kato等提出的解析机理较为吻合。
如图5所示[22],在氢气形成释放前,两个氢原子的结构有四种:
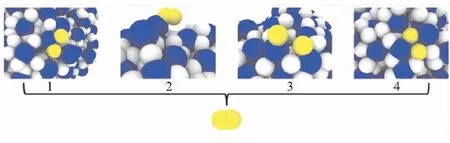
图5 H2形成释放前,两个H原子的结构(H原子:白色,突出强调的H原子:黄色;Al原子:蓝色)Fig.5 The structure of two hydrogen atoms before the formation of hydrogen(H atom:white,highlighted H atom:yellow;Al atom: blue)
(1)两者都附着在同一个Al原子上;
(2)两者首先结合在一起,其中一个连接在Al原子上;
(3)与两个相邻的Al原子分开;
(4)与两个相邻的Al原子共享。
同时,通过Arrhenius公式计算得到AlH3的分解活化能约为102.2 kJ/mol,远小于Herley等测得的150 kJ/mol,分析产生此差距的原因为Graetz等人合成的AlH3有较小的颗粒尺寸和较少表面氧化物。Tarasov等[23]通过核磁共振波谱法(NMR)来检测AlH3分解过程中Al相的形成和生长,在等温条件下得到三个分解阶段的活化能:诱导期为97 kJ/mol,加速期为112 kJ/mol,衰变期为108 kJ/mol。
通过已有文献对AlH3分解机理的研究,AlH3在诱导期颗粒表面形成金属Al核,而表面成核反应是控制AlH3整体分解速率的决定步骤。因此,AlH3用于固体推进剂时,其改性手段集中于减少其表面成核位点来阻止成核反应的发生,提高稳定性;AlH3用于燃料电池时,各种改性调控方法应基于缩短诱导期增加Al的成核位点,来降低AlH3的释氢温度,通过控制温度来控制释氢速率。
2 AlH3稳定化改性方法的
AlH3作为固体推进剂的组分,要求稳定存放而无分解,但AlH3对光、热、电、摩擦、撞击等敏感,影响推进剂的制备、储存和运输,因此有必要对AlH3进行有效的稳定化处理。目前稳定化的方法主要为表面钝化法、表面包覆法和添加稳定剂。
2.1 表面钝化法
表面钝化法的主要目的是对AlH3颗粒表面进行处理,使其表面形成氧化膜。释氢反应是从AlH3表面开始进行,因此氧化膜的存在可以阻止AlH3开始释氢,提高材料稳定性。Petrie等[24]使用不同种类的稀酸(盐酸、硫酸、硼酸、高氯酸、磷酸、氟化氢酸,溴化氢酸等)处理AlH3,对比发现,盐酸最适合用来酸洗,最佳浓度(V/V)为10%,因为通过酸洗能使AlH3表面产生Al(OH)3和Al2O3保护层,提高了AlH3的热稳定性。
CHEN Rong等[25]在70 ℃的真空条件下,采用原子层沉积技术在AlH3颗粒表面沉积纳米厚度的Al2O3使其钝化,钝化后氢含量降低了约5%,主要是因沉积Al2O3后H含量减少。通过水热老化试验来研究钝化后的AlH3对水蒸气和氧气的敏感性,发现钝化后AlH3保留的氢容量是未处理样品的4倍,说明此方法能有效提高AlH3的稳定性。钝化层使摩擦感度从96%降低至68%,且钝化前后AlH3的释氢速度大致相同,说明钝化层不会影响AlH3的能量释放能力。此技术的优点在于钝化层致密且厚度均匀可控,不影响之后AlH3的能量释放,且提高了摩擦耐热性,便于运输。
Nakagawa等[10]研究Al2O3厚度对释氢过程的影响,将AlH3颗粒暴露在空气中来改变Al2O3的厚度,图6显示释氢峰值温度与暴露时间的关系,氧化膜厚度在4.6~7.8 nm范围内,峰值温度几乎保持不变,存在氧化膜时,释氢动力学不取决于Al2O3的厚度大小。另外,图6(b)表明AlH3在Ar气氛围中研磨后,释氢峰值温度显著降低,没有氧化膜的存在可显著增强释氢动力学,可运用表面钝化法来产生氧化膜抑制释氢使其稳定。
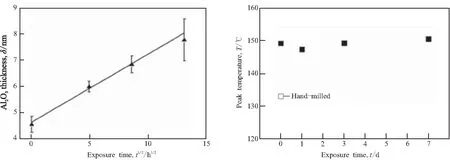
(a)Al2O3 thickness (b)Peak temperature
表面成核反应是控制AlH3分解释氢的关键步骤,采用表面钝化法产生氧化膜并减少成核位点,阻止成核反应的发生,能够让AlH3保持稳定,且钝化层不会影响之后AlH3的能量释放,钝化层的厚度也不会影响释氢过程,但不同厚度下AlH3机械感度可能会有所不同,这需要今后进一步研究。
2.2 表面包覆法
表面包覆法主要是使用惰性材料涂覆至AlH3的表面,产生相对惰性的表面层,隔绝与外界空气和水分的接触,在一定程度上增加AlH3的稳定性。
SELF等[26]使用含有二苯基乙炔的苯溶液来洗涤AlH3,使二苯基乙炔包覆AlH3,在其表面形成小分子包覆层。包覆前的AlH3在60 ℃下分解1%需13 d,而包覆后则需29 d,AlH3的热稳定性显著提高,并且AlH3热稳定性随包覆量的增加而增加。但此包覆方法并未确定包覆过程中是否发生脱氢和氧化过程。
秦明娜等[27]采用溶剂-非溶剂法将硬脂酸均匀包覆在AlH3表面,包覆前后的AlH3的物性结构与晶体形貌并未改变,包覆过程中未出现严重的脱氢和氧化现象,说明此包覆法有效可行。按GJB 5891.27—2006使用静电火花感度仪进行静电感度测试,包覆后AlH3的E50由包覆前的367 mJ降低至测试上限5390 mJ时未见发火,静电感度大幅降低,分析原因为硬脂酸包覆在AlH3的表面,形成的层状蜡质物具有物理隔离作用,从而降低外界静电对其刺激。但此研究未探讨AlH3包覆后的释氢规律及热稳定性。
朱朝阳等[28]用自行合成的小分子包覆剂(胺脲类化合物)包覆AlH3,将包覆前后的AlH3同时在20 ℃、相对湿度90%环境下放置2~16 d,通过对比包覆前后AlH3的XRD图,发现未包覆的AlH3在10 d后即分解,而包覆后的AlH3在16 d后仍保持很好的稳定性。分析其原理发现,包覆剂中有机官能团与AlH3进行配位螯合,有效消除AlH3晶体本征缺陷态,实现AlH3的稳定。同时推测,由于AlH3+和自由电子能够进一步引发AlH3的分解,当包覆剂与AlH3紧密结合时,能够有效抑制AlH3+和自由电子的形成。但考虑到并不明确包覆剂具体成分,还需研究包覆后材料与固体推进剂成分的相容性等问题。
为使包覆更加均匀,CAI X W等[29]使用液态CO2作为反溶剂来包覆AlH3,选择的包覆材料为氟橡胶(FE26),液态CO2能够使FE26均匀地包覆在AlH3表面且不改变其晶型,并通过XPS分析计算了FE26包覆层的厚度为3.6 nm,使用傅立叶变换红外光谱和差示扫描量热法(DSC)分析表明包覆后的AlH3热稳定性提高,测试包覆前后的静电感度,E50由包覆前的63.71 mJ降低至85.24 mJ,包覆后的AlH3静电感度下降。采用此包覆方法操作简单、使用范围广并且不污染环境。
另外,包覆材料在AlH3表面形成的包覆层能够起到物理隔离的作用,从而降低机械感度,避免了与推进剂成分的直接接触,提高了相容性。表面包覆法是解决高能材料适用性、稳定性、相容性的主要技术手段,在实际中更具有运用前景,需要根据不同的需求选择合适的包覆材料和包覆方法。
2.3 添加稳定剂
在合成过程中掺入自由基接受体稳定剂或者某些金属离子化合物,可以有效提高AlH3的稳定性。但添加稳定剂的同时会引入杂质离子,导致AlH3的纯度下降,影响其性能,最近的国内外研究中,对此方法的探索比较少。
刘明星等[30]向经过稀酸处理过的AlH3中分别加入石墨和Al粉,发现加入石墨并不能降低静电感度,而加入Al粉(AlH3与Al粉的比例为3︰1)能够有效降低静电感度。但这种物理混合容易造成材料组分不均一,材料的批次质量不稳定,给后续应用研究带来极大不便。邢校辉等[31]选择富勒烯类化合物作为稳定剂,无机盐作为研磨剂制得AlH3,在60 ℃下贮存3个月,发现AlH3的分解小于1%,有效提高了AlH3的热稳定性。此方法操作简单,绿色高效,易于工业化生产。
通过以上研究,可见提高AlH3稳定性的方法和机理主要是在表面形成氧化膜或减少表面缺陷,以减少AlH3表面成核位点阻止AlH3进入诱导期开始分解释氢,维持AlH3的稳定性。
3 AlH3释氢加速性方法
AlH3用于储氢燃料电池时,要求其在低温下(T≤ 100 ℃)有较快且可控的释氢速率。目前常见的提高释氢速率的方法有光处理,球磨和掺杂等。
3.1 光处理
Herley等[17]研究了紫外光对AlH3释氢的影响,发现紫外光的辐射缩短了AlH3分解过程中的诱导期,增加了晶体分解位点,提高了释氢性能。Gabis等[32-34]研究也得到同样的结果,且给出了紫外光促进AlH3分解的机理。因为紫外光的照射,AlH3晶体表面失去大量来自氢原子的电子,氢原子从铝原子间的Al-H-Al桥键转移到空隙的几率增大,形成氢空缺,氢空缺聚集、合并导致金属Al核的形成,且随着张力蔓延,氢空缺增多,铝核不断由外表面向晶体中心生长,晶体孔隙度增加,释氢加速。如图7所示,比较同一温度下有无紫外光照射的AlH3的分解曲线,发现经紫外光照处理的AlH3的释氢速率更高,更快的达到完全释氢,原因是紫外照射后的AlH3有更短的诱导期和更多的成核位点。

图7 不同温度下,AlH3经紫外光照射后与未经照射的分解曲线图Fig.7 Decomposition curve of AlH3 after irradiation with ultraviolet light at different temperatures and without irradiation
3.2 球磨和掺杂
使用球磨和掺杂过渡金属(Ti,Nb等)或碱金属氢化物(LiH等),是提高AlH3释氢性能的常用方法,国内外学者进行了大量相关的研究。
Sandrock等[35]将少量碱金属氢化物(LiH,NaH,KH)掺杂到AlH3中,在氩气气氛中球磨1 h后,发现AlH3的解吸温度降低(100~125 ℃),释氢速率有所提高。对比释氢温度和释氢量,发现最佳的添加剂为LiH。LiH提高释氢的机理如图8所示,AlH3与LiH在球磨过程中机械合金化形成的LiAlH4颗粒作为表面Al2O3层的“窗口”,将氢从AlH3相转移到外部空间。同时,当LiH和Ti混合掺杂,能够增强LiAlH4颗粒吸附性,进一步提高释氢性能。
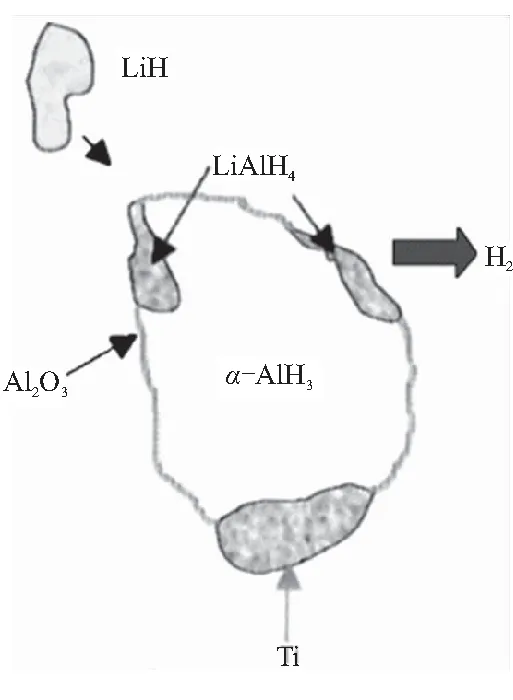
图8 球磨过程中LiH +AlH3⟹LiAlH4机械合金化反应,产生H2的LiAlH4窗口示意图Fig.8 Schematic representation of LiH + AlH3⟹LiAlH4 mechanical alloying,reaction during ball milling to produce H2-transparent LiAlH4 windows
Duan等[36]在LiH/AlCl3反应体系中掺杂TiF3,试验测得研磨5 h后形成的AlH3的平均晶粒尺寸约为45 nm(未添加TiF3时为56 nm[37])。因此,掺杂TiF3可诱导形成更小纳米尺寸的 AlH3。同时,掺杂TiF3后的AlH3释氢活化能56.8 kJ/mol降低到51.6 kJ/mol,释氢性能得到改善。
陈田等[38]发现经过球磨处理有利于AlH3释氢。因为经球磨处理的AlH3颗粒尺寸减小,比表面积增大,且颗粒表面的缺陷和应力增加,有利于氢气扩散,降低了AlH3的释氢势垒。并在AlH3添加NbC后再球磨处理,XRD分析结果显示,NbC不参与释氢反应,但能够起到催化作用,同时可以在球磨时起到分散作用,减少颗粒尺寸,提高比表面积,增加缺陷和应力,促进氢气释放。研究还发现手工研磨的AlH3+1mol %NbF5,在研磨过程中样品就发生了分解,可见NbF5能够显著提高AlH3的释氢。因为AlH3颗粒表面的Al2O3氧化膜阻挡氢气的逸出,使得AlH3在常温下为亚稳态,当AlH3表面氧化膜破裂,AlH3核表面与外界气相接触开始释氢。而NbF5很容易破坏AlH3颗粒表面的Al2O3氧化膜,促进AlH3释氢。
另外,Nakagawa等[39]发现在AlH3中掺杂NbF5后开始释氢的温度为60 ℃,峰值释氢温度为120 ℃,释氢活化能为96 kJ/mol,与未处理的活化能111 kJ/mol相比有所降低。分析其显著改善释氢性能的原因是球磨过程中NbF5与AlH3(表面Al2O3膜)反应产生的AlF3对释氢有催化作用,如图9所示。
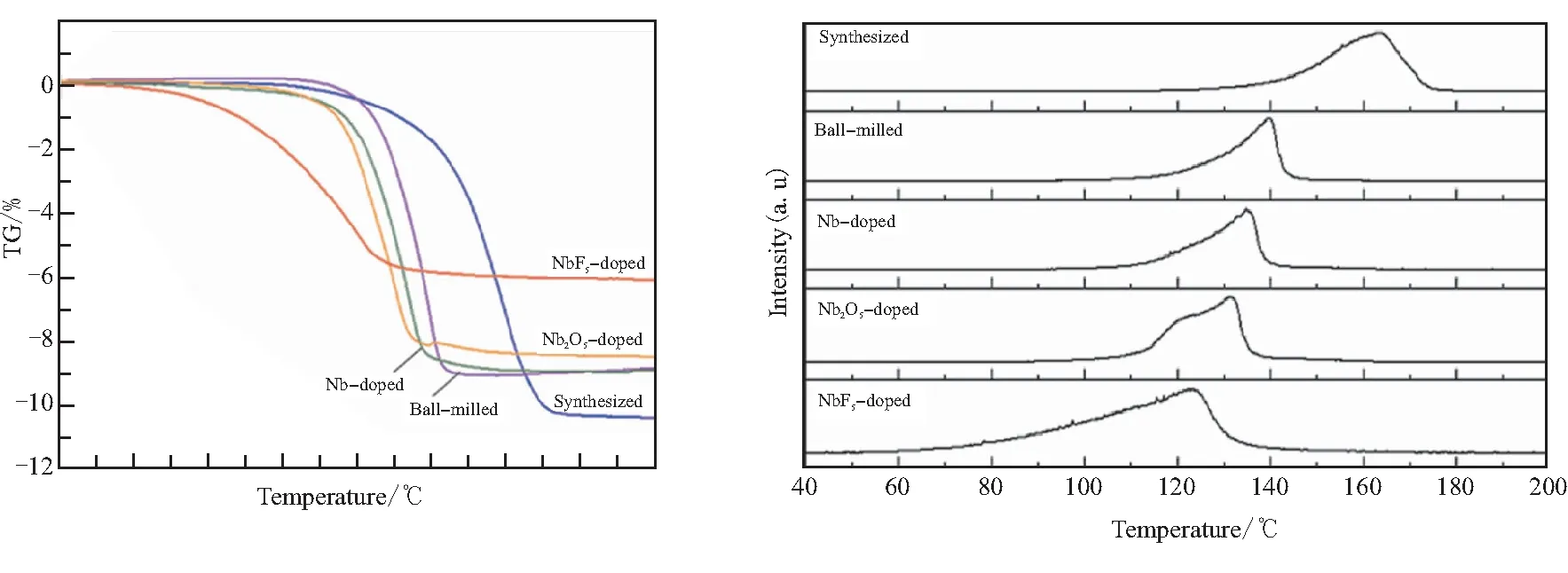
(a)Thermogravimetric analysis curves (b)Mass spectrum curves
通过球磨和掺杂处理AlH3,主要是通过破坏AlH3表面氧化层,增加金属Al相的成核位点来提高释氢性能。在Graetz等[16]的总结中提到,使用热处理、光处理、球磨等方法提高AlH3的释氢速率,都是为了增加金属Al相的形成来缩短诱导期。Gabis等[40]发现AlH3表面解吸形成的金属Al区域能够充当进一步解吸的核,解吸形成的多孔铝结构使氢从AlH3到表面的扩散路径更短。因此在AlH3表面形成金属铝区域的方法,均能够增加AlH3的分解速率。
3.3 外界条件的影响
AlH3的释氢过程还会受到外界因素的影响,如粒径大小、温度、气氛、压力等。Sandrock等[11]通过改变球磨时间来控制AlH3的粒径,粒径大小通过SEM估算,在加热速率为2 ℃/min的条件下测释氢量,试验发现不进行球磨的样品(粒径约100 μm)释氢温度范围为175~200 ℃,球磨1 h的样品(粒径约1 μm)释氢温度范围为125~175 ℃,球磨3 h的样品(粒径约0.3 μm)释氢温度范围为100~150 ℃,研究结果表明粒径减小能够降低释氢温度范围。Ismail等[18]通过建立满足KJMA方程[38]的动力学模型,预测在低于10 ℃的惰性气氛中,15 a内AlH3的分解非常小,约为0.1%。但如果在30 ℃下存储15 a,材料可能损失其全部氢含量。因此,不建议在较高温度下存放AlH3。Milekhin等[42]使用TGA和DSC研究AlH3在氮气,氩气和空气中的热分解过程。在氩气或氮气氛围下,相对于AlH3样品的初始质量,H2释放后剩余沉淀物的质量增加了0.5±0.3%,原因是H2释放后,氮气和氩气能吸附在残留物颗粒中,且在氮气和空气氛围中继续升高温度,能与Al反应生成AlN和Al2O3。而用于固体推进剂时,AlN的生成会影响金属Al的燃烧性能,因此为避免气氛影响,热分解时可以选择氩气氛围。
通过光处理,球磨,掺杂或改变外界条件等方法处理AlH3后,释氢性能得到改善,其中可在AlH3生产过程中对其进行掺杂改性处理,实际应用更加方便,但最终还需要根据实际情况选择合适的改性方法。
4 结束语
表面成核反应是控制AlH3整体分解速率的决定步骤,通过控制表面成核位点的数量可以改变AlH3的释氢性能。在未来的研究中需要进一步对释氢改性调控方法和机理进行研究,具体如下:
(1)AlH3自身理化特性(如表面缺陷等)和外界环境(如气氛、压力等)对释氢性能影响机理是提出改性调控方法的基础,但相关研究比较少,可以作为后续研究的重点。
(2)AlH3用于固体推进剂时,需要研究AlH3与推进剂各组分的相互作用机理,以及各组分对AlH3释氢过程的影响本质,确定可以稳定贮存的AlH3高能推进剂配方。
(3)AlH3用于燃料电池时,需要研究释氢速率可控的方法。同时,还应探究分解产物Al的循环利用问题,找寻低成本再生AlH3的方法。
致谢:感谢国家自然科学基金和航天化学动力技术重点实验室开放基金资助。

