绝经前后乳腺癌患者临床病理特征及肿瘤分子分型的相关性分析
徐玲玉 杨荣华 陈玉芳 李子燕
江苏省常州市肿瘤医院 1 乳腺外科 2 病理科 213000
目前,乳腺癌在全球女性恶性肿瘤中发病率和死亡率居第一位,并且有一个重要特征是年龄发病率呈现双峰分布,我国女性发病率和死亡率在全球处于比较高的水平,并且有逐年增长的趋势,随着社会经济的发展,女性生活方式发生显著改变,乳腺癌年轻化趋势日益显著,流行病学相关研究显示,在传统确认的乳腺癌危险因素下,基于分子分型的乳腺癌病理因素研究对于正确判断乳腺癌预后因素起着越来越重要的作用。本研究对2014年2月—2018年8月期间我院收治的49例绝经前女性与53例绝经后女性乳腺癌的临床病理特征和肿瘤分子分型进行分析,指导临床治疗及预后判断。
1 资料与方法
1.1 临床资料 选取2014年2月—2018年8月期间我院收治的49例绝经前与53例绝经后女性乳腺癌患者。
1.2 ER、PR、HER-2、Ki-67检测方法 (1)抗体:ER、PR为兔抗人单克隆抗体,购自西雅金桥生物有限公司,HER-2为兔抗人单克隆抗体,购自瑞士罗氏公司。(2)免疫组织化学染色。实验方法:应用瑞士罗氏公司全自动免疫分析仪(VENTANA XT)进行检测,以已知阳性片作阳性对照,以空白片作阴性对照,一抗选用西雅金桥生物有限公司,二抗及显色系统均为全自动免疫染色仪自带封闭套盒,衬染液为Gill苏木精染色液。具体步骤如下:(1)每张石蜡切片的玻片上标记一抗名称;(2)根据所需检测免疫组化项目,电脑输入免疫组化号与各一抗的名称,Ebar条码打印机打印出来标签后对应贴到每张防脱片玻片上,全自动仪器不需要额外烤片;(3)仔细检查机器自带试剂与各散装试剂是否足够完整实验;(4)将标签表面水分与切片背面擦干,平稳放置于切片盘上;(5)将DAB试剂盒、苏木素、返蓝液等试剂置于检测试剂架上(注意擦干条形码上水珠);(6)准备完毕后,电脑启动运行程序;(7)染色完成后,打开切片盘,取出切片后先入洗洁精去玻片表面油质,然后常规脱水、透明、封片;(8)使用仪器自带清洁功能清洗仪器。
1.3 结果判定 所有乳腺组织标本均用4%甲醛固定24h,常规石蜡包埋后连续切片,HE染色,光镜观察。采用免疫组化SP法染色。试剂盒购于北京中杉金桥生物技术有限公司。免疫组织化学染色结果由两名有经验的病理科医生阅片。(1)ER、PR的阳性标准:ER、PR均定位于细胞核,肿瘤细胞核中出现棕黄色颗粒着色即为阳性细胞。阳性细胞≥1%定义ER或PR为阳性。PgR 20%阳性作为Luminal A型和Luminal B型的临界值。(2)HER-2的阳性标准:HER-2阳性细胞染色的信号位于胞膜,阳性标准为胞膜染色或胞膜胞浆同时染色,单独胞浆染色不计为阳性。其中>10%的浸润癌细胞呈现不完整的、细胞膜染色判定为(1+),>10%的浸润癌细胞呈现不完整和/或弱~中等强度的细胞膜染色或者≤10%的浸润癌细胞呈现强而完整的细胞膜染色判定为(2+),>10%的浸润癌细胞呈现强、完整且均匀的细胞膜染色判定为(3+),本研究将HER-2(2+)及以下者定义为阴性,HER-2(3+)定义为阳性。(3)Ki-67数值判定:对于阳性细胞分布较均匀的肿瘤细胞,随机选取3个或以上浸润性癌高倍镜视野计数,得出平均Ki-67指数,<15%为低表达,>30%为高表达。以肿瘤细胞核呈棕色为阳性细胞,Ki-67指数指100个细胞中Ki-67阳性细胞数。每张切片于400倍镜下选定10个视野,每个视野计数100个细胞,计算每张切片上阳性表达的细胞个数即Ki-67增殖指数。
1.4 分子分型方法 见表1。
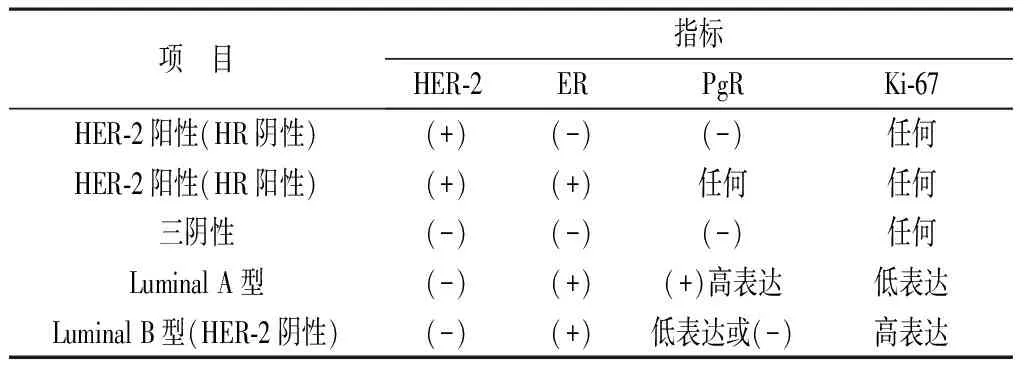
表1 分子分型方法
1.5 统计学方法 采用SPSS19.0软件进行统计学分析,计数资料组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 绝经前、后肿瘤的病理类型、组织学分级、肿块大小、淋巴结转移情况 绝经前后患者在病理类型方面无明显差异(P>0.05),绝经前组在肿瘤组织学分级Ⅲ级、原发肿瘤直径≥2cm、腋窝淋巴结阳性比例均较绝经后组高,差异有统计学意义(P<0.05)。见表2。

表2 绝经前、后肿瘤的病理类型、组织学分级、肿块大小、淋巴结转移情况(n)
2.2 绝经前、后肿瘤的分子分型情况 绝经后组Lumina型比例较三阴性或HER-2阳性型高于绝经前组,差异有统计学意义(P<0.05)。见表3。

表3 绝经前、后肿瘤的分子分型情况(n)
2.3 绝经前、后肿瘤组织ER、HER-2表达与腋窝淋巴结转移情况 绝经前组HER-2阳性且淋巴结阳性者比例较ER阳性且淋巴阴性高于绝经后组,差异有统计学意义(P<0.05)。见表4。

表4 绝经前、后肿瘤组织ER、HER-2表达与腋窝淋巴结转移情况(n)
3 讨论
流行病学调查发现,乳腺癌在45岁左右发病率随年龄增长迅速增高,全球约70%的乳腺癌发生在45岁以上,我国45岁以上女性乳腺癌占所有病例的69.75%[1],我国乳腺癌地区分布差异明显,主要由社会经济发展和生活方式差异解释,大城市20余年的上升幅度达到100%~150%[2]。乳腺癌流行病学的一个重要特征就是年龄发病率呈现明显的双峰,绝经期前峰值明显高于绝经期后,这种分布反映了乳腺癌具有较高的异质性。乳腺癌的分子分型改变了乳腺癌流行病学的研究和认识模式,基于分子分型的乳腺癌流行病学中,对传统确认的乳腺癌危险因素,在乳腺癌不同的亚型中的作用具有显著差异。2000年Perou等[3]的研究成果对于乳腺癌分子分型具有划时代意义,通过对基因表达谱的聚类分析将乳腺癌分成Lumina A、Lumina B、HER-2阳性和三阴性。流行病学对乳腺癌的发病危险因素的认识基本清楚,而预后因素却较为模糊,比较公认的预后因素主要受患者的临床病理特征影响,如肿瘤的组织学分级、肿块大小,淋巴结转移情况,而不同分子分型的乳腺癌预后也有显著差异,相关研究表明,Lumina型[4-5]预后最好,其构成占全部乳腺癌的50%左右,但三阴性乳腺癌预后最差,占全部乳腺癌的10%左右,在临床工作中,我们发现绝经前后乳腺癌的病理特征及分子分型方面也有显著的差异,本研究针对此点进行分析,希望为临床个体化治疗和预后判断提供理论依据。
目前研究[6-7]普遍认为绝经前乳腺癌特别是35岁以下乳腺癌分化低,肿瘤直径大,易出现腋窝淋巴结转移,预后差,ER阴性率高及HER-2阳性率高。本研究发现绝经前患者在肿瘤组织学分级Ⅲ级、原发肿瘤直径≥2cm、腋窝淋巴结阳性比例均高于绝经后患者,差异有统计学意义(P<0.05),与国内外多数文献报道一致。
如今通过免疫组化分析得出的分子分型已经广泛应用于临床,指导乳腺癌患者的综合治疗,包括手术方式的制定、化疗方案的选择、是否需要行内分泌治疗及靶向治疗,并对乳腺癌患者的预后进行评估。相关研究[8]报道,不同的分子分型显著影响乳腺癌的预后,其中Lumina亚型与HER-2阳性和三阴性的DFS和OS曲线截然分开,提示前者预后较好。
Lumina型乳腺癌发展相对较慢,内分泌治疗效果好,术后5年内复发率相对较低。本研究中发现绝经后组Lumina 型比例高于绝经前组,差异有统计学意义(P<0.05)。提示绝经后患者较绝经前预后相对较好。三阴性乳腺癌因其特殊的病理特征和较差的预后,成为研究的热点,研究表明[9],三阴性乳腺癌中位肿瘤大小为2cm,约50%伴随淋巴结转移,且组织学分级多为3级,不适合接受针对受体阳性患者的内分泌治疗及针对HER-2阳性患者的靶向治疗,放化疗成为其术后的主要治疗方式,且术后5年内复发率高。近年来随着驱动基因重要性的不断加强,Her-2状态成为分子分型的重要原则,Her-2是乳腺癌明确的预后指标,与乳腺癌的发生发展密切相关,相关研究[10-11]表明:HER-2阳性与乳腺的预后和患者生存率呈负相关。本研究中发现绝经前乳腺癌患者肿瘤组织HER-2阳性同时伴有淋巴结转移比例高于绝经后患者,差异有统计学意义(P<0.05)。提示绝经前患者较绝经后预后相对较差。不同亚型乳腺癌恶性程度差异较大,有针对性的加强绝经前后乳腺癌亚型的研究,可以提高乳腺癌防治的效率,减少过度诊断和治疗的发生,加强个体化的治疗。

