胶原蛋白海绵复合种子细胞对兔尺骨缺损的修复效果
杨森,冯付明
(郑州市第七人民医院 骨科,河南 郑州 450000)
骨缺损骨不愈合临床较常见,也是目前骨科的研究热点。本实验选用体外培养的新西兰大白兔骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)和成骨细胞(osteoblast,OB)作为组织工程骨的种子细胞,胶原蛋白海绵作为种子细胞的支架材料,细胞和载体体外培养1周,移植入新西兰大白兔尺骨中段1.5 cm节段性骨缺损处,观察兔BMSCs和OB体外培养情况,细胞与载体的相容性及体外构建的组织工程骨修复新西兰大白兔尺骨骨缺损的情况,为骨缺损组织工程技术治疗中种子细胞的来源及载体的选择寻求一种新的途径。
1 材料与方法
1.1 实验动物及实验主要试剂、设备
1.1.1 实验动物 出生14日龄乳兔1只;孕28~30 d新西兰兔1只;参照Delgado-ruiz等[1]文献,采用健康6月龄新西兰成年大白兔27只,雌雄各半,清洁级,体质量为2.2~2.8 kg,平均2.5 kg。以上动物均由新乡华兰生物疫苗公司提供,动物合格证号:SCXK(豫)2010-0001。
1.1.2 主要试剂及设备 DMEM-LG 、DMEM-HG (Hyclone 公司,美国),胰酶、青链霉素溶液(genview公司,美国),胎牛血清(FBS Gibico公司 ,美国),β-甘油磷酸钠粉剂、地塞米松(Sigma,美国),茜素红染液(北京索莱宝科技有限公司),抗坏血酸(南京第三制药厂),Percoll分离液(Pharmacia,美国),碱性磷酸酶试剂盒(南京建成生物制品有限公司),医用胶原蛋白海绵(无锡贝迪生物工程有限公司),超净工作台(苏净集团安泰公司),倒置显微镜(Olympus公司,日本),CO2孵箱(Thermo,美国),高速低温离心机(Hitachi,日本日立公司),恒温振荡器(常州国华电器有限公司)。
1.2 种子细胞的提取及传代培养
1.2.1 BMSCs的分离及培养 取14日龄乳兔1只,耳缘静脉注射空气处死,无菌条件下完整切取四肢长骨,移入超净台内,用肝素预湿的20 mL注射器吸取无血清的DMEM-LG 培养基冲洗出骨髓,收集含骨髓的悬液装入无菌离心管,以1 000 r·min-1速度离心5 min,弃上清和脂肪,将剩余悬液沿离心管壁缓慢滴入底部含等体积量的Percoll分离液(密度为1.073 g·mL-1)的离心管中[2],以3 000 r·min-1速度离心30 min。离心后液体分为3层,巴氏吸管吸取中间交界处云雾状的单核细胞层装入离心管,加入少量无血清DMEM-LG培养基漂洗,以1 000 r·min-1速度离心5 min,弃上清,重复漂洗1次。将沉淀加入BMSCs生长培养液[含DMEM-LG培养基、体积分数为10%的胎牛血清(fetal bovine serum,FBS)、100 U·mL-1青霉素、100 mg·L-1链霉素],制成单细胞悬液后进行细胞计数,调整细胞密度至1×106mL-1,接种于25 cm2培养瓶,置于37 ℃含体积分数为5% CO2的恒温恒湿培养箱。48 h首次半量换液,72 h全量换液,以后每3 d换液1次。待BMSCs长满瓶底90%时,按1∶2比例传代培养,细胞传至第3代时备用。倒置相差显微镜观察细胞形态学变化。
1.2.2 改良酶消化法提取兔OB 100 g·L-1水合氯醛腹腔麻醉孕兔,无菌条件下剖腹取产前1周的胎兔,超净台内取出胎兔颅盖骨,放入含青霉素、链霉素的0.01 mol·L-1PBS液的培养皿内清除骨膜、血管及结缔组织[3],无菌PBS液冲洗颅盖骨1次。然后将颅盖骨剪成1 mm3的骨片,加入盛有5 mL质量浓度为2.5 g·L-1胰酶的离心管中,37 ℃水浴15 min,弃上清液。将骨片移入含等量1 g·L-1Ⅰ型胶原酶和2.5 g·L-1胰酶各5 mL的离心管,37 ℃恒温振荡20 min,200目滤网过滤,保留滤网上骨残渣,将含有细胞的滤过液加入胎牛血清终止消化,然后放入冰块中冰浴。将骨残渣按上述方法重复操作1次,留取滤过液和含细胞的第1次滤过液混合,然后将含细胞的滤过液用低温离心机以1 000 r·min-1速度离心5 min,弃上清液。沉淀加入OB培养液(含DMEM-HG培养基、体积分数为10%的FBS、50 mg·L-1的L-抗坏血酸、10 mmol·L-1的β-甘油磷酸钠、100 U·mL-1的青霉素、100 mg·L-1的链霉素),吹打混匀并调整细胞密度,按1×106个·mL-1接种于25 cm2培养瓶。放置于37 ℃含体积分数为5% CO2的恒温恒湿培养箱。48 h后首次全量换液,以后每3 d换液1次,传代方法同BMSCs。
1.3 种子细胞的鉴定方法
1.3.1 倒置相差显微镜观察 原代培养传代前照相,对第1代细胞采用尹红-苏木素染色,镜下观察种子细胞的形态和生长状况。
1.3.2 Ⅰ型胶原蛋白和Ⅲ型胶原蛋白免疫组化染色 分别取第3代兔BMSCs和第3代兔OB于预置有盖玻片的6孔板内进行培养,1周后用0.1 mol·L-1的PBS缓冲液轻洗3遍,按照Ⅰ型胶原蛋白和Ⅲ型胶原蛋白免疫组织化学染色方法及试剂盒说明,进行免疫组化染色。
1.3.3 钙结节茜素红染色 细胞接种方法同上,弃培养基,培养板用PBS冲洗2次,400 g·L-1的多聚甲醛固定30 min,蒸馏水冲洗3次,1 g·L-1茜素红[茜素红-Tris-Hcl(pH 8.3)]染色,37 ℃染色30 min,蒸馏水冲洗。倒置显微镜下观察矿化结节。
1.4 细胞-胶原蛋白海绵支架复合物的制备及检测
1.4.1 细胞-支架复合物制备 收集第3代OB和BMSCs,用含体积分数为10%的FBS的DMEM-LG培养液制成浓度为1×106个·mL-1的细胞悬液。制备3种细胞-支架复合物,分别为OB-支架复合物(A组)、BMSCs -支架复合物(B组)及混合细胞-支架复合物(C组,OB和BMSCs比例为1∶1)。按照细胞悬液反复滴加的方法,分别将0.1 mL OB、BMSCs、混合细胞悬液均匀分布于胶原蛋白海绵支架上。将细胞-支架复合物置于37 ℃含体积分数为5% CO2的培养箱中孵育3 h,待细胞黏附于支架表面后,加入含体积分数为10%的FBS相应细胞培养液,混合细胞加入OB培养液,每2 d换液1次,培养1周备用。
1.4.2 MTT测定支架内细胞增殖活性 将无菌胶原蛋白海绵裁制成5 mm×5 mm×5 mm大小[4],分别置于96孔板中,调整OB、BMSCs及混合细胞密度为1×106个·mL-1,将0.1 mL细胞悬液缓慢滴加于支架的表面,37 ℃含体积分数为5% CO2培养箱中培养,分别于第1、2、4、6、8天对3组细胞采用MTT法检测490 nm处吸光度(A)值,每组设3个复孔,并设空白对照组,绘制3组细胞生长曲线。
1.5 动物分组与造模 取健康6月龄体质量2.5 kg左右新西兰大白兔27只,做双侧尺骨中段1.5 cm节段性骨缺损模型,按植入的修复物随机分成3组,每组9只。A组为OB+胶原蛋白海绵;B组为BMSCs+胶原蛋白海绵;C组为混合细胞+胶原蛋白海绵;D组为胶原蛋白海绵,作为自身对照。为了方便观察,右侧作为不同分组侧,左侧作为自身对照侧。造模方法[5-7]:100 g·L-1水合氯醛麻醉动物满意后,取仰卧位前臂尺侧中段切开皮肤,分离皮下组织至骨膜,用骨科微型电钻将尺骨鹰嘴下2.5~3.0 cm处一段尺骨连同骨膜一并截除,制成长1.5 cm节段性缺损,然后植入相应组织工程骨,术后均予青霉素(40万U)肌内注射预防感染,分笼饲养。各组分别于术后4、8和12周每个时间点处死3只动物做相关检查。
1.6 标本检测及方法
1.6.1 骨标本大体观察及术后12周兔尺骨缺损愈合后几何参数测量 各组动物在术后4、8、12周3个时间点分别处死3只,肉眼观察骨缺损修复情况,测量术后12周兔尺骨缺损区愈合后几何参数变化。
1.6.2 骨缺损区HE组织染色 分别截取包括两端各5 mm正常骨质的标本,100 g·L-1中性甲醛固定,脱钙,脱水,石蜡包埋,纵行切片,分别行苏木素-伊红(HE)染色,显微镜下观察成骨情况。
1.6.3 X线检查 于术后当天及各时间点摄双侧尺桡骨正位片,曝光条件为40 kV、50 mA、0.2 s,投照距离为75 cm,观察骨痂生长和骨连接情况。以Lane—Sandhu X 射线评分标准评估骨形成及塑形评分,总分12分,以第4周、第8周、第12周各时间点取各组X线得分,取各时间参考点X线平均值作为结果进行统计学分析,骨愈合的Lane—Sandhu X线评分标准见表1。
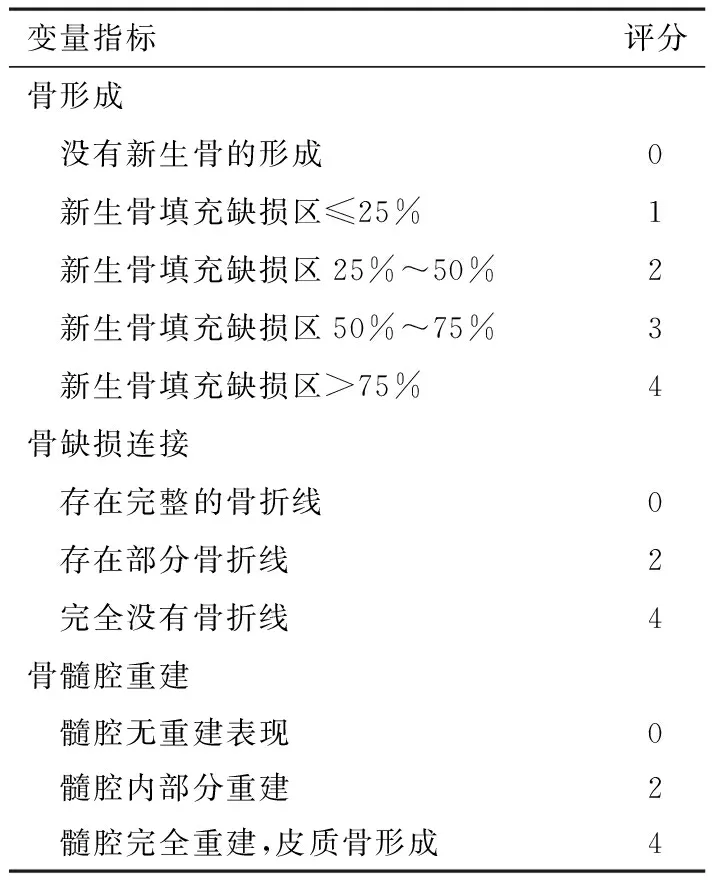
表1 骨愈合的Lane—Sandhu X线评分标准
2 结果
2.1 种子细胞的鉴定
2.1.1 原代培养细胞 见图1。
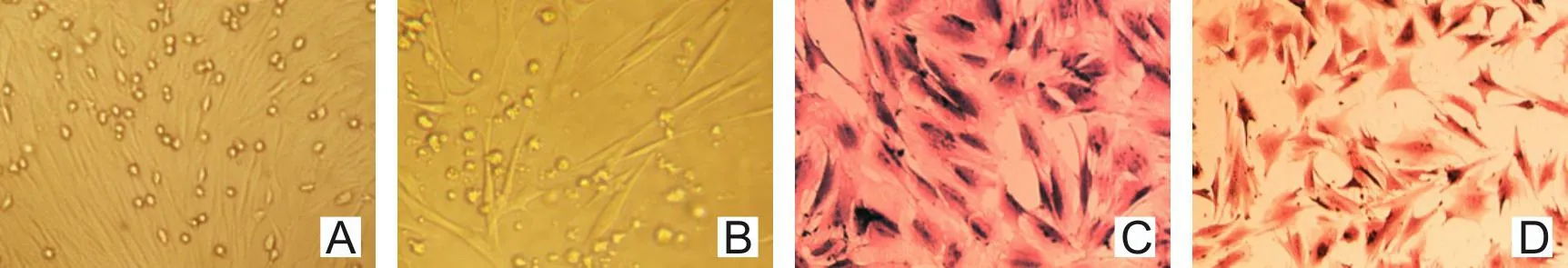
A—BMSCs原代第5天;B—兔OB原代第10天;C—BMSCs HE染色;D—兔OB HE染色。图1 骨髓间充质干细胞(BMSCs)和成骨细胞(OB)原代培养细胞(×100)
2.1.2 Ⅰ型胶原酶原和Ⅲ型胶原酶原免疫组化染色 见图2。

A—BMSCs Ⅰ型胶原蛋白染色;B—BMSCs Ⅲ型胶原蛋白染色;C—兔OB Ⅰ型胶原蛋白染色;D—兔OB Ⅲ型胶原蛋白染色。图2 骨髓间充质干细胞(BMSCs)和成骨细胞(OB)Ⅰ型胶原酶原和Ⅲ型胶原蛋白免疫组化染色结果(×100)
2.1.3 茜素红染色 见图3。

A—兔OB;B—BMSCs。
图3 骨髓间充质干细胞(BMSCs)和成骨细胞(OB)茜素红染色结果(×100)
2.2 种子细胞与胶原蛋白海绵的相容性
2.2.1 种子细胞在胶原蛋白海绵表面黏附 见图4。
2.2.2 种子细胞在胶原蛋白海绵支架上的增殖(MTT法) 生长曲线绘制:以培养天数为横轴,实验孔减去空白孔的吸光度值为纵轴,绘制1条连续的曲线。BMSCs、OB、混合细胞3组的细胞数量均随着培养时间的延长而增加,在培养的第8天达到峰值, 通过对第3代3组细胞的计数,绘制出的生长曲线呈S形。见图5。接种的第0~2天为细胞适应期,细胞增殖不明显;第3~6天为细胞的对数增长期,细胞在短时间内大量增殖;第7天为平台期,细胞增殖逐渐变缓。

A—BMSCs;B—兔OB;C—混合细胞。图4 种子细胞接种至胶原蛋白海绵第3天结果(×100)

图5 种子细胞在胶原蛋白海绵支架上的增殖情况
2.3 标本测量结果
2.3.1 标本大体观察和HE染色结果 见表2。
2.3.2 术后12周骨缺损区几何参数测量结果 4组矢状径、冠状径、骨痂厚度、骨密度比较,差异有统计学意义(均P<0.05)。进一步两两比较,混合细胞组矢状径、冠状径、骨痂厚度、骨密度与A组、B组、D组比较,差异有统计学意义(均P<0.05)。见表3。

表2 标本大体观察和HE染色结果
2.3.4 各组骨缺损修复X线 4周时,A、B、C 3个实验组骨缺损处材料密度增高呈云雾状,均匀分布在骨缺损区;D组仅在缺损两端有少量的云雾状骨痂生成,缺损区中央部分无骨生成影像。8周时,A、B、C 3个实验组材料与宿主骨交界处模糊,形成大小不一的骨痂;D组仍仅在缺损两端有骨痂生成,缺损区中央部分无明显骨生成影像。12周时,A、B、C 3个实验组材料边缘部分区域密度接近宿主骨,各组形成骨痂大小及密度有差异,C组出现髓腔再通,A组和B组出现部分髓腔再通,骨缺损区域密度大部分接近宿主骨;D组骨缺损处骨不愈合,但骨缺损两端有少许高密度影。见图7。4组在4、8和12周的评分值比较,差异有统计学意义(均P<0.05)。进一步两两比较,混合细胞组4、8和12周的评分值与A组、B组、D组比较,差异有统计学意义(均P<0.05)。见表4。

表3 兔尺骨缺损愈合后几何参数的变化
注:与混合细胞组比较,aP<0.05。
2.3.3 各组骨缺损区HE组织学染色 见图6。
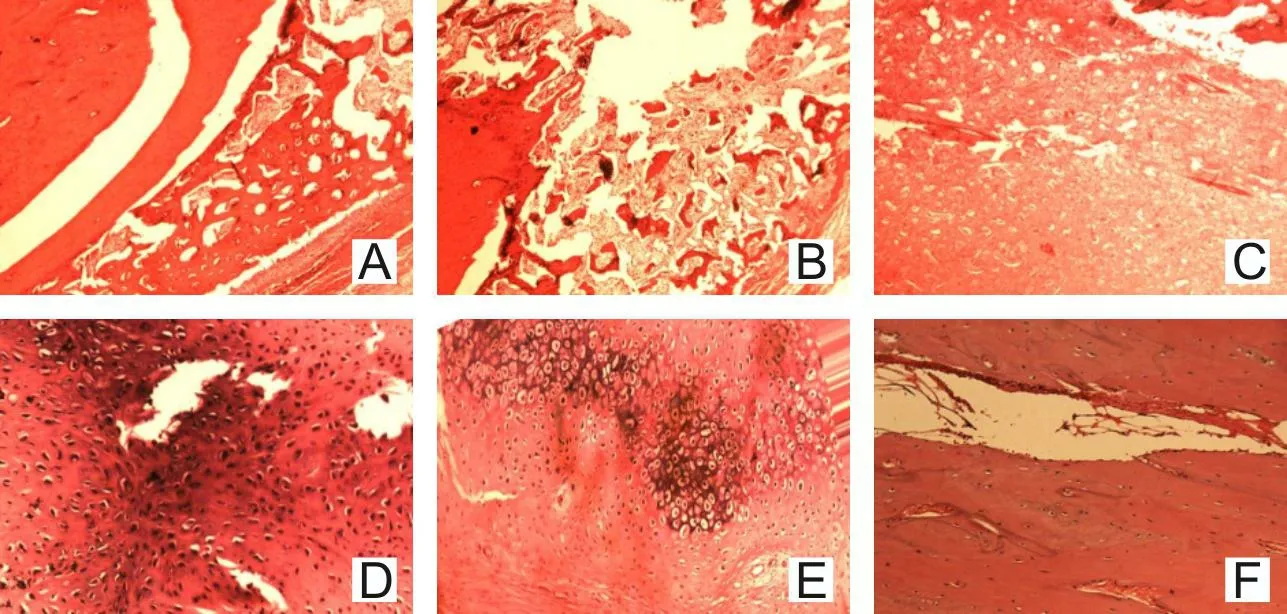
A—OB组第12周,新生骨内髓腔出现,逐渐向板成骨改建,但尚不完全;B—BMSCs组第12周,新生骨内髓腔出现,板成骨出现,改建不完全;C—对照组第12周,缺损区被纤维结缔组织充填;D—混合细胞组第4周,骨缺损区出现岛状生长的软骨和骨组织;E—混合细胞组第8周,新生软骨和骨组织增多,出现板成骨;F—混合细胞组第12周缺损区修复,形成正常组织骨,骨髓腔再通。图6 各组骨缺损区HE组织学染色结果(×40)

图7 各组术后4、8、12周骨缺损修复X线结果
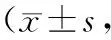
表4 4组不同时间点Lane-Sandhu法X线得分值比较分)
注:与混合细胞组同时间点比较,aP<0.05。
3 讨论
本实验通过分子生物学、标本观察、X线及组织学检测对BMSCs和OB体外培养的特点与构建组织工程骨体内移植后的成骨性能和成骨特点进行了评估和研究。实验结果显示BMSCs和OB两种种子细胞混合后成骨性能强于单独的任何一种细胞组,究其原因可能由于BMSCs 的分化具有位点特异性,OB可以诱导BMSCs向OB分化[8],从而加速了骨缺损的修复进程。
3.1 种子细胞的制备 目前骨组织工程应用最广泛的种子细胞是BMSCs,其次是OB。有关BMSCs的研究,最早可追溯到1966年Friedenstein等[9]首先发现并证实了在骨髓中除了包含造血干细胞外,还存在着一类可以向骨组织、软骨组织、脂肪细胞、神经细胞等分化的细胞,称之为骨髓间充质干细胞。近年来,单独应用BMSCs或者BMSCs复合各种材料用于移植修复体内损坏或者失能的器官或组织已经取得了巨大成功。由于BMSCs具有多向分化潜能,而且来源广泛,取材方便,分离培养、扩增以及导入外源基因等技术比较成熟,诱导分化后成骨能力明确,遗传背景稳定,且无免疫排斥反应[10]。临床应用的前景非常广阔,是骨组织工程较为理想的种子细胞。OB的来源也比较广泛,国内外学者已从胚胎或新生动物颅盖骨、骨膜、皮质骨和松质骨、骨髓等组织中提取出OB[11-12]。但骨膜和其他骨小梁来源的OB存在取材不方便、有创伤等缺点,加上增殖能力不如骨髓来源的OB,从而限制了它们在骨组织工程中的应用。对于BMSCs和OB的原代培养,各种文献的操作方法不一。本研究参考Stanko等[13]的操作方法,采用1.073 g·mL-1的Percoll分离液,经过3次以上传代获得了性能稳定、单一纯化的BMSCs。OB的提取参考袁月等[14]的方法并做出了改进,短时间内建立了稳定的成骨细胞系。
3.2 胶原蛋白海绵支架材料的研究 胶原蛋白作为骨组织工程支架材料具有许多优点[15]。胶原是天然骨组织中有机质的主要成分,可为种子细胞的附着提供支架;其次,它还具有无毒、低抗原性、良好的生物相容性、可降解性和可吸收性,可以通过介导各种理化刺激来调节细胞的分化,对种子细胞的早期黏附、随后的分化增殖以及发挥成骨功能都具有促进作用[16]。但是此种支架材料生物强度较低,力学性能较差,单独移植用于骨缺损治疗效果较差。目前的研究热点是将胶原与BMP、HA、种子细胞或者自体骨髓等材料复合构建组织工程骨,不断提高修复材料的机械性能和成骨性能。本研究中种子细胞BMSCs和OB接种至胶原蛋白海绵支架上,体外培养1周,细胞在支架上完全伸展并大量增殖[4],形成具有一定强度的组织工程骨后用于移植,避免了种子细胞流失,同时也增加了胶原海绵组织工程的机械强度。
3.3 动物模型的制作 研究骨缺损的动物模型必须标准可靠并且尽可能模拟临床情况。Tägil等[17]指出骨干连同骨膜的完全缺损,长度超过直径的三四倍,机体就无法自行愈合,具有一般性的指导作用。参考国内外研究骨缺损模型的造模方法[5-7],本研究采用尺骨中段1.5 cm节段性骨缺损模型。由于尺骨位置表浅,肌肉覆盖较少,实验中采用双上肢尺侧弧形切口,避免因伤口不愈合影响骨组织的修复。由于兔的前肢有尺桡骨组成,对于截骨区的选择,参考顾祖超等[18]对兔尺骨解剖数据的测量结果,选取桡骨弧形顶点对应尺骨处截骨,截骨时用尖刀环形切开骨膜,使用骨科微型电钻在上截骨点下缘和上截骨点下缘钻孔线锯截骨(这样可以避免截骨过长),然后用骨锉磨钝骨折端,这样截骨区远离上下关节面,即使尺骨有较大缺损,桡骨也能起到内固定的作用,而且尺骨的直径足够大,结构和功能类似人类,因而可以基本模拟临床情况。
3.4 胶原蛋白海绵组织工程化骨组织修复病理过程 Sellers等[19]将胶原海绵作为骨形态蛋白载体用于软骨缺损的治疗,Wakitani等[20]用嵌入软骨细胞的胶原蛋白凝胶来修复软骨缺陷。本研究使用胶原蛋白海绵复合种子细胞修复皮质骨缺损,通过形态学观察发现两种种子细胞可以在胶原海绵周围生长,逐渐黏附,并在其表面形成细胞集落或团簇,随着培养时间的延长,细胞长入孔隙内,分泌细胞外基质,细胞连接成片,胶原海绵复合体逐渐转化为软骨组织。研究结果显示,胶原蛋白海绵骨植入体内后的骨折愈合过程以软骨内化骨为主。骨折愈合是一个复杂的连续进行的过程,是OB与破骨细胞等多因素相互作用的结果,缺损区软骨细胞逐渐增生、钙化而骨化,在破骨细胞作用下,骨化后的骨小梁表面开始形成小腔隙,之后小腔隙逐渐相互贯通形成较大腔隙,并有血管生成,当大腔隙连接成片并与自体骨髓腔重新沟通后,即完成了骨折愈合过程。

