WNK1在结直肠癌中的表达情况及对预后的影响
刘利佳,吴欣爱,董文杰,李慧霞
(郑州大学第一附属医院 肿瘤科,河南 郑州 450052)
结直肠癌(colorectal cancer,CRC)是最常见的消化系统恶性肿瘤,和肺癌、乳腺癌一同被列为当前全球的三大恶性肿瘤。2018年全球新发CRC病例共1 800 977例,占恶性肿瘤发病总数的10.2%,发病率在总人群中仅次于肺癌和乳腺癌,位列第3。死亡861 663例,占恶性肿瘤死亡总数的9.2%,死亡率在总人群中仅次于肺癌,位列第2[1]。近年来我国CRC发病率和死亡率呈上升趋势[2]。癌胚抗原和糖类抗原是当前CRC临床诊断中常用的肿瘤标志物,但这些标志物的敏感性和特异性不理想,因此急需寻找新的肿瘤标志物以及评估患者预后较灵敏的指标。WNK1[不含赖氨酸(K)1]是WNK激酶家族的成员之一,是一种位于集合管远端肾单位的丝氨酸/苏氨酸蛋白激酶[3]。WNK1在肿瘤细胞增殖、代谢适应、凋亡逃避、浸润转移中起重要作用[4]。Wnt/β-连环蛋白信号传导是发育的核心,HEK293T细胞中下调WNK1和WNK2,显著降低了Wnt信号基因的表达,表明敲除WNK1、WNK2基因降低了HEK293T细胞的活性[5]。Vegf/Vegfr信号通路通过Akt激酶介导的磷酸化和WNK1的激活以及斑马鱼中WNK1的表达调控血管生成,提高了WNK1促进癌组织中血管生成的可能性[6]。ZHANG等[7]研究发现,WNK1作为细胞质第二信使参与Cl-通道诱导的信号级联反应,促进血管增生。根据以上研究推测,WNK1的表达与肿瘤的侵袭性行为相关。据报道,WNK1基因的拷贝数在CRC中是异常的[8]。然而WNK1在CRC中的表达情况以及其对CRC患者的影响尚无报道。本研究探讨WNK1在CRC中的表达情况及其对结直肠癌预后的影响。
1 资料与方法
1.1 患者组织芯片研究样本为上海生物科技有限公司组织标本库提供的68例CRC组织。患者手术时间为2006年7月至2007年5月,最后1次随访时间为2014年8月。根据TNM对肿瘤进行临床病理分期。其中男41例,女27例,中位年龄55岁。每个研究标本均提供癌组织及癌旁组织,癌旁组织距癌1.5 cm。
1.2 免疫化学染色组织样本按标准程序处理为福尔马林固定石蜡包埋组织。两名专业的病理学家对免疫组化结果进行复检。根据阳性程度将标本分为3个等级:1级(0%~25%阳性),2级(26%~50%阳性)和3级(51%~100%阳性)。统计分析中1、2级为阴性,3级为阳性。癌组织中WNK1表达阳性38例,阴性30例,癌旁组织中WNK1表达阳性10例,阴性58例。
1.3 细胞系、化学物质和抗体本实验室在体积分数为10%DMEM液的胎牛血清中保存了两株CRC细胞株(HCT116和HCT15)。胎牛血清和DMEM细胞培养基均购自美国Gibco公司。Lipofectamine 2000转染试剂购自美国Invitrogen公司。针对WNK1的抗体购自Abclonal公司。粘连蛋白、波形蛋白和肌动蛋白抗体均购自Cell Signaling Technology公司。通过小干扰RNA(siRNA)诱导WNK1基因抑制。WNK1 siRNAs的序列为:上游引物5’-CAAUGSGUCAGAUAUACGAAtt-3’;下游引物5’-UUCGAUAUCUGACUCAUUGtc-3’;转染前24 h将体积分数为10%DMEM液的胎牛血清中的HCT116和HCT15细胞接种于6孔板中(每2 mL每孔105个细胞)。Lipofectamine 2000 /siRNA的准备是在500 μL不含血清的optiMEM中加入siRNA和5 μL Lipofectamine 2000。转染后的细胞在37 ℃温度下孵育48 h后进行实验。稳定转染的克隆体通过蛋白免疫印迹法检测得到验证。
1.4 蛋白免疫印迹收集细胞样本,将样品(20 μg)的细胞裂解物在体积分数为10%的SDS-PAGE中进行凝胶电泳,然后将分离的蛋白质转移到硝酸纤维素膜上。用50 g·L-1的脱脂奶粉和体积分数为0.1%的Tween20在三倍缓冲盐水中封闭膜,并用抗体探测,之后使用增强化学发光法显影。
1.5 Transwell实验将细胞浓度为1×105个·mL-1、体积分数为0.1%胎牛血清的DMEM接种在室板(BD Biosciences)中的Transwell过滤器(8 μm孔径)的每个小室上部培养嵌室内。在底部培养室每室加入1.5 mL体积分数为20%胎牛血清的DMEM。在37 ℃、体积分数为5%的CO2培养箱中培养48 h,用棉棒轻轻擦去嵌室底部内表面的细胞。用多聚甲醇固定并用Giemsa染色。显微镜下随机选取5个视野, 统计小室细胞的迁移数, 取平均值进行统计分析。
1.6 细胞划痕实验以每孔5×105个细胞将对数期siWNK1细胞及转染空载体对照组细胞接种于6孔板内,培养24 h。用1 mL枪头在孔内沿直径方向画粗细均匀的1条竖线,用PBS洗细胞2次,去除脱落细胞,并将其放入培养箱中,0 h和48 h时在倒置显微镜下观察细胞划痕的状态并拍照。计算划痕的相对愈合率。公式为:划痕的相对愈合率=(0 h的划痕宽度-48 h的划痕宽度)/ 0 h的划痕宽度×100%。
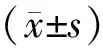
2 结果
2.1 WNK1在CRC及癌旁组织中的表达情况CRC组织WNK1的表达阳性率[(55.9%(38/68)]高于癌旁组织[14.7%(10/68)],差异有统计学意义(P<0.05)。WNK1的表达与淋巴结转移和TNM分期相关(均P<0.05);WNK1表达与年龄、性别、肿瘤直径和肿瘤浸润深度无关(均P>0.05)。见表1。

表1 WNK1表达和CRC临床病理特征的关系(n)
2.2 WNK1表达与CRC患者OS和PFS的关系WNK1高表达CRC患者OS率和PFS率均低于WNK1低表达患者(均P<0.05)。见图1、2。
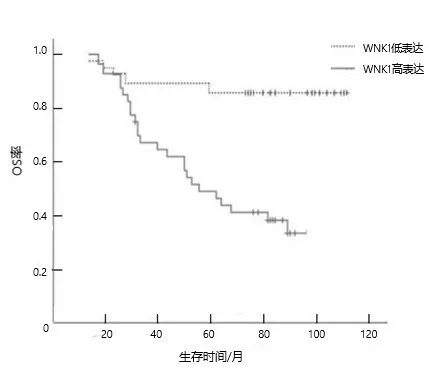
图1 WNK1表达对CRC患者OS的影响
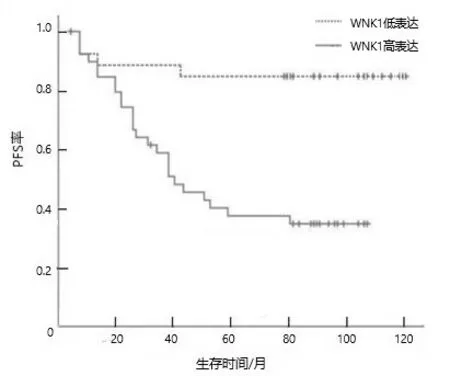
图2 WNK1表达对CRC患者PFS的影响
2.3WNK1基因对上皮细胞-间充质转换(epithelial-mesenchymal transition,EMT)的影响经蛋白免疫印迹法证实,WNK1在HCT116和HCT15细胞系中的表达均下调,HCT116细胞中灰度降低72%,HCT15细胞中灰度降低85%。见图3。在HCT116和HCT15细胞中,WNK1的下调可恢复上皮标志物钙黏附蛋白E的表达,并伴随间质标记物波形蛋白的丢失。见图4。
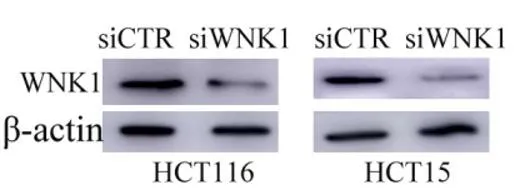
图3 蛋白免疫印迹法检测确认HCT116和HCT15中瞬时siRNA转染敲低WNK1
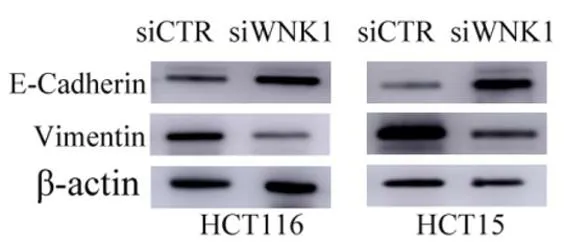
图4 蛋白免疫印迹法检测WNK1下调对钙黏附蛋白E及波形蛋白的影响
2.4WNK1基因对CRC细胞迁移能力的影响Transwell结果显示,采用siRNA抑制WNK1基因后HCT116细胞中通过滤膜迁移至下室的细胞(57.00±4.36)少于转染空载体对照组(230.00±8.89),差异有统计学意义(P<0.05);HCT15细胞中通过滤膜迁移至下室的细胞(61.00±3.61)少于转染空载体对照组(241.00±5.52),差异有统计学意义(P<0.05)。见图5。划痕实验结果显示,在HCT116中下调WNK1基因后细胞48 h划痕愈合率(10.7%)低于转染空载体对照组(60.3%),差异有统计学意义(P<0.05);在HCT15中下调WNK1基因后细胞48 h划痕愈合率(7.8%)低于转染空载体对照组(45.8%),差异有统计学意义(P<0.05)。见图6。

图5 Transwell实验检测下调WNK1对HCT116和HCT15细胞迁移能力的影响
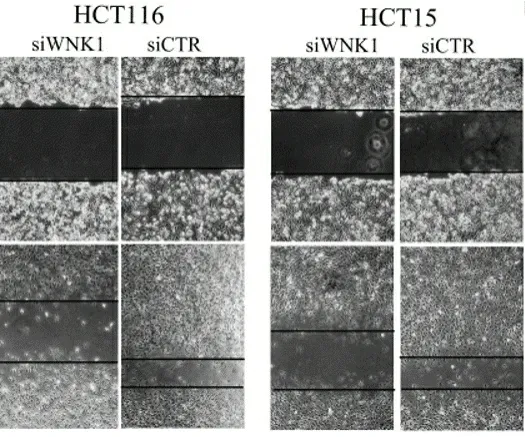
图6 细胞划痕实验检测WNK1对HCT116和HCT15细胞迁移能力的影响
3 讨论
CRC由于早期症状缺乏或不典型,就诊时往往已为进展期肿瘤,且CRC患者生存率与其分期密切相关,Ⅰ期与Ⅳ期患者5年生存率分别为93%和8%[9]。寻找方便灵敏的指标或方法来筛选肿瘤及评估预后是提高CRC患者生存期的有效方法。
丝氨酸/苏氨酸蛋白激酶是一种保持血压稳态的重要蛋白激酶,在肿瘤发生发展中发挥重要作用。有研究发现,WNK1激活OSR1信号级联是调控小鼠胚胎发育过程中血管生成和心脏形成的重要途径[10],而新生血管形成在肿瘤性疾病的发生发展中起重要作用。肺癌组织中抑制WNK1可逆转EMT和癌细胞迁移[11]。研究发现,非小细胞肺癌中一种新的WNK1-ROS1融合,对克唑替尼敏感,WNK1-ROS1重排似乎是非小细胞肺癌的一个新的驱动因素[12]。有证据表明PDK1/WNK1信号通路与乙肝相关性肝癌有关,p-PDK1和p-WNK1在乙肝相关性肝癌细胞中上调[13]。Kim等[14]最新研究表明,WNK1通过激活TRPC6促进肾透明细胞癌增殖和迁移,通过激活TRPC6-NFAT通路促进肾肿瘤进展,WNK1是肾透明细胞癌潜在诊断标准物。Costa等[15]在甲状腺乳头状癌中发现嵌合转录产物WNK1-B4GALNT3,并与B4GALNT3过表达相关。研究发现,复发性卵巢癌细胞中WNK1蛋白水平高于匹配的原发肿瘤细胞[16]。据报道,WNK1-OSR1激酶介导的NKCC磷酸化激活促进胶质瘤迁移[17-18]。WNK1的下调降低了前列腺和神经干细胞的细胞迁移和侵袭能力[19-20]。此外,Desjardins等[21]通过动物实验发现,WNK1-SPAK/OSR1信号通路通过调节NKCC1和KCC2参与了大鼠骨肿瘤疼痛的形成,WNK1-SPAK/OSR1信号可能是骨肿瘤疼痛治疗的潜在靶点。
本研究发现,CRC组织中WNK1的表达阳性率高于癌旁组织。此外,WNK1的表达与淋巴结转移和TNM分期相关。WNK1高表达CRC患者OS率和PFS率均低于WNK1低表达患者,提示WNK1可能参与了CRC的复发。为进一步证明WNK1在CRC中的作用,采用蛋白免疫印迹法对细胞的上皮和间质标志物进行分析,发现在体外抑制WNK1基因可抑制EMT。Transwell分析与划痕实验证实了在体外抑制WNK1基因可抑制CRC细胞的迁移能力。
WNK1在CRC中的表达显著高于正常结直肠组织,且WNK1高表达与CRC TNM分期及复发转移相关。抑制WNK1基因可抑制EMT和CRC细胞的迁移能力。因此,WNK1基因的表达水平可能成为评估CRC预后的重要指标和潜在的治疗靶点,但具体调控机制有待进一步研究。

