急性低氧胁迫对翘嘴鳜抗氧化酶、呼吸相关酶活性及相关基因表达的影响
徐畅 丁炜东 曹哲明 邴旭文 张晨光 谷心池 刘雨

摘要:【目的】从酶活性和基因表达水平分析低氧胁迫对翘嘴鳜(Siniperca chuatsi)应激的生理响应过程,为其健康养殖及耐低氧品种选育提供科学依据。【方法】选取体表无损伤、体重450±20 g/尾、体长24.0±0.7 cm的健康翘嘴鳜进行低氧(溶解氧含量2.8±0.2 mg/L)胁迫,设常氧(溶解氧含量6.5±0.2 mg/L)为对照组,分别在低氧胁迫0、6、12、24、48和96 h时采集翘嘴鳜的肝脏和鳃组织样品,进行抗氧化酶、呼吸相关酶活性及低氧诱导反应相关基因表达测定。【结果】在整个急性低氧胁迫过程中,翘嘴鳜肝脏过氧化氢酶(CAT)活性、还原型谷胱甘肽(GSH)含量及谷丙转氨酶(GPT)活性均呈先升高后降低的变化趋势,GSH含量从低氧胁迫6 h起显著高于对照组(P<0.05,下同),CAT和GPT活性从低氧胁迫12 h起显著高于对照组。鳃组织乳酸脱氢酶(LDH)活性先升高后降低再升高,在胁迫6 h时达最高值(849.67 U/mg),显著高于对照组;超微量总ATP酶(ATPase)活性呈降低—升高—降低的变化趋势,且显著低于对照组。低氧胁迫组翘嘴鳜肝脏HIF-1α基因的相对表达量在胁迫48 h后显著上调;EPO基因的相对表达量先升高后降低,在胁迫12 h时显著上调;HSP90α基因的相对表达量在胁迫6和48 h分别出现峰值,其他时间点与对照组持平。【结论】急性低氧胁迫对翘嘴鳜肝脏抗氧化酶、鳃组织呼吸相关酶及低氧诱导反应相关基因表达均产生显著影响。虽然翘嘴鳜能通过自我调节抗氧化酶和呼吸相关酶活性及上调低氧诱导反应相关基因表达,促使机体适应低氧环境,但溶解氧降至2.8 mg/L以下即对其产生不利影响,因此在实际养殖过程中须密切关注养殖水体溶解氧变化。
关键词: 翘嘴鳜;低氧胁迫;抗氧化酶;呼吸相关酶;低氧诱导反应相关基因
0 引言
【研究意义】溶解氧(Dissolved oxygen,DO)是影响鱼类生存和生长的重要环境因子。在水产养殖过程中,影响水体溶解氧的因素很多,包括天气、水流和水温等(Wu et al.,2020)。大多数鱼类具有适应溶解氧波动的能力,但溶解氧长期处于较低水平,则会对鱼类造成不可逆损伤,甚至导致死亡(Abdel-Tawwab et al.,2019),给水产养殖业带来严重损失。因此,探究低氧胁迫下鱼类生理生化指标及相关基因的表达变化规律,明确鱼类对低氧的效应及耐受限度,对科学指导鱼类高密度养殖具有重要意义。【前人研究进展】随着养殖水体中溶解氧水平的降低,鱼类的呼吸和摄食活动会随之降低,其生理和代谢活动也受到不利影响(Wedemeyer,1996)。鱼类响应低氧胁迫是一个复杂的生理过程,是多种因素相互作用的结果(熊向英等,2016),通常需要在基因水平、信号通路及低氧信号途径网络调控等不同层面进行深入探讨。Pichavant等(2002)研究表明,在严重低氧条件下鱼类的有氧呼吸速率受到影响,腺苷三磷酸(ATP)产生减慢,导致肌肉组织中乳酸含量发生变化;Rinaldi等(2005)研究发现,在轻度低氧条件下欧洲鲈(Dicentrarchus labrax)的鳃组织结构会受到影响;Omlin和Weber(2010)在研究虹鳟(Oncorhynchus mykiss)时发现,由低氧引起的乳酸增加在降低循环中乳酸负荷具有战略性作用;狄治朝等(2018)研究表明,斑马鱼(Danio rerio)在低氧胁迫下Hsp90ab1基因相对表达量呈上调趋势;Sun等(2020)研究表明,大嘴鲈(Micropterus salmoides)受低氧胁迫时其肝脏的过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)活性明显升高;张凯强等(2020)研究发现,HIF-1α基因在花鲈的低氧应答中发挥重要作用。此外,在团头鲂(Megalobrama amblycephala)(王慧娟,2015)、卵形鲳鲹(Trachinotus ovatus)(陈世喜等,2016)、河川沙塘鳢(Odontobutis potamophila)(贾秀琪等,2017)、花鲈(常志成等,2018)、黄颡鱼(Pelteobagrus fulvidraco)(孙俊霄等,2019)的相关研究中均发现低氧胁迫能诱导抗氧化酶呈规律性变化。【本研究切入点】翘嘴鳜(Siniperca chuatsi)是人工养殖鳜鱼的主要品种,但其耐低氧能力较弱,尤其随着养殖规模化和集约化的发展,养殖水体中的溶解氧水平已成为翘嘴鳜养殖不可忽视的重要环境因素之一。至今,有关鳜鱼耐氧能力的研究主要集中在窒息点和耗氧率探析(杨春等,2003)及利用池塘微孔增氧进行生态高效养殖(蔡建中等,2011;刘林,2011;章爱华,2017)等方面,而针对翘嘴鳜的耐低氧机制研究尚无报道。【拟解决的关键问题】探究急性低氧胁迫下翘嘴鳜抗氧化酶、呼吸相关酶活性及低氧誘导反应相关基因表达的变化规律,从酶活性和基因表达水平分析低氧胁迫对翘嘴鳜应激的生理响应过程,为其健康养殖及耐低氧品种选育提供科学依据。
1 材料与方法
1. 1 试验用鱼
供试翘嘴鳜取自南京农业大学无锡渔业学院南泉养殖基地,选取体表无损伤、体重450±20 g/尾、体长24.0±0.7 cm的健康成鱼,暂养于室内控温循环水养殖系统(450 L)内。暂养期间以鲮鱼(体长4.0±1.0 cm)为饵料,每2 d投饵1次,投喂量为翘嘴鳜体重的2倍;同时保持水体溶解氧含量6.5±0.2 mg/L、pH 7.55±0.20,水温(22.0±0.5)℃。暂养14 d后进行低氧胁迫试验。
1. 2 试验设计及样品采集
根据司亚东等(1995)、熊向英等(2016)的相关研究可知,鱼类的饱和溶解氧浓度为7.0 mg/L,缺氧临界值为4.0 mg/L,鳜鱼成鱼的溶解氧窒息点在l.0 mg/L左右。考虑到实际生产过程中,低于鱼类缺氧临界值可能会给翘嘴鳜养殖带来影响,故设常氧对照组(溶解氧含量6.5±0.2 mg/L)和低氧试验组(溶解氧含量2.8±0.2 mg/L),每组设3个平行,即6个450 L的养殖桶,桶内水体积约320 L。通过调节充入水中的氮气和空气速率改变其溶解氧含量,利用HACH-LDO溶氧仪检测溶解氧变化情况,使溶解氧含量维持在预设值上。待对照组和试验组的水体溶解氧降至预设值并保持稳定时,将180尾翘嘴鳜随机平均放养到6个养殖桶内(每桶30尾)。试验期间每2 h用HACH-LDO溶氧仪检测并调整水体溶解氧含量,保持水体静止,停止进食,水温(22.0±0.5)℃,pH 7.55±0.20。分别在低氧胁迫0、6、12、24、48和96 h时,每桶随机选取3尾翘嘴鳜,以100 mg/L MS-222麻醉后解剖采集肝脏和鳃组织样本,经液氮速冻后置于-80 ℃冰箱保存备用。
1. 3 酶活性检测
过氧化氢酶(CAT)、还原型谷胱甘肽(GSH)、谷丙转氨酶(GPT)、乳酸脱氢酶(LDH)及超微量总ATP酶(ATPase)均采用南京建成生物工程研究所研发的试剂盒进行测定。取0.1 g肝脏、鳃组织按重量体积比1∶9加入生理盐水,制成10.0%组织匀浆,离心收集上清液制备待测溶液。其中,鳃组织再加10和100倍生理盐水分别制成1.0%和0.1%组织匀浆,然后按试剂盒说明进行测定。使用BioTek EonTM微孔板分光光度计进行检测读数。
1. 4 总RNA提取及实时荧光定量PCR检测
取0.1 g翘嘴鳜肝脏置于RNAiso Plus[宝生物工程(大连)有限公司]中匀浆,按说明提取总RNA。以微量紫外分光光度计和1.5%琼脂糖凝胶电泳分别检测总RNA纯度及完整性后,使用HiFiScript cDNA Synthesis Kit试剂盒(北京康为世纪生物科技有限公司)将其反转录合成cDNA,-20 ℃保存备用。在NCBI中检索HIF-1α(Hypoxia inducible factor-1alpha)、EPO(Erythropoietin)和HSP90α(Heat shock protein 90 alpha)基因序列,以β-actin为管家基因,利用Primer-BLAST程序设计引物(表1),委托生工生物工程(上海)股份有限公司合成。实时荧光定量PCR反应体系20.0 μL:2×UltraSYBR Mixture 10.0 μL,上、下游引物各0.4 μL,cDNA模板0.8 μL,ddH2O 8.4 μL。扩增程序:95 ℃预变性10 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 32 s,进行39个循环;60 ℃ 30 s,95 ℃ 15 s。以2-ΔΔCt法换算目的基因的相对表达量。
1. 5 统计分析
试验数据采用Excel 2013进行统计整理,并以SPSS 22.0分别进行单因素方差分析(One-way ANOVA)和Duncans多重比较。
2 结果与分析
2. 1 急性低氧胁迫对翘嘴鳜肝脏抗氧化酶活性的影响
由图1可知,对照组翘嘴鳜肝脏CAT活性无显著变化(P>0.05,下同),试验组翘嘴鳜在整个急性低氧胁迫过程中其肝脏CAT活性呈先升高后降低的变化趋势。试验组翘嘴鳜肝脏CAT活性在低氧胁迫初期持续升高但与对照组相比无显著差异,至胁迫12 h时显著升高(P<0.05,下同),CAT活性达最高值(40.13 U/mg),是对照组的1.70倍;随后呈逐渐下降趋势,但至胁迫96 h时CAT活性仍显著高于对照组。
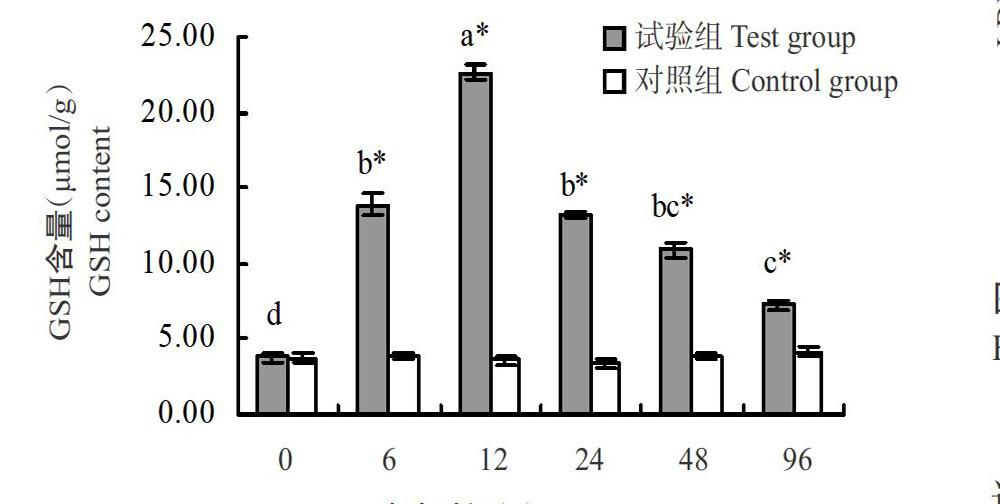
由图2可知,对照组翘嘴鳜肝脏GSH含量无显著变化,试验组翘嘴鳜在整个急性低氧胁迫过程中其肝脏GSH含量变化趋势与CAT活性相似,均呈先升高后降低的变化趋势,但较CAT活性变化更明显。低氧胁迫6 h时试验组翘嘴鳜肝脏GSH含量显著高于对照组,且呈持续升高趋势;至胁迫12 h时GSH含量达最高值(22.65 μmol/g),是对照组的6.24倍;随后开始下降,但直至胁迫96 h时试验组翘嘴鳜肝脏GSH含量仍显著高于对照组。
由图3可知,对照组翘嘴鳜肝脏GPT活性无显著变化,试验组翘嘴鳜在整个急性低氧胁迫过程中其肝脏GPT活性变化也呈先升高后降低的变化趋势。在低氧胁迫6 h时,试验组翘嘴鳜肝脏GPT活性与对照组间无显著差异;至胁迫12 h时GPT活性显著高于对照组,至胁迫48 h时GPT活性达最高值(12.93 U/g),是对照组的2.26倍;随后开始下降,但直至胁迫96 h时GPT活性仍显著高于对照组。
2. 2 急性低氧胁迫对翘嘴鳜鳃组织呼吸相关酶活性的影响
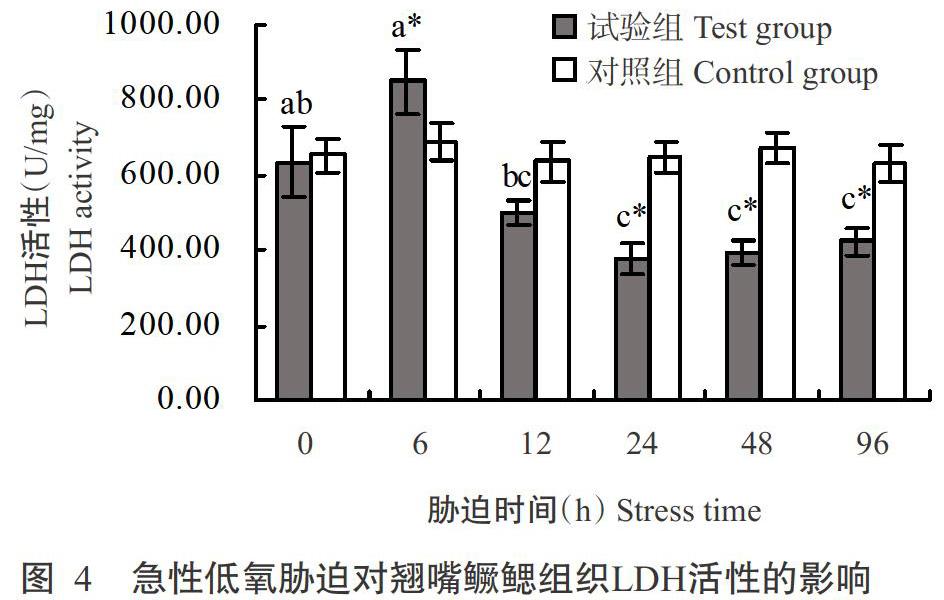
由图4可知,对照组翘嘴鳜鳃组织LDH活性无显著变化,试验组翘嘴鳜在整个急性低氧胁迫过程中其鳃组织LDH活性呈先升高后降低再升高的变化趋势。低氧胁迫6 h时试验组翘嘴鳜鳃组织LDH活性达最高值(849.67 U/mg),是对照组的1.34倍,显著高于对照组;随后开始下降,至胁迫24 h时LDH活性达最低值(380.32 U/mg),显著低于对照组;至胁迫96 h时LDH活性略有回升,但仍显著低于对照组。
由图5可知,对照组翘嘴鳜鳃組织ATPase活性无显著变化,试验组翘嘴鳜在整个急性低氧胁迫过程中其鳃组织ATPase活性呈降低—升高—降低的变化趋势。低氧胁迫6 h时,试验组翘嘴鳜鳃组织ATPase活性显著低于对照组,至胁迫24 h时达最低值(0.35 U/mg),仅为对照组的16%;随后ATPase活性略有回升,但仍显著低于对照组。
2. 3 急性低氧胁迫对翘嘴鳜低氧诱导反应相关基因表达的影响
如图6所示,在整个急性低氧胁迫过程中,试验组翘嘴鳜肝脏HIF-1α基因的相对表达量呈逐渐升高趋势。低氧胁迫24 h内,试验组翘嘴鳜肝脏HIF-1α基因的相对表达量与对照组的差异均不显著;从胁迫48 h起HIF-1α基因的相对表达量显著高于对照组,至胁迫96 h时其相对表达量达最高值,是对照组的9.57倍。
如图7所示,在整个急性低氧胁迫过程中,试验组翘嘴鳜肝脏EPO基因的相对表达量呈先升高后降低的变化趋势。低氧胁迫12 h时,试验组翘嘴鳜肝脏EPO基因的相对表达量达最高值,显著高于对照组;随后呈下调趋势,但至胁迫24 h时EPO基因的相对表达量仍显著高于对照组;从胁迫48 h起,试验组翘嘴鳜肝脏EPO基因的相对表达量与对照组相比无显著差异。
如图8所示,在整个急性低氧胁迫过程中,试验组翘嘴鳜肝脏HSP90α基因的相对表达量呈升高—降低—升高—降低的波动变化趋势。低氧胁迫6 h时,试验组翘嘴鳜肝脏HSP90α基因的相对表达量达最高值,显著高于对照组;随后开始下调,至胁迫12 h时其相对表达量开始与对照组持平;至胁迫48 h时试验组翘嘴鳜肝脏HSP90α基因的相对表达量又出现一个峰值,且显著高于对照组,但至胁迫96 h时HSP90α基因的相对表达量又降至对照组水平。
3 讨论
3. 1 翘嘴鳜肝脏抗氧化酶活性对急性低氧胁迫的响应
需氧生物的正常新陈代谢均会产生少量活性氧自由基(ROS),参与其体内的各种生理活动。当机体受到逆境胁迫时,体内产生的ROS大量积累而造成氧化损伤。抗氧化酶类在清除多余ROS的过程中发挥重要作用(亢玉静等,2013),CAT和GSH是抗氧化酶类的重要组成部分,是反映机体健康与否的重要指标(梁俊平等,2019)。本研究结果表明,低氧胁迫下翘嘴鳜肝脏的CAT活性和GSH含量均呈先升高后降低的变化趋势。低氧胁迫6 h时翘嘴鳜肝脏GSH含量升高显著高于对照组,至胁迫12 h时GSH含量达最高值;与此同时,翘嘴鳜肝脏CAT活性升高,至胁迫12 h时显著高于对照组。说明低氧胁迫致使翘嘴鳜体内的ROS含量升高,从而引起抗氧化酶系统诱导CAT活性和GSH含量升高,以清除体内过多的ROS,将ROS诱导的脂质过氧化程度控制在其生理可耐受范围内(Lushchak et al.,2001),保护机体不受损害,与陈世喜等(2016)的研究结果相似。至胁迫24 h时,翘嘴鳜肝脏CAT活性和GSH含量分别出现下降趋势,可能是因低氧胁迫时间过长,翘嘴鳜体内的ROS得不到及时清除而大量积累,超过体内抗氧化酶系统的耐受极限,致使抗氧化酶活性下降,与常志成等(2018)的研究结果相似。至胁迫96 h时,翘嘴鳜肝脏CAT活性和GSH含量虽然显著高于对照组,但相对于胁迫12 h时明显降低,其原因可能是翘嘴鳜体内ROS含量已超过体内抗氧化酶系统的耐受极限,导致抗氧化系统受损,但仍具有抗氧化作用。可见,低氧胁迫前期翘嘴鳜体内抗氧化酶系统被激活,随着胁迫时间的延长,其抗氧化酶系统虽然受到影响,但仍然继续行使抗氧化功能。
GPT能催化氨基从丙氨酸向α-酮戊二酸转移,形成谷氨酸和丙酮酸(刘沛,2014),其活性反映蛋白合成与分解代谢的状况(李开放和徐奇友,2019),是判断肝细胞损伤的重要指标之一(罗莎等,2016)。本研究结果表明,低氧胁迫下翘嘴鳜肝脏GPT活性呈先升高后降低的变化趋势。低氧胁迫12 h时翘嘴鳜肝脏GPT活性显著高于对照组,表明低氧胁迫导致翘嘴鳜体内的ROS含量升高,虽然激活了抗氧化酶系统,但由于未能及时清除过多的ROS,致使肝细胞受损伤,GPT活性升高,与陈静怡等(2018)的研究结果一致;同时说明CAT和GSH的协同作用对GPT的影响具有滞后性。在胁迫48 h时,GPT活性升高至最高值,表明随着胁迫时间的延长,大量ROS在体内积累而得不到及时清除,严重影响抗氧化酶系统。至胁迫96 h时,可能是机体进行自我调节后稍有恢复,GPT活性有所下降,但仍显著高于对照组。
3. 2 翘嘴鳜鳃组织呼吸相关酶活性对急性低氧胁迫的响应
LDH的功能是催化乳酸氧化形成丙酮酸,在糖酵解与有氧氧化的转换过程中起关键作用(毛瑞鑫等,2009;揭小华等,2015),其活性反映机体的无氧呼吸代谢水平。鳃组织是鱼类的呼吸器官,是溶解氧进行气体交换的场所(王晓雯等,2016)。本研究结果表明,低氧胁迫6 h时试验组翘嘴鳜鳃组织LDH活性显著高于对照组,但随后呈逐渐下降趋势,与李根瑞(2016)的研究结果相似。说明在低氧胁迫下,翘嘴鳜通过无氧代谢为机体提供能量,并进行自我生理调节恢复。无氧呼吸代谢能力增强,促进乳酸积累,而积累的乳酸诱导LDH活性上升,形成一种调节机制。胁迫24~96 h,试验组翘嘴鳜鳃组织LDH活性略有回升但仍显著低于对照组,与区又君等(2017)的研究结果基本吻合,可能是低氧胁迫时间过长,机体为应对低氧胁迫带来的影响而将乳酸转化为葡萄糖,以维持机体酸碱平衡及葡萄糖供应(Oliveira et al.,2004),从而引起乳酸含量下降;也可能是低氧胁迫已超出机体LDH的调节范围,使其不能发挥调节功能。
ATPase能将三磷酸腺苷(ATP)催化水解为二磷酸腺苷(ADP)和磷酸根离子,释放能量供给生命活动,但ATPase的合成及活性均受外界溶解氧变化的影响(王晓雯等,2016)。本研究结果表明,低氧胁迫下翘嘴鳜鳃组织ATPase活性呈降低—升高—降低的变化趋势,且显著低于对照组,与王春枝等(2014)的研究结果相似。王春枝等(2014)認为在低氧条件下鱼类能通过自我调节作用,促使ATPase活性升高,但溶解氧降至一定程度时,可能超过鱼类自我调节的范围,因此ATPase活性呈急速下降趋势。在整个急性低氧胁迫过程中,LDH活性显著低于对照组,可能也影响ATPase活性,究其原因可能是急性低氧胁迫时间过长造成翘嘴鳜线粒体或线粒体内膜的损伤,从而影响ATPase活性。
3. 3 翘嘴鳜低氧诱导反应相关基因对急性低氧胁迫的响应
在缺氧条件下,基因表达变化主要由缺氧诱导因子(HIF alpha)介导(Kalle et al.,2007)。其中,HIF-1α是低氧信号传导途径中的关键因子,对调控低氧信号传导途径起重要作用,在多数高低等动物体内均有表达(肖武汉,2014)。孙俊霄等(2019)在黄颡鱼低氧(溶解氧含量1.48±0.27 mg/L)胁迫24 h、张凯强等(2020)在花鲈低氧(溶解氧含量1.56±0.24 mg/L)胁迫12 h的研究中发现HIF-1α基因呈上调表达,但Geng等(2014)研究表明斑点叉尾鮰在低氧(溶解氧含量1.0 mg/L)胁迫下,HIF-1α基因在胁迫1.5 h时呈下调表达,至胁迫5.0 h时则上调表达;Mu等(2015)研究发现许氏平鲉在低氧条件下其肝脏HIF-1α基因表达无显著差异。本研究结果表明,低氧胁迫48 h时翘嘴鳜肝脏HIF-1α基因的相对表达量开始显著上调,可能是本研究的溶解氧含量较高,翘嘴鳜肝脏HIF-1α信号通路在低氧胁迫前期未被激活,直至低氧胁迫48 h时才引起转录因子HIF累积,HIF-1α基因上调表达促使翘嘴鳜能量代谢由有氧向无氧转变(王国善等,2014),以适应低氧环境。
EPO是一种糖蛋白激素,具有促红细胞生成的调节功能(Chu et al.,2007)。周智涓等(2016)研究证实缺氧环境能影响BMSCs细胞EPO蛋白的表达。本研究结果也表明,低氧胁迫12 h时翘嘴鳜肝脏EPO基因的相对表达量显著上调,说明低氧诱导了机体低氧应激反应,通过上调EPO基因表达以促进翘嘴鳜肝脏红细胞的生成,进而应对缺氧导致的血氧能力下降,提高機体的低氧耐受能力。随后EPO基因表达持续下调,至低氧胁迫48 h时与对照组差异不显著,可能是翘嘴鳜通过上调EPO基因表达而促使机体对氧气的获取能力和利用率有所提高,同时通过反馈机制抑制EPO基因生成,维持红细胞正常水平,以获得生命活动需要的氧气,使机体适应低氧环境,进而导致EPO基因表达下调,与赵永丽等(2018)的研究结论一致。HIF-1α基因和EPO基因具有协同作用,但在急性低氧胁迫下的应激反应不同步,可能是二者的响应过程及承担功能不同,也可能是存在一定的组织特异性,具体原因有待进一步探究。
HSP(热休克蛋白)是一整套高度保守的蛋白,除热应激外,缺氧、局部缺血、毒素等均会促使其上调表达(Roberts et al.,2010)。HSP90家族是HSP最重要的基因家族,常被用作环境胁迫因子的分子生物标志物(刘童,2015)。本研究结果表明,低氧胁迫后翘嘴鳜肝脏HSP90α基因的相对表达量显著上调,说明肝脏在低氧胁迫下受到影响,机体通过上调HSP90α基因表达而发挥对细胞的保护作用;随后其相对表达量下调,可能是HSP90α基因表达上调发挥作用,使机体能适应低氧环境,与徐贺(2015)的研究结果相似。至胁迫48 h时HSP90α基因的相对表达量又出现一个峰值,且显著高于对照组,可能是随低氧胁迫时间的延长,再次激活机体氧化应激效应,保护肝脏细胞,与王晓雯等(2019)研究发现急性热应激下西伯利亚鲟幼鱼肝脏受到影响但胁迫96 h后能恢复的结果相似。
4 结论
急性低氧胁迫对翘嘴鳜肝脏抗氧化酶、鳃组织呼吸相关酶及低氧诱导反应相关基因表达均产生显著影响。虽然翘嘴鳜能通过自我调节抗氧化酶和呼吸相关酶活性及上调低氧诱导反应相关基因表达,促使机体适应低氧环境,但养殖水体溶解氧降至2.8 mg/L以下即对翘嘴鳜产生不利影响,因此在实际养殖过程中须密切关注养殖水体溶解氧变化。
参考文献:
蔡建中,李洪进,唐玉华. 2011. 鱼虾蟹池塘微孔增氧高产高效养殖技术初探[J]. 渔业致富指南,(1):55-57. [Cai J Z,Li H J,Tang Y H. 2011. Preliminary study on microporous oxygenation and high yield and high efficient aquaculture technology for fish,prawn and crab ponds [J]. Fishery Guide to be Rich,(1):55-57.]
常志成,温海深,张美昭,李吉方,李昀,张凯强,王伟,刘阳,田源,王晓龙. 2018. 溶解氧水平对花鲈幼鱼氧化应激与能量利用的影响及生理机制[J]. 中国海洋大学学报(自然科学版),48(7):20-28. [Chang Z C,Wen H S,Zhang M Z,Li J F,Li Y,Zhang K Q,Wang W,Liu Y,Tian Y,Wang X L. 2018. Effects of dissolved oxygen levels on oxidative stress response and energy utilization of juvenile Chinese sea bass(Lateolabrax maculatus) and associate physiological mechanisms[J]. Periodical of Ocean University of China,48(7):20-28.]
陈静怡,王晓雯,朱华,马国庆. 2018. 不同水温下低氧胁迫对西伯利亚鲟生理状态的影响[J]. 水产科技情报,45(2):70-76. [Chen J Y,Wang X W,Zhu H,Ma G Q. 2018. Effects of hypoxia stress on the physiological status of Siberian cormorants at different water temperatures[J]. Fisheries Science and Technology Information,45(2):70-76.]
陈世喜,王鹏飞,区又君,温久福,李加儿,王雯,谢木娇. 2016. 急性和慢性低氧胁迫对卵形鲳鲹幼鱼肝组织损伤和抗氧化的影响[J]. 动物学杂志,51(6):1049-1058. [Chen S X,Wang P F,Ou Y J,Wen J F,Li J E,Wang W,Xie M J. 2016. The Effect of acute and chronic hypoxia stress on liver tissue structure and oxidation in juvenile Golden Pompano(Trachinotus ovatus)[J]. Chinese Journal of Zoology,51(6):1049-1058.]
狄治朝,周涛,许强华. 2018. 低氧胁迫与常氧条件下斑马鱼鳃中热休克蛋白基因家族的表达差异比较[J]. 大连海洋大学学报,33(6):690-695. [Di Z C,Zhou T,Xu Q H. 2018. Expression comparisons of heat shock proteins gene in gills of zebrafish exposed to both normoxia and hypoxia[J]. Journal of Dalian Ocean University,33(6):690-695.]
贾秀琪,张宏叶,王丽,于兴达,王佩佩,张国松,尹绍武. 2017. 低氧胁迫对河川沙塘鳢抗氧化酶及ATP酶活性的影响[J]. 海洋渔业,39(3):306-313. [Jia X Q,Zhang H Y,Wang L,Yu X D,Wang P P,Zhang G S,Yin S W. 2017. Effect of hypoxia stress on the antioxidant enzyme and ATP enzyme activity in tissues of Odontobutis potamophila[J]. Marine Fisheries,39(3):306 -313.]
揭小華,彭雄,黄波,肖影群,罗达亚. 2015. 乳酸脱氢酶编码基因在肿瘤中表达及其转录调控机制的研究进展[J]. 肿瘤,35(11):1271-1277. [Jie X H,Peng X,Huang B,Xiao Y Q,Luo D Y. 2015. Progress in research on expression and transcriptional regulation of lactate dehydrogenase coding genes in cancer[J]. Tumor,35(11):1271-1277.]
亢玉静,郎明远,赵文. 2013. 水生生物体内抗氧化酶及其影响因素研究进展[J]. 微生物学杂志,33(3):75-80. [Kang Y J,Lang M Y,Zhao W. 2013. Advance in antioxi-dant enzymes and its effect factors in aquatic organisms[J]. Journal of Microbiology,33(3):75-80.]
李根瑞. 2016. 仿刺参对环境低氧胁迫的生理生化响应研究[D]. 上海:上海海洋大学. [Li G R. 2016. Study on the physiological and biochemical responses of Apostichopus japonicus to environmental hypoxia stress[D]. Shanghai:Shanghai Ocean University.]
李开放,徐奇友. 2019. 白藜芦醇对松浦镜鲤生长性能、肠道消化酶活性、肝脏抗氧化指标和血清生化指标的影响[J]. 动物营养学报,31(4):1833-1841. [Li K F,Xu Q Y. 2019. Effects of resveratrol on growth performance,intestinal digestive enzyme activities,liver antioxidant indices and serum biochemical indices of Songpu mirror carp[J]. Chinese Journal of Animal Nutrition,31(4):1833-1841.]
梁俊平,张静,覃宝利,王宣朋,蔺玉华,丁辰龙,吴学军. 2019. 维生素C对氨氮胁迫下大鳞鲃幼鱼存活及鳃抗氧化酶活性的影响[J]. 河南农业科学,49(1):157-164. [Liang J P,Zhang J,Qin B L,Wang X P,Lin Y H,Ding C L,Wu X J. 2019. Effects of vitamin C on the survival and antioxidant enzyme activities of juvenile Barbus ca-pito under ammonia-N stress[J]. Journal of Henan Agricultural Sciences,49(1):157-164.]
刘林. 2011. 蟹、鳜池塘微孔增氧高效生态混养技术[J]. 渔业致富指南,(18):47-48. [Liu L. 2011. High efficiency ecological mixed culture technology of micro hole oxygena-tion for Eriocheir sinensis H. Milne-Edwards and Siniperca chuatsi[J]. Fishery Guide to be Rich,(18):47-48.]
刘沛. 2014. 光学核酸分子探针信号放大策略用于生化分析的研究[D]. 长沙:湖南大学. [Liu P. 2014. Reaserch of signal amplification methods of nucleic acid molecular optical probes in biochemical analysis[D]. Changsha:Hunan University.]
刘童. 2015. 基于菲律宾蛤仔的近海多环芳烃生物监测技术的研究[D]. 青岛:中国海洋大学. [Liu T. 2015. Biological monitoring technology research of offshore PAHs in the clam Ruditapes philippinarum[D]. Qingdao:Ocean University of China.]
罗莎,王秋举,鞠雪,厉菲菲,高永生,张东鸣. 2016. 氧化鱼油对草鱼幼鱼磷酸酶和转氨酶活性的影响[J]. 吉林农业大学学报,38(3):357-363. [Luo S,Wang Q J,Ju X,Li F F,Gao Y S,Zhang D M. 2016. Effects of oxidized fish oil on activities of phosphatase and aminotransferase in juvenile grass carp(Ctenopharyngodon idella)[J]. Journal of Jilin Agricultural University,38(3):357-363.]
毛瑞鑫,刘福军,张晓峰,张研,曹顶臣,鲁翠云,梁利群,孙效文. 2009. 鲤鱼乳酸脱氢酶活性的QTL检测[J]. 遗传,31(4):407-411. [Mao R X,Liu F J,Zhang X F,Zhang Y,Cao D C,Lu C Y,Liang L Q,Sun X W. 2009. Studies on quantitative trait loci related to activity of lactate dehydrogenase in common carp(Cyprinus carpio)[J]. Gene-tics,31(4):407-411.]
区又君,陈世喜,王鹏飞,李加儿,温久福,王雯,谢木娇. 2017. 低氧环境下卵形鲳鲹的氧化应激响应与生理代谢相关指标的研究[J]. 南方水产科学,13(3):120-124. [Ou Y J,Chen S X,Wang P F,Li J E,Wen J F,Wang W,Xie M J. 2017. Study on oxidative stress response and physiological metabolism related indices of Trachinotus ovatus under hypoxic stress[J]. South China Fisheries Science,13(3):120-124.]
司亚东,陈英鸿,曾继参. 1995. 鳜鱼的耗氧率及其池塘养殖[J]. 水生生物学报,19(4):327-332. [Si Y D,Chen Y H,Zeng J S.1995. The oxygen consumption and cultivation of mandarin fish,Siniperca chuatsi[J]. Acta Hydrobiolo-gica Sinica,19(4):327-332.]
孙俊霄,韩广坤,刘娅,李明波,袁勇超,樊启学,王银海,杨贺舒,莫爱杰. 2019. 杂交黄颡鱼与普通黄颡鱼幼鱼生长性能及耐低氧能力的比较[J]. 水生生物学报,43(6):1271-1279. [Sun J X,Han G K,Liu Y,Li M B,Yuan Y C,Fan Q X,Wang Y H,Yang H S,Mo A J. 2019 .The crowth characteristics and hypoxia tolerant ability of ye-llow catfish and hybrid catfish[J]. Acta Hydrobiologica Sinica,43(6):1271-1279.]
王春枝,李忠,梁宏偉,王丹,吴奎,邹桂伟. 2014. 低氧胁迫对鲢线粒体ATP酶活性及F1-δ基因表达的影响[J]. 中国水产科学,21(3):454-463. [Wang C Z,Li Z,Liang H W,Wang D,Wu K,Zou G W. 2014. The effects of hypoxia stress on mitochondrial ATPase activity and the expression of F1-δ in Hypophthalmichthys molitrix[J]. Journal of Fishery Sciences of China,21(3):454-463.]
王国善,甄毓,王敏晓,王建艳,石岩,米铁柱,孙松,于志刚. 2014. 急性低氧胁迫下海月水母HIF-1α基因的表达[J]. 科学通报,59(18):1715-1722. [Wang G S,Zhen Y,Wang M X,Wang J Y,Shi Y,Mi T Z,Sun S,Yu Z G. 2014. Hypoxia induced gene expression under acute hypoxic stress in Aurelia sp.1[J]. Chinese Science Bulletin,59(18):1715-1722.]
王慧娟. 2015. 低氧对团头鲂生理生化指标及低氧应答基因表达的影响[D]. 武汉:华中农业大学. [Wang H J. 2015. Hypoxia effect on changes of biochemical and physiolo-gical parameters and the expression of hypoxia response genes in Megalobrama amblycephala[D]. Wuhan:Huazhong Agricultural University.]
王晓雯,张蓉,朱建亚,刘丽丽,马国庆,朱华. 2019. 急性热应激对西伯利亚鲟肝功指标及肝脏热休克蛋白表达的影响[J]. 四川农业大学学报,37(1):122-128. [Wang X W,Zhang R,Zhu J Y,Liu L L,Ma G Q,Zhu H. 2019. Effects of acute heat stress on hepatic biochemical index and gene expression of heat shock proteins in Acipenser baeri[J]. Journal of Sichuan Agricultural University,37(1):122-128.]
王晓雯,朱华,胡红霞,马国庆. 2016. 低氧胁迫对西伯利亚鲟幼鱼生理状态的影响[J]. 水产科学,35(5):459-465. [Wang X W,Zhu H,Hu H X,Ma G Q. 2016. Effects of hypoxia on physiological status of Siberian sturgeon Acipenser baeri juvenile[J]. Fisheries Science,35(5):459-465.]
肖武汉. 2014. 低氧信号传导途径与鱼类低氧适应[J]. 中国科学:生命科学,44(12):1227-1235. [Xiao W H. 2014. Hypoxia signaling pathway and hypoxia adaptation of fishes[J]. Science China:Life Science,44(12):1227-1235.]
熊向英,黄国强,彭银辉,刘旭佳. 2016. 低氧胁迫对鲻幼鱼生长、能量代谢和氧化应激的影响[J]. 水产学报,40(1):73-82. [Xiong X Y,Huang G Q,Peng Y H,Liu X J. 2016. Effect of hypoxia on growth performance,energy metabolism and oxidative stress of Mugil cephalus[J]. Journal of Fisheries of China,40(1):73-82.]
徐贺. 2015. 丙氨酰—谷氨酰胺和γ-氨基丁酸对建鲤生长、免疫和抗低氧胁迫的影响[D]. 长春:吉林农业大学. [Xu H. 2015. Effect of Ala-Gln and γ-GABA on growth,immunity and resistance to hypoxia stress of Cyprinus carpio var. jian[D]. Changchun:Jilin Agricultural University.]
杨春,李达,徐光龙,张力. 2003. 鄱阳湖鳜鱼窒息点与耗氧率的初步研究[J]. 江西农业学报,10(4):96-98. [Yang C,Li D,Xu G L,Zhang L. 2003. Preliminary study on asphyxiation point and oxygen consumption rate of Siniperca chuatsi[J]. Acta Agriculturae Jiangxi,10(4):45-48.]
张凯强,常志成,温海深,李吉方,齐鑫,张晓燕,李昀. 2020. 花鲈低氧诱导因子基因(hifs)的序列分析及低氧诱导表达[J]. 中国海洋大学学报(自然科学版),50(1):39-47. [Zhang K Q,Chang Z C,Wen H S,Li J F,Qi X,Zhang X Y,Li Y. 2020. Sequence analysis and hypoxia-induced expression of hypoxia inducible factor gene(hifs) in La-teolabrax maculatus[J]. Periodical of Ocean University of China,50(1):39-47.]
章愛华. 2017. 蟹、鳜池塘微孔增氧生态高效养殖技术[J]. 河北渔业,(3):39-41. [Zhang A H. 2017. Microporous aera-tion and ecological high-efficiency aquaculture technology for Eriocheir sinensis H. Milne-Edwards and Siniperca chuatsi[J]. Hebei Fisheries,(3):39-41.]
赵永丽,吴蓉蓉,晁燕,陈祺昌,夏明哲,祁得林. 2018. 花斑裸鲤Epo和Epor基因克隆及其低氧诱导的mRNA表达[J]. 动物学杂志,53(2):220-233. [Zhao Y L,Wu R R,Chao Y,Chen Q C,Xia M Z,Qi D L. 2018. cDNA cloning and hypoxia-induced mRNA expression of Epo and Epor genes in Gymncypris eckloni[J]. Chinese Journal of Zoo-logy,53(2):220-233.]
周智涓,伍卫,黄穗花,刘茂,陈剑. 2016. 低氧环境对大鼠骨髓间充质干细胞交感神经重构相关因子表达的影响[J]. 中西医结合心脑血管病杂志,14(6):599-603. [Zhou Z J,Wu W,Huang S H,Liu M,Chen J. 2016. Effect of hypoxic environment on expression of sympathetic nerve remodeling related factors in rat bone marrow mesenchymal stem cells[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease,14(6):599-603.]
Abdel-Tawwab M,Monier M N,Hoseinifar S H,Faggio C. 2019. Fish response to hypoxia stress:Growth,physiolo-gical,and immunological biomarkers[J]. Fish Physiology and Biochemistry,45(3):997-1013.
Chu C Y,Cheng C H,Chen G D,Chen Y C,Hung C C,Huang K Y,Huang C J. 2007. The zebrafish erythropoietin:Functional identification and biochemical characte-rizations[J]. FEBS Letters,581(22):4265-4271.
Geng X,Feng J B,Liu S K,Wang Y P,Arias C,Liu Z J. 2014. Transcriptional regulation of hypoxia inducible factors alpha(HIF-α) and their inhibiting factor(FIH-1) of channel catfish(Ictalurus punctatus) under hypoxia[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry and Molecular Biology,169:38-50.
Kalle T R,Vuori K A M,Primmer C R,Nikinmaa M. 2007. Comparison of hypoxia-inducible factor-1 alpha in hypo-xia-sensitive and hypoxia-tolerant fish species[J]. Compa-rative Biochemistry and Physiology. Part D: Genomics and Proteomics,2(2):177-186.
Lushchak V I,Lushchak L P,Mota A A,Hermes-Lima M. 2001. Oxidative stress and antioxidant defenses in goldfish Carassius auratus during anoxia and reoxygenation[J]. American Journal of Physiology Regulatory,Integrative and Comparative Physiology,280(1):R100-R107.
Mu W J,Wen H S,Li J F,He F. 2015. HIFs genes expression and hematology indices responses to different oxygen treatments in an ovoviviparous teleost species Sebastes schlegelii[J]. Marine Environmental Research,110:142-151.
Oliveira G T,Eichler P,Rossi I C,Da Silva R S M. 2004. Hepatopancreas gluconeogenesis during anoxia and post-ano-xia recovery in Chasmagnathus granulata crabs maintained on high-proteinor carbohydrate-rich diets[J]. Journal of Experimental Zoology. Part A:Comparative Experi-mental Biology,301(3):240-248.
Omlin T,Weber J M. 2010. Hypoxia stimulates lactate dispo-sal in rainbow trout[J]. Journal of Experimental Biology,213(22):3802-3809.
Pichavant K,Maxime V,Thébault M T,Ollivier H,Garnier J P,Bousquet B,Diouris M,Boeuf G,Nonnotte G. 2002. Effects of hypoxia and subsequent recovery on turbot Scophtalmus maximus:Hormonal changes and anaerobic metabolism[J]. Marine Ecology Progress Series,225:275-285.
Rinaldi L,Basso P,Tettamanti G,Grimaldi A,Terova G,Saroglia M,de Eguileor M. 2005. Oxygen availability causes morphological changes and a different VEGF/FIk-1/HIF-2 expression pattern in sea bass gills[J]. Italian Journal of Zoology,72(2):103-111.
Roberts R J,Agius C,Saliba C,Bossier P,Sung Y Y. 2010. Heat shock proteins(chaperones) in fish and shellfish and their potential role in relation to fish health:A review[J]. Journal of Fish Diseases,33(10):789-801.
Sun J L,Zhao L L,Liao L,Tang X H,Cui C,Liu Q,He K,Ma J D,Jin L,Yan T,Zhou J,Yang S. 2020. Interactive effect of thermal and hypoxia on largemouth bass(Micropterus salmoides) gill and liver:Aggravation of oxidative stress,inhibition of immunity and promotion of cell apoptosis[J]. Fish & Shellfish Immunology,98:923-936.
Wedemeyer G A. 1996. Interactions with water quality conditions[J]. Physiology of Fish in Intensive Culture Systems,4:60-110.
Wu C B,Zheng G D,Zhao X Y,Zhou S,Zou S M. 2020. Hypoxia tolerance in a selectively bred F4 population of blunt snout bream(Megalobrama amblycephala) under hypoxic stress[J]. Aquaculture,518:734484. doi:10.1016/ j.aquaculture.2019.734484.
(責任编辑 兰宗宝)

