赊店老酒大曲中耐高温霉菌的筛选与产酶条件优化
刘延波 张丽婷 赵志军 王贤 孙西玉 潘春梅


摘要: 从赊店老酒大曲中分离筛选得到1株在60 ℃仍能生长的霉菌,将其命名为B8。对该菌株进行菌落形态观察和种属鉴定,确定其为根霉菌(Rhizopus),最适生长温度为45 ℃。以该菌株为出发菌株,通过单因素试验测定其糖化酶活力和液化酶活力,结合响应面分析法优化其培养条件,测得其糖化酶活力在料水比为5 g ∶3 mL、氮源添加量为0.4%、培养时间为5 d时最高,经试验验证酶活力达到162.38 U/g,与预测值基本接近;液化酶活力在料水比为5 g ∶3 mL、氮源添加量为0.4%、培养时间为5 d时最高,经试验验证酶活力达到41.57 U/g,与预测值基本接近。
关键词: 赊店老酒;大曲;霉菌;耐高温;液化酶;糖化酶;响应面回归方程;产酶条件
中图分类号:S182;TS262.3 文献标志码: A
文章编号:1002-1302(2020)05-0268-08
白酒的产量与品质主要取决于大曲中微生物的协同参与作用[1-2],而在大曲的真菌群落中,霉菌是很重要的一类微生物[3]。一方面,霉菌为其他微生物提供生长因子;另一方面,霉菌产生的淀粉酶对白酒酿造有至关重要的作用[4-5]。淀粉酶主要包括液化酶和糖化酶,对淀粉的水解能力极强[6-8]。
在制曲过程中,中高温大曲温度达到60 ℃以上时,将大量耐热性差的微生物淘汰,相当于一个富集嗜热菌的过程[9]。而嗜热功能霉菌对白酒的风味起着重要的作用,具有重要的研究价值[10]。目前关于白酒大曲中耐高温细菌的研究较多,如葛媛媛等从高温大曲中筛选出85株可以耐受55 ℃温度的嗜热细菌[11],周瑞平等从偏高温大曲中筛选出可耐受72 ℃高温的嗜热细菌[12];而对浓香型白酒中高温大曲中耐高温霉菌的研究较少。因此,本研究以赊店老酒的中高温大曲为试验材料筛选得到耐高温霉菌,并对其产酶条件进行研究,以期揭示制曲过程和酿酒规律,为后期运用优势菌优化白酒生产工艺、提高白酒出酒率提供理论基础。
1 材料与方法
1.1 儀器与试剂
1.1.1 材料和试剂 试验材料:赊店老酒股份有限公司的中高温大曲。
培养基:PDA(马铃薯琼脂培养基);孟加拉红培养基;麸皮培养基。
0.2 mol/L醋酸缓冲液:称取乙酸钠13.4 g,以蒸馏水溶解,加入冰醋酸5.2 mL,定容于1 000 mL容量瓶中,摇匀,pH 值4.6。
2%可溶性淀粉:称取2 g淀粉,加入少量煮沸后的蒸馏水调成糊状,再加入约50 mL煮沸的蒸馏水,搅拌均匀,再煮沸1 min,冷却,加入10 mL 0.2 mol/L 乙酸缓冲液,于容量瓶中定容至100 mL。
DNS试剂:称取3,5-二硝基水杨酸10 g,置于约600 mL水中,逐渐加入NaOH 10 g,在50 ℃水浴锅中搅拌溶解,再依次加入酒石酸钾钠200 g、苯酚2 g、无水亚硫酸钠5 g,待全部溶解并澄清后,冷却至室温,用水定容至1 000 mL,过滤。贮存于棕色试剂瓶中,于暗处放置7 d后使用。
工作碘液:500 mg I2和5 g KI溶于100 mL水中,即为贮藏碘液,取1 mL贮藏碘液稀释至100 mL即为工作碘液。
1.1.2 仪器和设备 SW-CJ-2F型双人双面净化工作台(苏州净化设备有限公司);752型紫外可见分光光度计(上海菁华科技仪器有限公司);水浴锅(山东方科仪器有限公司);振荡培养箱(上海知楚仪器有限公司);GH-500ASB型隔水式培养箱(北京科伟永兴仪器有限公司);LDZX-50KBS型高压灭菌器(上海申安医疗器械厂)。
1.2 试验方法
1.2.1 霉菌的分离纯化
称取10 g大曲研磨,在无菌条件下加入到90 mL无菌水中,150 r/min充分振荡30 min。取上清液1 mL即为10-1稀释度,加入9 mL的无菌水中制成10-2稀释度,重复此步骤,直到稀释度为10-7。吸取各稀释度100 μL涂布于已经凝固的PDA培养基上,1个梯度做3个平行。30 ℃条件下培养3~5 d,完成初步分离。将得到的菌株用平板划线法进行纯化,纯化2~3次即可得到纯菌落。镜检[13],于孟加拉红斜面培养基试管中 4 ℃ 保藏。
1.2.2 耐高温霉菌的筛选
将保藏的霉菌分别接种到平板上,置于28 ℃条件下培养48 h后,缓慢将培养温度升高并将菌株继续转接,分别于40、45、50、55、57、60 ℃温度下培养3~5 d,直到获得最耐高温的菌株[14]。每株菌做3个平行。
1.2.3 菌株18S rDNA分析[15]
用Ezup柱式基因组DNA提取试剂盒提取基因组DNA,真菌核糖体rRNA区通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)由生工生物工程(上海)股份有限公司合成。
PCR反应试剂:SanTaq PCR Mix预混液、ddH2O、marker,生工生物工程(上海)股份有限公司。真菌核糖体扩增引物为通用引物对ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。反应体系为 50 μL(SanTaq PCR Mix预混液25 μL,引物各 2 μL,DNA模板2 μL,ddH2O 19 μL)。
PCR扩增条件:94 ℃ 6 min;94 ℃ 45 s,53 ℃ 45 s,72 ℃ 120 s,30个循环;最后72 ℃延伸10 min。取3 μL PCR产物经1%琼脂糖凝胶电泳检测产量和特异性,PCR产物由生工生物工程(上海)股份有限公司进行测序,然后在NCBI上通过BLAST程序进行同源性比较与分析。采用MEGA 6.0软件作系统发育树。
1.2.4 酶活的测定方法
1.2.4.1 液化酶活力:YOO改良法[16]
酶活力定义:于40 ℃下,5 min内水解1 mg淀粉(0.5%淀粉)的酶量为1个活力单位,以“U/g”表示。
1.2.4.2 糖化酶活力:DNS法[17]
葡萄糖标准曲线如图1所示。
酶活力定义:于40 ℃下、pH 值为4.6的条件下,每1 h水解淀粉产生1 mg葡萄糖作为1个酶活力单位,以“U/g”表示。
1.2.5 耐高温霉菌的产酶条件优化
1.2.5.1 不同料水比对菌株酶活的影响
以麸皮和不同水分混合制成麸曲,为菌株生长提供物质基础,菌株在不同料水比麸曲中培养其产酶活力也不同。选取分离得到的耐高温菌株,设置料水比为 5 g ∶1 mL、5 g ∶2 mL、5 g ∶3 mL、5 g ∶4 mL、5 g ∶5 mL,将料水混合均匀[18],配制好麸皮培养基以相同的量分装到三角瓶中,0.1 MPa灭菌20 min,冷却后接种,每隔12 h进行1次摇瓶,置于45 ℃恒温培养箱中培养4 d。干燥10 h后以pH值为7.5的磷酸缓冲溶液浸提1 h配制成粗酶液[19],对其进行液化酶活力和糖化酶活力的测定。
1.2.5.2 不同氮源添加量对菌株酶活力的影响
在麸曲中加入(NH4)2SO4不仅为菌株生长提供氮源,且对菌株生长环境中pH值也有一定的影响。因此本试验选取(NH4)2SO4作为氮源,分别以0.1%、0.4%、0.7%、1.0%、1.3%进行试验[20],以最适料水比配制麸皮培养基,并以相同的量分装到三角瓶中,0.1 MPa 灭菌20 min,冷却后接种,每隔12 h进行1次摇瓶,置于45 ℃恒温培养箱中培养 4 d,干燥10 h后以pH值为7.5的磷酸缓冲溶液浸提1 h配制成粗酶液,对其进行液化酶活力和糖化酶活力的测定。
1.2.5.3 不同培养时间对菌株酶活的影响
以最适料水比和最适氮源添加量配制麸皮培养基,并以相同的量分装到三角瓶中,0.1 MPa灭菌20 min,冷却后接种,每隔12 h进行1次摇瓶,置于45 ℃恒温培养箱中培养。培养后3 d开始取样测酶活,直到培养后7 d。
1.2.6 响应面试验
在前期单因素试验的基础上选取3个影响因素,以酶活力为因变量,利用DesignExpert 8.0.6软件设计Box-Behnken试验,分别确定产糖化酶和液化酶的最佳发酵工艺参数组合并进行试验验证[21]。利用Design-Expert 8.0.6软件对二次响应面回归模型作出相应的响应曲面[22-23]。
2 结果与分析
2.1 耐高温菌株筛选结果
从赊店老酒大曲中分离筛选得到霉菌200株,通过耐高温试验最终获得1株霉菌B8。B8菌株在60 ℃ 时仍能生长,且最适生长温度为45 ℃。B8菌株菌落形态如图2所示。
由图2可知,B8菌株的菌落培养特征为:蔓延迅速,初为白色,后逐渐变为黑褐色,透明性差。菌丝无隔膜,假根发达,分枝呈指状,孢子囊呈球形或近球形。
2.2 分子生物学鉴定结果
利用特异性引物对B8的18S rDNA片段进行扩增,然后进行凝胶电泳。由图3可以看出,扩增所得ITS序列长度约为574 bp,特异性好,与预期结果相符。
将所得B8菌株574 bp ITS序列在NCBI网站上通过BLAST程序进行同源性比较与分析。取与B8菌ITS序列一致性在99%以上的序列,用MEGA 6.0进行多序列比对并构建进化树,结果见图4。结合生理生化试验表明菌株B8属于根霉属(Rhizopus)。
2.3 单因素条件优化结果
2.3.1 不同料水比对菌株酶活的影响 由图5可知,B8产液化酶和糖化酶活力的能力具有同步性,都是随着水分的增多酶活力先慢慢升高再降低,即当水分含量过低或过高时,2种酶活力都比较低,而当料水比为5 g ∶3 mL时,2种酶活力最高,此时液化酶活力达到30.55 U/g,糖化酶活力达到 163.66 U/g。在制作麸曲中,水分是很重要的因素,过多或过少都会抑制菌株活力。因此,选择最佳料水比5 g ∶3 mL做后續试验。
2.3.2 不同氮源添加量对菌株酶活的影响 由图6可知,液化酶活力和糖化酶活力随着添加量的增多而升高,当氮源添加量达0.4%时2种酶活都达到最大值,此时液化酶活力为29.88 U/g, 糖化酶活力为142.34 U/g。之后随着添加量的增多,2种酶活力都呈下降趋势,过量的氮源添加量会使pH值超过菌株的正常生长范围。因此,选择0.4%氮源为最佳添加量做后续试验。
2.3.3 不同培养时间对菌株酶活的影响 以料水比为5 g ∶3 mL,氮源添加量为0.4%制作麸曲培养基,灭菌冷却后接种,从培养后3 d开始测酶活。由图7可知,液化酶活力在培养后3~5 d呈上升趋势,培养后5 d达到酶活最大值,为33.14 U/g;之后随着培养时间的增加、培养基内营养物质的消耗以及水分的减少,酶活力下降。糖化酶活力也是在培养后3~5 d逐渐上升,培养后4~6 d的酶活力相差甚小,分别是172.23、175.51 U/g,培养后5 d酶活达到最大值;之后呈下降趋势。因此,最佳培养时间选择 5 d 做后续试验。
2.4 糖化酶活力响应面试验结果
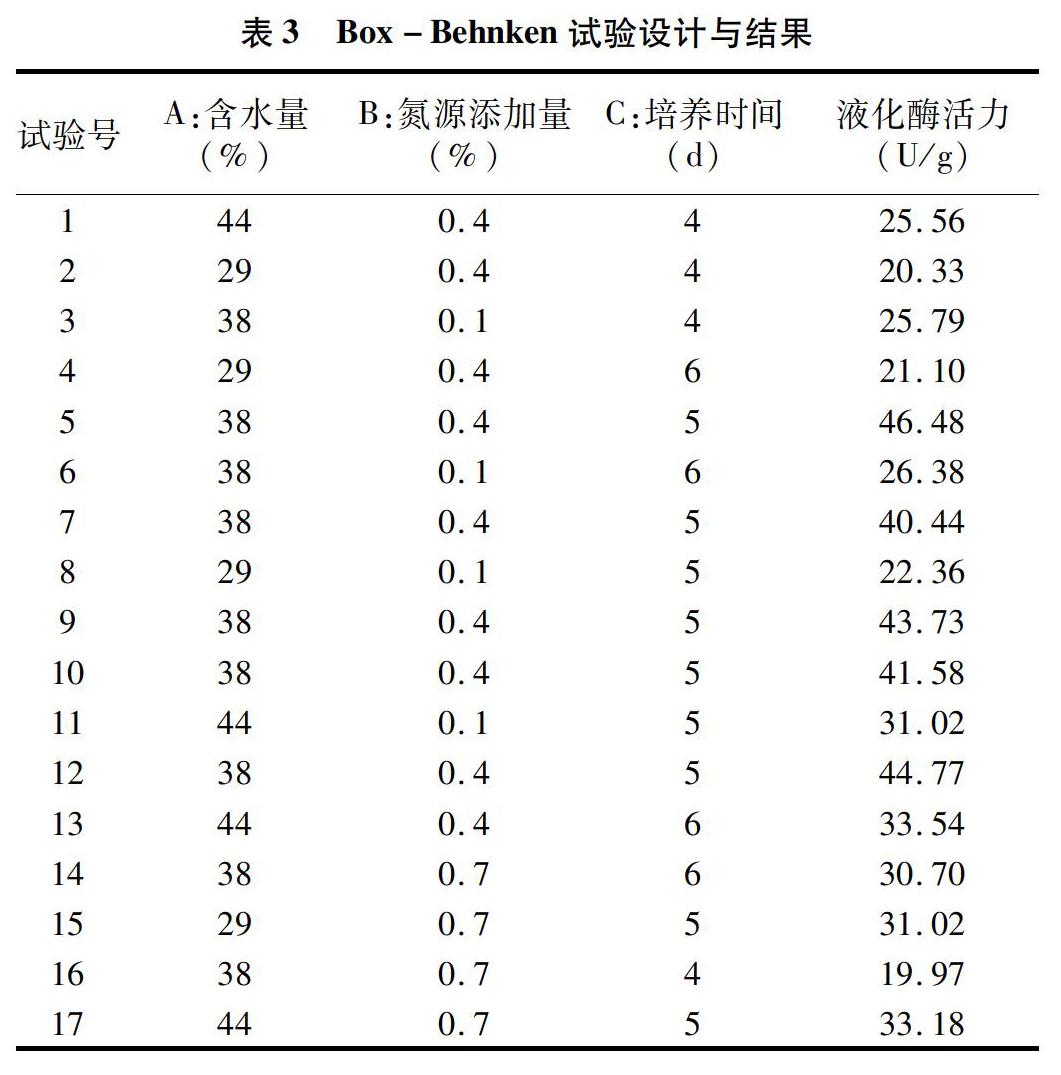
2.4.1 Box-Behnken设计与结果
根据Box-Behnken试验设计原理[24],设计17个试验点的响应面分析试验,以菌株的糖化酶活力作为响应值,选取A含水量(为了便于响应面分析数据的处理,料水比以下均采用水的百分含量表示,料水比 5 g ∶2 mL、5 g ∶3 mL、5 g ∶4 mL分别对应含水量29%、38%、44%)、B氮源添加量、C培养时间3个具有显著影响的因素作为自变量,试验因素的水平选取:含水量29%、38%、44%,氮源添加量0.1%、0.4%、0.7%,培养时间4、5、6 d,试验设计与结果如表1所示。

