γ-氨基丁酸能神经元在丙泊酚缓解抑郁模型大鼠电休克后脑损伤中的作用☆
陈舒婷 任力 闵苏○☆
抑郁症是目前已知全球发病率最高,导致患者行为失能最主要的精神疾病[1]。对于重度抑郁和难治性抑郁患者来说,电休克治疗(electric convulsive therapy,ECT)是重要的治疗方法[2]。然而电休克带来的学习记忆功能损害成为制约其在临床推广的主要因素[3]。大量临床和基础研究表明,无抽搐电休克治疗(modified electric convulsive therapy,MECT)能够明显减轻电休克带来的认知功能损伤[3]。丙泊酚系MECT最常用的全身麻醉药物,对电休克后学习、记忆功能有保护作用[4]。该药可以通过特异性激动 γ-氨基丁酸 A型受体 (γaminobutyric acid type A receptors,GABAAR) 发挥镇静安眠作用[5],而GABAAR的配体γ-氨基丁酸(γ-aminobutyric acid,GABA) 是脑内重要的抑制性神经递质。中枢神经系统内GABA水平改变或其受体GABAAR功能改变,无论是对学习、记忆能力,还是抑郁状态,均可产生明显影响[6]。因此本研究拟通过抑郁模型大鼠,测量其海马中GABA和GABAAR表达的变化,探讨电休克中丙泊酚保护学习、记忆功能的GABA能神经元机制。
1 材料与方法
1.1 研究材料 由重庆医科大学动物实验中心提供的2~3月龄健康雄性 Sprague-Dawley(SD)大鼠80只。采用慢性温和不可预见性应激(chronic unpredictable mild stress,CUMS)法建立抑郁模型,包括拥挤群养(20 只/笼,24 h)、禁饮(24 h)、禁食(24 h)、热水游泳(40 ℃,5 min)、冰水游泳(4 ℃,5 min)、睡眠剥夺(24 h)、水平摇笼(频率 1 次/s,20 min)、夹尾(1 min)、潮湿垫料(24 h)。每日随机给予一种刺激,同一种刺激不连续重复2 d,持续28 d。第29天停止刺激,进行糖水偏好实验,评测动物抑郁建模是否成功。
1.2 研究方法
1.2.1 糖水偏好实验(sucrose preference test,SPT)分别在建模后和电休克治疗后,各实施1次SPT。第1天给每只大鼠适应性饮用蔗糖水24 h后撤走,随即禁饮任何饮用水24 h。24 h后给予禁饮大鼠1瓶蔗糖水和1瓶蒸馏水1 h,记录1 h内糖水和蒸馏水的消耗量,计算糖水偏好百分比(sucrose preference percentage,SPP):SPP=[糖水消耗量 (mL)/(糖水消耗量 (mL)+蒸馏水消耗量(mL)]× 100%。
1.2.2 实验动物分组及处理 将抑郁建模成功的大鼠随机分为丙泊酚+电休克组、电休克组和抑郁组等3组(n=12),另设未建模的同一批次大鼠12只作为对照组。丙泊酚+电休克组腹腔注射80 mg/kg丙泊酚(批号:PK799,Astra Zeneca,意大利)后,行电休克处理(NiviqureMeditech,电休克治疗仪,印度),参数设置为双相矩形波,波幅0.8 A,波宽1.5 ms,频率125 Hz[7]。电休克组大鼠腹腔注射生理盐水(8 mL/kg)后,用同样方法行电休克处理。对照组和抑郁组大鼠腹腔注射8 mL/kg生理盐水后,双耳放置电极但不做电击处理。上述处理每日1次,持续7 d。
1.2.3 Morris水迷宫实验(Morris water maze,MWM) 电休克处理后第1~5天,将大鼠依次从NE(Ⅰ)、SE(Ⅱ)、SW(Ⅲ)、NW(Ⅳ)象限放入水中。 从入水到登陆位于NW(Ⅳ)象限平台的时间,记为逃避潜伏期(escape latency);如果60 s内大鼠找不到平台,则用工具引导其上台,逃避潜伏期记为60s。所有登陆平台的大鼠允许其逗留15 s用以学习记忆。第6天撤走位于NW(Ⅳ)象限的平台,将大鼠从平台的对侧SE(Ⅱ)象限放入水中,允许其自由游泳60 s,记录大鼠在 NW(Ⅳ)象限停留的时间,记作空间探索时间(space exploration time)。
1.2.4 ELISA检测海马GABA含量 MWM实验结束后,每组随机取 6只大鼠,用 2%戊巴比妥钠(50 mg/kg,ip)麻醉大鼠,快速断头分离全脑,于冰面上剥取完整双侧海马,称重后按100:1:1加入RIPA裂解液、PMSF和蛋白磷酸酶抑制剂,匀浆离心后取上清液保存待测。按照GABA ELISA试剂盒(塞维尔,武汉)说明书操作,设置标准孔、样品孔和对照孔。每孔样品孔加入100 μL待测样品,37℃孵育(1~2 h)。洗板后依次加入GABA抗体和酶结合物工作液,加入终止液后于酶标仪450 nm处以空白对照孔调零,测各孔的OD值。
1.2.5 Western blot检测海马GABAARα5蛋白含量取大鼠海马组织(同前),加细胞裂解液匀浆,离心后制备待测上清液。Western blot检测蛋白浓度(BCA 法),每个孔加样 50 μg,电泳、转膜、封闭。滴加抗 GABAARα5(1:500,Abcam)及抗 GAPDH(1:500,碧云天),4℃过夜。TBST清洗3次,滴加HRP标记的山羊抗兔 IgG(1:1000,碧云天),ECL显色。计算GABAARα5与GAPDH灰度值的比值(Image J软件),以反映GABAARα5蛋白的相对表达量。
1.2.6 免疫组化法检测海马GABAARα5蛋白表达余下大鼠戊巴比妥钠麻醉后开胸,右心穿刺,阻断下腔动脉和降主动脉,经升主动脉快速灌注4℃生理盐水100 mL后,以4%多聚甲醛缓慢灌注1 h,剥取大鼠完整大脑。4℃冰箱内4%多聚甲醛中固定24 h后,石蜡包埋组织并切片。组织切片常规脱蜡后行抗原修复,室温冷却后,PBS漂洗5 min,加10%山羊血清封闭液37℃孵育30 min,滴加一抗(1:100,兔抗大鼠 GABAARα5 抗体,Abcam)4 ℃孵育过夜。加二抗孵育(37℃,30 min),以二氨基联苯胺(DAB)显色,封片后显微镜下观察。Image J软件分析海马CA1区GABAARα5蛋白阳性表达光密度值。
1.3 统计学方法 采用SPSS 21.0进行统计分析。采用重复测量方差分析比较各组全程游泳速度和逃避潜伏期;采用单因素方差分析比较组间SPP、空间探索时间、GABA和GABAARα5蛋白表达水平,两两比较采用SNK-q检验。检验水准α=0.05,双侧检验。
2 结果
2.1 糖水偏好实验 CUMS建模之后,SPP组间差异具有统计学意义(F=148.19,P<0.01),与对照组比较,其余各组SPP均降低(P<0.01)。治疗处理后,各组间SPP差异具有统计学意义(F=123.21,P<0.01),丙泊酚+电休克组和电休克组SPP高于抑郁组(P<0.01),丙泊酚+电休克组和电休克组间差异无统计学意义(P>0.05)。见表1。
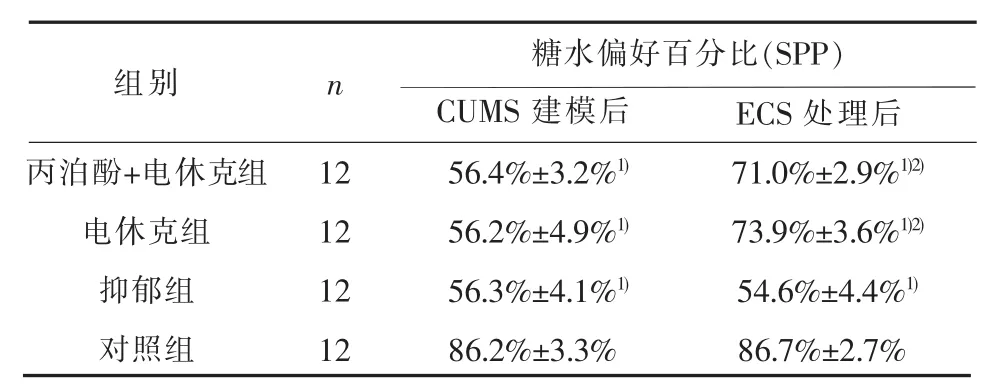
表1 糖水偏好实验结果
2.2 Morris水迷宫 各组大鼠游泳速度分组主效应无统计学意义 (F=0.35,P=0.98)。逃避潜伏期(F=2.59,P=0.01) 与空间探索时间 (F=26.95,P<0.01)的分组与时间交互效应均具有统计学意义。分组的简单效应中,丙泊酚+电休克组、电休克组和抑郁组相较于对照组逃避潜伏期延长(P<0.05),空间探索时间缩短(P<0.05);丙泊酚+电休克组和电休克组相较于抑郁组逃避潜伏期延长(P<0.05),空间探索时间缩短(P<0.05);丙泊酚+电休0.05),空间探索时间延长(P<0.05)。 见表 2。
2.3 海马GABA含量 各组大鼠海马组织GABA含量具有统计学差异 (F=305.21,P<0.01)。丙泊酚+电休克组比电休克组海马GABA含量低(P<0.05);丙泊酚+电休克组和电休克组高于抑郁组和对照组(P<0.05);抑郁组海马GABA含量比对照组低(P<0.05)。 见表 3。
2.4 海马GABAARα5蛋白表达量 各组大鼠海马组织 GABAARα5蛋白 Western-blot条带见图1;海马组织免疫组化显微镜观察结果见图2,黄染部分为GABAARα5蛋白阳性表达。各组海马GABAARα5蛋白相对表达水平(F=200.69,P<0.01)和海马 CA1区GABAARα5蛋白阳性表达光密度值(F=43.38,P<0.01)差异具有统计学意义。其中,丙泊酚+电休克组比电休克组增多(P<0.05);丙泊酚+电休克组和电休克组较抑郁组和对照组增多(P<0.05);抑郁组比对照组低(P<0.05)。 见表3。
3 讨论
CUMS是目前常用且可靠的经典啮齿类动物抑郁模型建模方法[8]。本实验结果显示,电休克治疗后的CUMS模型大鼠SPP显著提升,提示电休克具有明显的抗抑郁作用,但丙泊酚不加强电休克的抗抑郁疗效。在学习、记忆能力方面,Morris水迷宫实验结果提示抑郁模型大鼠的认知功能相较于对照组正常大鼠有所下降,经过电休克治疗的抑郁大鼠学习、记忆能力比抑郁大鼠进一步下降,而经过MECT的大鼠(丙泊酚+电休克)相较单纯电休克大鼠学习、记忆损伤明显减轻。既往研究显示单独使用丙泊酚对抑郁模型大鼠的抑郁样行为与认知功能皆无显著影响[9-10]。因此本研究针对丙泊酚作为特异性GABAAR激动剂能够改善电休克造成的学习、记忆损伤这一现象,以GABA能神经元为切入点展开研究。

表2 Morris水迷宫实验结果
多项临床研究提示GABA能神经元功能障碍与多种神经退行性疾病的发生发展密切相关[11]。抑郁症是最常见的精神疾病之一,有研究发现抑郁症患者血浆与脑脊液GABA水平显著低于正常对照[12-13]。在认知功能方面,脑内GABA水平下降可造成认知功能受损与记忆障碍[6,11,14]。另一方面,在哺乳动物中枢神经系统内,GABAAR是GABA的主要受体,也是临床上镇静、催眠、抗惊厥药物的药理学分子靶点[15]。其亚单位α5主要分布在海马等脑区中,占海马GABAAR的近25%[16-17]。海马是学习、记忆发生的关键脑区,海马特别是CA1区在应激时极易受损而发生突触可塑性变化,进而影响学习、记忆功能[17]。因此,基于α5亚基独特的脑分布,本研究通过Western blot检测海马GABAARα5含量并重点观察其在海马CA1区的表达。
本研究发现,相较于正常大鼠,抑郁大鼠的GABA和GABAARα5都呈现出低表达的状态,并且空间学习记忆能力相对低下,这提示GABA能神经元低活性对情绪与认知功能均可产生影响。电休克显著提高抑郁大鼠GABA和GABAARα5的表达水平,改善大鼠抑郁状态。近期也有关于电休克提高精神分裂症患者内侧前额叶皮质GABA浓度的研究报道[18]。但是Morris水迷宫结果显示,电休克造成大鼠空间学习、记忆损伤。丙泊酚是GABAAR特异性激动剂[19]。多项研究发现丙泊酚能够改善电休克造成的学习、记忆损伤[7,9,20]。本研究证明丙泊酚联合电休克能显著提高电休克抑郁大鼠GABAARα5的表达,其海马GABA浓度相较电休克大鼠有所下降,这一现象可能是由于丙泊酚特异性激动GABAAR,促进GABA与其受体结合,从而导致GABA水平相对下降。

图1 各组大鼠海马组织的GABAARα5蛋白表达水平(Western-blot法)

图2 各组大鼠海马组织GABAARα5表达水平(免疫组化法)
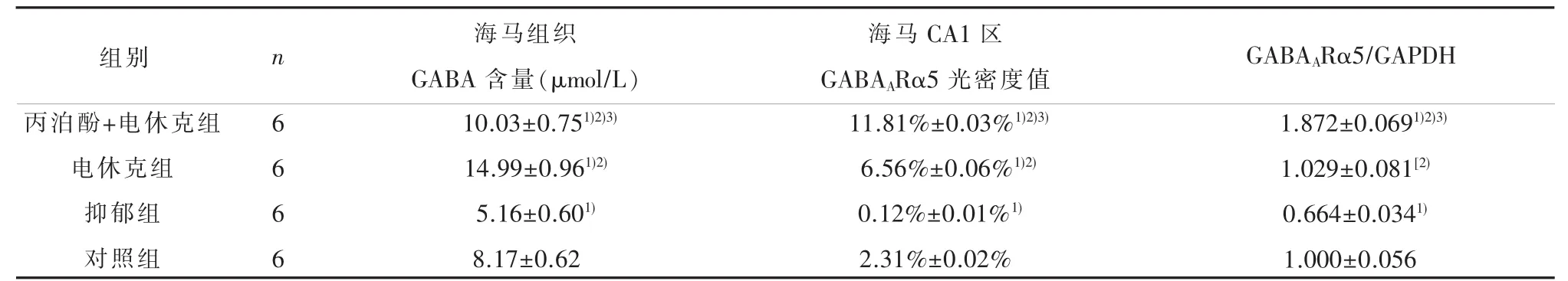
表3 各组大鼠海马组织GABA含量和GABAARα5蛋白表达量
本研究观察到电休克提高海马GABAARα5的表达,表现为损伤记忆功能,丙泊酚联合电休克进一步提高GABAARα5表达却表现为保护学习记忆。这似乎使得GABAARα5在其中的作用变得难以解释。此时需要考虑与认知功能紧密相关的另一神经元受体——N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)。 有研究表明电休克产生脑损伤的原因是电刺激过程中过度激活神经元NMDAR而产生兴奋性神经毒性,电刺激结束后NMDAR功能下降,使得后续长时程增强(long-term potentiation,LTP)难以被诱导[21-22]。LTP是学习、记忆能力的主要分子机制之一,LTP受损可导致学习和记忆功能受损[22]。多项研究证实丙泊酚能抑制NMDAR相关通路[23-24]。GABAAR是抑制性神经元递质受体,丙泊酚可通过激动GABAAR增强GABA介导的神经抑制[25]。所以MECT中丙泊酚发挥学习、记忆保护的功能,可能是通过增强GABA能神经元抑制,减轻电休克造成的NMDAR过度激活而起作用。
综上所述,丙泊酚实现抑郁模型大鼠电休克后的脑保护作用,可能是通过上调GABA能神经元相关受体的表达,增强其抑制效应实现的。本研究的局限性在于只检测GABA能神经元相关通路的分子表达,后续研究将完善NMDAR和LTP的相关检测,进一步探讨丙泊酚保护电休克后认知功能损伤的作用机制。

