自噬调节高浓度葡萄糖诱导的人晶状体上皮细胞上皮间质转化
马济远,叶 巍,李 吉,裴 瑞,何梦梅,苏静波,孙董洁,周其武,周 健
目的:探究自噬水平变化对高糖诱导人晶状体上皮细胞上皮间质转化(EMT)的影响及其机制。
方法:人晶状体上皮细胞(HLE-B3)分为正常对照组(NC组)和高糖处理组(HG组),分别用含5.5mmol/L葡萄糖的DMEM和添加了30mmol/L葡萄糖的上述DMEM培养12、24、48h,用Western blot检测上皮间质转化标志蛋白(E-cadherin、α-SMA)和自噬标志蛋白(LC3、Beclin 1和SQSTM1/p62)的表达变化,用划痕实验观察细胞的移行能力以明确高糖对晶状体上皮细胞自噬和EMT的影响。利用雷帕霉素调节自噬水平,将细胞分为正常对照组(NC组)、高糖处理组(HG组),高糖处理细胞的同时添加DMSO溶剂组(DMSO组)和添加200nmol/L雷帕霉素的雷帕霉素组(RAPA组),处理细胞24h,用Transwell实验观察细胞的移行能力,用Western blot检测EMT、自噬标志蛋白和TGF-β信号通路蛋白(TGF-β2、Smad2/3、p-Smad2/3、Snail)的表达。用细胞免疫荧光染色观察SQSTM1/p62与Smad2/3在细胞内的表达,免疫共沉淀方法检测细胞中SQSTM1/p62与Smad2/3之间的相互结合。
结果:在高糖刺激后12、24、48h,HG组细胞E-cadherin、LC3 Ⅱ/Ⅰ和Beclin 1蛋白表达逐渐降低(F=67.52、163、206,均P<0.0001),而α-SMA、SQSTM1/p62蛋白表达增加(F=53.37、302.1,均P<0.0001),细胞移行也较NC组增加(均P<0.001),提示高糖刺激后细胞发生EMT,而自噬水平降低;雷帕霉素处理后,与HG组和DMSO组相比,RAPA组LC3 Ⅱ/Ⅰ和E-cadherin蛋白表达水平增加,α-SMA、p-Smad2/Smad2、p-Smad3/Smad3及Snail蛋白表达降低(均P<0.05),TGF-β2表达无明显改变(均P>0.05),细胞移行被抑制(均P<0.001),提示雷帕霉素在提高自噬水平的同时下调了TGF-β信号通路分子的表达进而抑制了EMT。细胞免疫荧光染色结果显示SQSTM1/p62与Smad2/3在胞浆内存在共定位,免疫共沉淀实验证实了SQSTM1/p62与Smad2/3蛋白相互结合。
结论:高糖可刺激HLE-B3细胞发生EMT,下调细胞的自噬水平;自噬通过SQSTM1/p62与Smad2/3相互作用,改变了TGF-β信号通路中Smad2/3的表达,实现对EMT的调节。
0 引言
白内障是糖尿病患者的眼部常见并发症之一,其患白内障的风险是普通人的2~5倍,且发生的年龄更早[1]、原因复杂,上皮间质转化(epithelial-mesenchymal transition,EMT)在糖尿病白内障的形成中起了重要作用[2-4]。自噬(autophagy)是一种维持细胞稳态,调节细胞信号传导和促进细胞存活的基本细胞降解机制[5]。越来越多的研究表明自噬与EMT之间密切相关[6],一方面,细胞依赖自噬激活后发生EMT而在受到外界刺激后得以存活,如在心肌细胞H9c2缺氧/复氧模型中发现高迁移率族1蛋白1(high mobility group box 1,HMGB1)通过增加盘状结构域受体1(discoidin domain receptor 1,DDR1)的表达和抑制由哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的磷酸化激活的自噬而诱导细胞发生EMT[7];与此相反,另一方面自噬还有抑制肿瘤信号的作用,这阻碍了EMT过程,如沉默自噬相关蛋白Beclin 1和ATG7的表达可使胶质母细胞瘤细胞中调节EMT的转录因子Snail和Slug的表达增高,从而增强这种细胞的EMT过程;然而,当用饥饿和mTOR抑制剂激活细胞自噬时,细胞迁移和侵袭能力却减弱[8]。
目前,对高浓度葡萄糖(简称高糖)刺激后人晶状体上皮细胞(human lens epithelial cell,HLEC)中自噬水平的变化情况,以及干预自噬后对EMT影响的相关研究还少有报道。本研究观察了高糖环境下人晶状体上皮细胞的自噬和EMT水平的变化,并观察用自噬激动剂雷帕霉素改变自噬水平后对晶状体上皮细胞EMT的影响,探讨自噬对EMT的调节作用及机制。
1 材料和方法
1.1材料
1.1.1细胞 永生化人晶状体上皮细胞系HLE-B3获自北京眼科研究所张伟教授馈赠。HLE-B3细胞交由北京擎科新业生物技术有限公司进行细胞系短串联重复序列(short tandem repeat,STR)鉴定,结果与收录在DSMZ数据库的SRA01/04细胞系完全匹配,SRA01/04细胞系为人类晶状体上皮细胞系,结果可证明本研究所用HLE-B3细胞为晶状体上皮细胞。
1.1.2试剂 雷帕霉素(rapamycin)购自美国Med Chem Express公司;蛋白酶抑制剂(No.539131)、磷酸酶抑制剂(No.524629)以及TGF-β2抗体(No.AEB586)均购自美国EMD Millipore公司;LC3(No.12741)、E-cadherin(No.14472)、Smad2/3(No.8685)、p-Smad2(No.3108)、p-Smad3(No.9520)以及Snail(No.3879)抗体均购自美国Cell Signaling Technology公司;α-SMA(No.ab5694)、SQSTM1/p62(No.ab56416)以及Beclin 1(No.ab62557)抗体均购自美国Abcam公司;GAPDH(No.60004-1-Ig)抗体、HRP标记山羊抗兔IgG抗体以及HRP标记山羊抗小鼠IgG抗体均购自中国武汉三鹰公司;Alexa Fluor 594标记的驴抗兔IgG抗体和Alexa Fluor 488标记的驴抗小鼠IgG抗体均购自上海翊圣生物科技有限公司;含DAPI的抗荧光淬灭封片剂购自西安赫特生物科技有限公司;BCA蛋白定量试剂盒、SDS-PAGE凝胶配制试剂盒以及IP裂解液均购自中国上海碧云天公司;ECL化学发光检测试剂盒购自中国北京ZETA公司;protein A/G磁珠购自美国赛默飞世尔科技公司。
1.1.3仪器设备 Transwell小室(Millipore公司,美国),SDS-PAGE电泳仪、电泳槽及化学发光仪(Bio-Rad公司,美国),倒置显微镜(Olympus公司,日本),共聚焦显微镜(Olympus公司,日本)
1.2方法
1.2.1细胞培养及分组 HLE-B3细胞培养在添加了10%胎牛血清和1%青霉素/链霉素的低浓度葡萄糖(5.5mmol/L)杜氏培养基(DMEM)中,并置于37℃的5% CO2培养箱内,每2d更换1次培养基,细胞达到80%~90%融合度后进行传代。在细胞长至密度约为70%后,转移至无血清培养基中饥饿2h后,高糖处理组(HG组)细胞更换添加了30mmol/L葡萄糖的DMEM(总葡萄糖浓度35.5mmol/L)中培养,而正常对照组(NC组)细胞仍用上述低浓度葡萄糖DMEM培养基培养。分别在高糖处理前(0h)、处理后12、24、48h 观察自噬和EMT相关指标。在200nmol/L雷帕霉素干预高糖处理的HLE-B3细胞实验中,将细胞分为4组,在原有的NC组和HG组基础上,增加雷帕霉素组(RAPA组)和溶剂组(DMSO组),即在高糖处理细胞的同时,用200nmol/L雷帕霉素和其等量的溶剂DMSO分别处理细胞24h,并观察相关指标。
1.2.2 Western blot实验 经过处理的HLE-B3细胞,在弃去培养液之后用PBS清洗3遍,再加入1mL PBS并使用细胞刮刀刮取细胞,将含有细胞的PBS转移至EP管中,在5000r/min转速下离心5min,弃去上清液后加入配置好的含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液120μL,经过充分裂解和超声粉碎后于4℃、12000r/min离心15min,吸取上清液。取20μL蛋白样品用BCA法测定蛋白浓度。在剩余的100μL蛋白提取液中加入25μL 5×上样缓冲液,于100℃金属浴中加热10min,冷却到室温。向电泳槽内加入电泳缓冲液,根据测定的蛋白浓度从每个样本取30μg蛋白,上样到配置好的8%或15%的SDS-PAGE胶加样孔内,在Bio-Rad标准电泳装置上进行电泳蛋白分离,再将分离的蛋白使用Bio-Rad标准湿式转膜装置冰浴下转移至PVDF膜上。剩余的变性后蛋白置于-20℃冰箱中保存。在室温下用5%脱脂牛奶封闭PVDF膜3h,4℃下孵育相应的一抗(稀释浓度均为1∶1000)过夜。TBST漂洗PVDF膜3次,每次5min。再使用相应的辣根过氧化物酶标记的二抗(稀释浓度均为1∶3000)37℃孵育1h,TBST漂洗PVDF膜3次,每次5min。配置化学发光显色液(A液∶B液=1∶1),在Bio-Rad化学发光仪下进行化学发光显影,并获得图像。使用Image J软件对相应条带灰度值进行测量。
1.2.3划痕实验 将细胞接种于6孔板中培养,确保过夜后细胞100%融合。次日使用1mL移液枪枪头在6孔板内笔直划线,形成一条划痕(原始划痕),然后用PBS清洗3次,洗去脱落的细胞。将划痕处理后的细胞分别置于常规DMEM培养基(NC组)和含高糖的DMEM培养基(HG组)中培养,分别在0、12、24、48h于倒置显微镜下观察并拍照划痕(新划痕)变化情况,每组随机挑选3个视野。用Image J软件标记图片中划痕范围并计算划痕的面积。细胞迁移百分比(%)=(原始划痕面积-新的划痕面积)/原始划痕面积×100%。
1.2.4 Transwell实验 将200μL HLE-B3细胞悬液接种于Transwell小室的上室(1×104/孔),下室根据分组(NC组、HG组、DMSO组、RAPA组)分别添加相应的培养基500μL,在培养箱中培养24h。将小室置于4%多聚甲醛中固定0.5h,小心拭去上室细胞,将小室用结晶紫染色15min。用PBS洗3次后在倒置显微镜下观察细胞数量,随机取5个视野拍照并计数。
1.2.5 细胞免疫荧光染色 将正常培养的HLE-B3细胞接种于放置细胞爬片的12孔板内,培养24h,待细胞长至70%时,吸除培养基,加入PBS浸洗细胞3次,每次5min。向孔内加入4%多聚甲醛1mL固定细胞30min后,吸去多聚甲醛,用PBS洗3次,每次5min。然后向孔内加入含有1% Tritonx-100和1% BSA的PBS室温放置2h后吸去孔内液体,加入Smad2/3和SQSTM1/p62一抗稀释液(稀释浓度均为1∶100)4℃湿盒内孵育过夜。次日先吸去一抗稀释液,用PBS漂洗3次,每次5min,再滴加Alexa Fluor 594标记的驴抗兔IgG抗体(1∶100)和Alexa Fluor 488标记的驴抗小鼠IgG抗体(1∶100),在室温下避光孵育2h后用PBS洗3次,每次5min。将含DAPI(0.4μg/mL)的封片剂滴于载玻片上,取出细胞爬片,将有细胞面向着载玻片方向贴于载玻片上。在激光共聚焦显微镜下观察并照相。
1.2.6免疫共沉淀实验 经过分组处理后的HLE-B3细胞,在弃去培养液后用PBS清洗3遍,加入1mL PBS,使用细胞刮刀刮取细胞,将含有细胞的PBS转移至EP管中,在5000r/min转速下离心5min,弃去上清后加入含蛋白酶抑制剂的IP裂解液1mL,轻轻吹悬后置于4℃裂解1h。在12000r/min下离心30min后取上清液,取20μL用于BCA蛋白定量,取50μL加入2×上样缓冲液50μL,100℃金属浴中加热10min作为Input样品。在其余细胞裂解液加入5μL p62抗体,4℃摇床上缓慢摇晃过夜。在上述混合液中加入protein A/G磁珠20μL,经孵育4h后将样品置于磁力架轻轻颠倒10次,此时含有IP的分子及其结合的蛋白的磁珠被吸附在EP管壁上。弃去上清液,再加入IP裂解液轻轻颠倒10次,重复3遍,弃去上清,在含磁珠的EP管中加入2×上样缓冲液50μL,充分震荡混匀后于100℃金属浴中加热10min,即为IP样品。根据测定的蛋白浓度从每个Input样品中取30μg蛋白上样,根据一次Western blot预实验结果调整正式IP时的上样量,保证每个组免疫沉淀物中的SQSTM1/p62的量基本一致。

2 结果
2.1高糖促进晶状体上皮细胞发生EMT Western blot结果显示,随着高糖刺激时间(0~48h)的延长,HLE-B3细胞的上皮细胞标志蛋白E-cadherin表达量逐渐降低(F=67.52,P<0.0001),而间充质细胞标志蛋白α-SMA表达量逐渐升高(F=53.37,P<0.0001),而且各时间点与高糖处理前(0h)相比,E-cadherin和α-SMA表达量均有显著性差异(P12h=0.015、0.033;P24h=0.0003、0.0006;均P48h<0.0001;图1A~C,表1)。同时,划痕实验结果显示,高糖处理12、24、48h时,划痕面积较NC组明显缩小,HG组细胞迁移百分比均比NC组高,差异均有统计学意义(P<0.001,图1D、E,表2),提示高糖刺激增强了细胞的移行能力,这与Western blot结果相一致。以上结果提示晶状体上皮细胞在高糖培养环境下发生了EMT。
2.2高糖抑制HLE-B3细胞内自噬水平 为探究高糖环境下细胞自噬水平的变化,我们检测了高糖处理HLE-B3细胞0~48h自噬标志蛋白水平的变化。LC3、Beclin 1和SQSTM1/p62是参与自噬过程的重要蛋白,LC3参与自噬体溶酶体膜的延伸[9];Beclin 1在自噬的起始阶段发挥重要作用;SQSTM1/p62结合泛素化蛋白后与LC3形成复合物,最终在溶酶体内降解[10]。Western blot结果显示,随着高糖刺激时间的增加,细胞LC3 Ⅱ/Ⅰ和Beclin 1的表达量逐渐降低,而且在24h时达到最低,48h不再有明显改变(F=163、206,均P<0.0001,图2A~C,表3);而SQSTM1/p62的表达量随着时间的延长逐渐增加(F=302.1,P<0.0001,图2A、D,表3)。
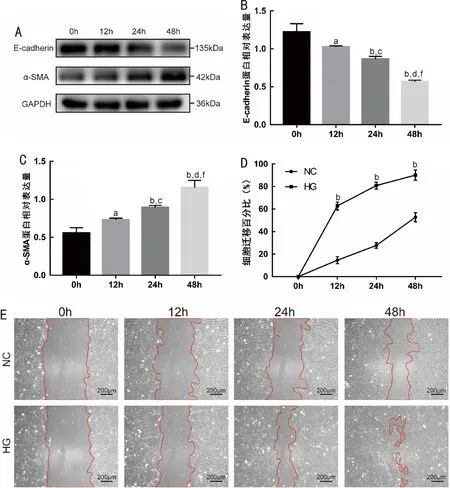
图1 HLE-B3细胞在高糖环境下发生EMT A:Western blot检测高糖刺激HLE-B3细胞48h后EMT标志蛋白E-cadherin和α-SMA的表达;B~C:E-cadherin和α-SMA的表达量化分析(aP<0.05,bP<0.01vs0h;cP<0.05,dP<0.01vs12h;fP<0.01vs24h);D:细胞划痕实验检测细胞迁移百分比的量化分析(bP<0.01vsNC组);E:细胞划痕实验结果(×100)。


培养时间E-cadherinα-SMA0h1.22±0.110.56±0.0712h1.03±0.01a0.73±0.02a24h0.87±0.03a,c0.90±0.03a,c48h0.57±0.02a,c,e1.16±0.09a,c,e F67.5253.37P<0.0001<0.0001
注:aP<0.05vs0h;cP<0.05vs12h;eP<0.05vs24h。


组别0h12h24h48hNC组014.63±3.1327.69±2.5252.75±4.00HG组062.76±3.51b80.84±3.06b90.17±4.51b t-17.7123.2610.75P-<0.0001<0.00010.0004
注:F时间=698.8,P时间<0.0001;F组间=72.95,P组间=0.001;F组间×时间=12.87,P组间×时间=0.0005。bP<0.01vsNC组。
2.3上调HLE-B3细胞的自噬水平可抑制高糖诱导的EMT 为了探讨自噬对HLE-B3细胞发生EMT的调节作用,我们使用自噬激动剂雷帕霉素(200nmol/L)对高糖刺激的HLE-B3细胞处理24h,用Western blot检测HLE-B3细胞自噬和EMT标志蛋白的表达变化。结果表明,与NC组相比,HG组HLE-B3细胞LC3 Ⅱ/Ⅰ及E-cadherin蛋白表达降低(P=0.0042、0.0001),而α-SMA蛋白表达增加(P<0.0001),这与2.1部分的结果一致;RAPA组与HG组、DMSO组相比,LC3 Ⅱ/Ⅰ、E-cadherin蛋白表达水平有所提高(P<0.0001、=0.0087;P<0.0001、=0.0245),α-SMA蛋白表达水平有所降低(P=0.0001、<0.0001),但与NC组相比差异有统计学意义(P=0.0051、0.0136、<0.0001),DMSO组与HG组相比差异无统计学意义(P=0.9997、0.8625、0.7128),见图3A~D,表4,提示雷帕霉素可逆转高糖引起的自噬水平降低及EMT增强的变化。Transwell实验结果表明,与NC组相比,HG组和DMSO组细胞的移行数量显著增加(均P<0.0001),提示高糖促进了HLE-B3细胞的移行,而RAPA组细胞的移行数量明显低于HG组和DMSO组(P=0.0002、0.0004),但仍高于NC组(P=0.0021),提示雷帕霉素对高糖诱导的细胞移行有所抑制,与Western Blot结果相一致(图3E、F,表4)。

图2 HLE-B3细胞在高糖环境下自噬水平下降 A:Western blot检测高糖刺激HLE-B3细胞48h自噬标志蛋白LC3、Beclin 1、SQSTM1/p62的表达变化;B~D:LC3、Beclin 1、SQSTM1/p62蛋白表达的量化分析(bP<0.01vs0h;dP<0.01vs12h;fP<0.01vs24h)。


培养时间LC3Ⅱ/ⅠBeclin 1SQSTM1/p620h1.65±0.051.13±0.050.24±0.0312h1.17±0.06b0.75±0.02b0.66±0.03b24h0.62±0.07b,d0.49±0.05b,d0.81±0.02b,d48h0.66±0.07b,d0.43±0.03b,d0.99±0.04b,d,fF163206302.1P<0.0001<0.0001<0.0001
注:bP<0.01vs0h;dP<0.01vs12h;fP<0.01vs24h。
2.4上调HLE-B3的自噬水平可抑制TGF-β信号通路 既往研究表明,晶状体上皮细胞在高糖培养下,细胞TGF-β信号通路被激活,表现为分泌型TGF-β和Smad2/3磷酸化蛋白水平升高[3,11-13]。TGF-β信号通路是细胞发生EMT的经典通路,自噬可能通过影响TGF-β信号通路而影响EMT。因此我们检测了雷帕霉素对高糖刺激的HLE-B3细胞中TGF-β2、Smad2/3、p-Smad2/3及Snail蛋白水平的影响。Western blot结果显示,与NC组相比,高糖刺激(HG组、DMSO组)细胞中TGF-β2(P=0.0044、0.008)、p-Smad2/Smad2(均P<0.0001)、p-Smad3/Smad3(均P<0.0001)及Snail(均P<0.0001)蛋白水平均有所升高;加入雷帕霉素处理后,相较高糖刺激(HG组、DMSO组)细胞,TGF-β2表达无明显改变(P=0.8142、0.5504,图4A、B,表5),但p-Smad2/Smad2(P=0.0015、0.0001)、p-Smad3/Smad3(P=0.0111、0.0042)以及Snail(P=0.0042、0.0016)的表达量明显降低(图4A、C~E,表5);但相较NC组,这些指标仍有比较明显的升高(P<0.0001、=0.0018、0.0131,表5)。以上结果表明上调细胞自噬水平可部分抑制高糖激活的由TGF-β2介导的EMT信号通路。
2.5自噬通过SQSTM1/p62与Smad2/3相互作用实现对EMT的调节 为了探究自噬信号通路与TGF-β信号通路之间的串扰,我们观察了SQSTM1/p62与Smad2/3之间的直接交互作用。首先,通过细胞免疫荧光染色观察两者的胞内分布情况,发现SQSTM1/p62与Smad2/3均位于细胞质,并存在共定位的情况(图5A)。
对不同处理的HLE-B3细胞进行了SQSTM1/p62的免疫共沉淀实验,Input部分结果表明,Smad2/3与SQSTM1/p62在各处理组细胞中均存在,且Smad2/3和SQSTM1/p62在HG组表达高于NC组,而RAPA组与HG组、DMSO组相比,SQSTM1/p62表达有所降低(图5B,Input),证实雷帕霉素可以激活细胞的自噬,同时细胞中存在SQSTM1/p62和Smad2/3蛋白表达(阳性对照)。在用SQSTM1/p62抗体进行免疫共沉淀的蛋白复合物中,通过Western blot检测到SQSTM1/p62和Smad2/3蛋白,表明SQSTM1/p62与Smad2/3存在相互作用,而且在SQSTM1/p62表达量基本一致的情况下,与NC组相比,HG组结合的Smad2/3更少,RAPA组与HG组相比有所增加,提示高糖可能抑制了SQSTM1/p62和Smad2/3的结合,而雷帕霉素部分逆转了这一现象(图5B,IP)。
3 讨论
白内障是糖尿病患者视力损害的主要原因之一[14]。白内障摘除术仍是目前唯一有效的治疗方法[15]。与非糖尿病患者相比,糖尿病患者出现手术并发症风险较高,如囊膜收缩和混浊、黄斑水肿和糖尿病视网膜病变加重等[16]。所以,研究药物防治糖尿病白内障很有必要。人们对糖尿病白内障发病机理的探索从未停止,陈文静等[17]发现高糖可以抑制HLE-B3细胞葡萄糖关键代谢酶(6-磷酸果糖激酶-1、丙酮酸激酶、己糖激酶、柠檬酸合成酶、α-酮戊二酸脱氢酶、6-磷酸葡萄糖脱氢酶)的表达,从而诱导细胞凋亡。本研究采用高糖刺激HLE-B3细胞以模拟糖尿病患者中晶状体上皮细胞的生存状态,观察晶状体上皮细胞EMT及自噬水平的改变,并通过雷帕霉素干预自噬水平,观察对细胞发生EMT的影响,探讨自噬对晶状体上皮细胞EMT的调节作用及其机制。

图3 雷帕霉素增强细胞自噬并抑制高糖诱导的HLE-B3细胞发生EMT A:Western blot检测雷帕霉素对高糖刺激HLE-B3细胞自噬和EMT标志蛋白LC3、E-cadherin和α-SMA表达的影响;B~D:LC3、E-cadherin和α-SMA蛋白表达的量化分析;E:Transwell实验中细胞迁移数量的量化分析;F:Transwell实验结果(×200)。aP<0.05,bP<0.01vsNC;dP<0.01vsHG;eP<0.05,fP<0.01vsDMSO。


组别LC3 Ⅱ/ⅠE-cadherinα-SMA迁移细胞数(个)NC组1.61±0.101.16±0.120.45±0.0526.67±3.06HG组1.16±0.10a0.60±0.05a1.16±0.04a79.33±7.37aDMSO组1.17±0.08a0.65±0.04a1.21±0.05a77.00±2.65aRAPA组2.04±0.14a,c,e0.89±0.08a,c,e0.81±0.06a,c,e49.33±4.04a,c,e F45.5231.41157.283.26P<0.0001<0.0001<0.0001<0.0001
注:aP<0.05vsNC组;cP<0.05vsHG组;eP<0.05vsDMSO组。
细胞发生EMT的标志是失去粘附连接和细胞极性,获得间充质表型及获得运动性和侵袭性[18],表现在上皮标志物E-cadherin、ZO-1的下调以及间充质标志物N-cadherin、α-SMA、Fibronectin、Vimentin等的上调。本课题组前期实验已证明高糖可通过c-Src/TGF-β信号途径诱导人晶状体上皮细胞发生EMT[4]。Zhang等[2]观察到在白内障患者中,晶状体上皮细胞E-cadherin较正常人表达减少,而间充质细胞标志物α-SMA和Vimentin表达增加,表明EMT是糖尿病白内障患者晶状体上皮细胞中的重要事件。本研究发现,随着高糖刺激时间的延长,HLE-B3细胞内E-cadherin表达量逐渐下调,而α-SMA表达量上调;细胞划痕实验提示HLE-B3细胞在高糖环境下获得了更强的移行能力,证实高糖刺激晶状体上皮细胞发生了EMT。
自噬是一种进化保守的分解代谢过程,通过形成双层膜的自噬体,将细胞质内的大分子和细胞器等传递至溶酶体进行降解,实现再利用。根据底物进入溶酶体途径的不同,可将自噬分为分子伴侣介导的自噬(chaperone-mediated autophagy)、微自噬(microautophagy)和巨自噬(macroautophagy),其中研究的最为透彻是巨自噬。巨自噬受多种信号途径的调控,mTOR是自噬的主要调控因子,其驱动主要的抑制信号[19],既往研究已经发现雷帕霉素—mTORC1的抑制剂,具有促进自噬的作用[20]。LC3被称为微管相关蛋白1轻链3(MAP1LC3),是公认的自噬标志物。LC3 Ⅰ被Atg7和Atg3相关的泛素样系统修饰和处理,与磷脂酰乙醇胺结合形成LC3 Ⅱ[21]。通常用LC3 Ⅱ与LC3 Ⅰ的比值表示细胞自噬水平的高低,比值高代表细胞内自噬水平高。Beclin 1作为自噬复合体的重要组成部分,在自噬活性发挥关键作用[22],其表达水平与自噬活性呈正相关。作为重要的选择性自噬接头蛋白,SQSTM1/p62在自噬清除泛素化蛋白过程中作为受体参与其中,其表达量与自噬水平呈负相关[23]。本研究中,高糖处理的HLE-B3细胞LC3 Ⅱ/Ⅰ和Beclin 1随着时间的推移明显降低,并在24h后维持在较低水平;而SQSTM1/p62随着时间的延长表达明显增加。结果表明,高糖抑制了HLE-B3细胞的自噬。
糖尿病对不同细胞自噬水平的影响似乎不尽相同,但最终对细胞EMT可产生类似的影响。Zhuang等[24]发现糖尿病肾病中肾小管上皮细胞自噬受到抑制,抑制血清和糖皮质激素诱导激酶1(serum and glucocorticoid induced kinase,SGK1)可通过PI3K/AKT/mTOR通路促进肾小管上皮细胞自噬和抑制EMT,Jin等[25]研究表明HMGB1通过诱导足细胞自噬参与糖尿病肾病的发展,HMGB1 siRNA联合雷帕霉素可通过抑制AKT/mTOR和TGF-β/Smad信号通路防止足细胞凋亡和EMT进展。既往有关晶状体上皮细胞的研究表明,在用TGF-β诱导的后囊膜混浊细胞模型中,使用mTOR抑制剂PP242或者靶向mTOR的siRNA可提高细胞的自噬水平,进而抑制晶状体上皮细胞的增殖和迁移[26-27]。本研究结果显示,雷帕霉素提高了高糖环境下细胞的自噬水平,部分抑制了高糖诱导的HLE-B3细胞发生的EMT。

图4 雷帕霉素抑制高糖激活的HLE-B3细胞中TGF-β信号通路 A:Western blot检测雷帕霉素对高糖刺激HLE-B3细胞中TGF-β2、Smad2/3、p-Smad2/3、Snail的蛋白表达的影响;B~E:TGF-β2、Smad2/3、p-Smad2/3、Snail的蛋白表达的量化分析(aP<0.05,bP<0.01vsNC;cP<0.05,dP<0.01vsHG;fP<0.01vsDMSO)。

图5 HLE-B3细胞中SQSTM1/p62与Smad2/3蛋白之间的相互作用 A:细胞免疫荧光染色结果,红色为Smad2/3,绿色为SQSTM1/p62,蓝色为细胞核,白色箭头所示为黄色,即Smad2/3与SQSTM1/p62共定位所在(×60);B:免疫共沉淀实验结果,Input为阳性对照,Western blot检测各组细胞均可表达Smad2/3与SQSTM1/p62蛋白;IP为实验组,用SQSTM1/p62抗体免疫共沉淀后,经Western blot检测蛋白复合物中SQSTM1/p62、Smad2/3的表达情况。


组别TGF-β2p-Smad2/Smad2p-Smad3/Smad3SnailNC组0.84±0.090.35±0.050.59±0.030.59±0.03HG组1.10±0.04a0.98±0.03a1.00±0.06a1.12±0.10aDMSO组1.07±0.05a1.08±0.06a1.03±0.06a1.15±0.06aRAPA组1.14±0.07a0.77±0.04a,c,e0.82±0.04a,c,e0.81±0.05a,c,e F14.05159.149.8651.93P0.0015<0.0001<0.0001<0.0001
注:aP<0.05vsNC组;cP<0.05vsHG组;eP<0.05vsDMSO组。
为了探究雷帕霉素抑制HLE-B3细胞发生EMT的原因,我们检测了雷帕霉素对EMT的经典信号通路—TGF-β信号通路关键蛋白的影响。研究发现,在高糖刺激的HLE-B3细胞中TGF-β2、p-Smad2/3以及EMT关键转录因子Snail的表达增加。雷帕霉素处理后,TGF-β2表达未见明显改变,而p-Smad2/3以及Snail的表达受到了抑制。提示提高HLE-B3细胞的自噬水平可以抑制高糖激活的TGF-β信号通路,继而抑制细胞的EMT。那么自噬信号通路又是怎样与TGF-β信号通路产生串扰呢?研究结果表明,SQSTM1/p62与Smad2/3存在相互作用,在高糖环境中这种相互作用有所减弱,雷帕霉素处理后两者的结合增强。我们推测SQSTM1/p62作为自噬接头蛋白,与Smad2/3结合并介导了Smad2/3通过自噬而降解。高糖环境下,自噬受到抑制,Smad2/3得以累积,而雷帕霉素提高细胞自噬水平后,自噬对Smad2/3的降解增加,可能引起其中p-Smad2/3的量减少,Smad2/3下游分子Snail也受到抑制,从而抑制了高糖诱导HLE-B3细胞发生的EMT。
综上所述,晶状体上皮细胞HLE-B3在高糖刺激下发生EMT,同时自噬受到抑制;利用雷帕霉素提高细胞的自噬水平可以通过SQSTM1/p62与Smad2/3的相互作用下调p-Smad2/3的表达,从而抑制了TGF-β信号通路,起到抑制细胞EMT的作用,表明提高细胞自噬水平可能对高糖刺激的晶状体上皮细胞具有保护作用,这为未来从自噬角度研发糖尿病白内障的防治药物提供了理论依据。但本研究还存在一些局限性,目前的结果提示200nmol/L雷帕霉素可部分逆转高糖诱导的晶状体上皮细胞EMT,能否通过改变雷帕霉素的剂量达到完全逆转EMT的作用还有待进一步研究,此外,以上研究结果还有待在体内实验进行证实。
——雷帕霉素

