生物质燃烧和热解中钾的释放规律研究进展
王洋,董长青
(1中国华能集团有限公司生产环保部,北京100031;2华北电力大学可再生能源学院,北京102206)
相比化石燃料的不可再生、二氧化碳和污染物排放量大等特点,生物质由于其具有可再生性、二氧化碳中性排放及低污染物排放等优势[1],在电力和热力生产中引起了越来越大的关注。生物质作为能源资源,有其自身的特点。生物质在生成过程中,会吸收土壤中的一些无机营养元素参与其代谢过程,如K、Na、Ca、Mg、Cl、S、P、Si 等。与煤、石油、天然气等常规化石燃料相比,生物质中碱金属钾的含量很高,通常是灰分中含量第二高甚至最高的元素。表1 所示为几种生物质的灰分组成[2],不同生物质的灰分中钾的含量有所不同,但含量均较高,有的可以达到50%以上。钾在燃烧、热解和气化等热化学转化过程中会释放到炉内,造成积灰。积灰能降低锅炉的热效率,同时还会导致腐蚀等问题,影响锅炉的安全、经济运行。因此,探究生物质热化学转化过程中碱金属钾的释放,对于理解和解决由灰分造成的问题具有重要意义。生物质中碱金属钾的释放问题已经引起了包括丹麦、瑞典、挪威、芬兰、美国、中国、德国和澳大利亚等多个国家科学家的关注。
影响生物质中钾释放的因素,不仅包括钾在生物质中的含量,还包括钾的赋存形式。Miller 等[3-4]在1970 年代和1980 年代率先发明了化学分馏分析(CFA)方法,并将其运用于煤和生物质的分析。化学分馏分析方法的过程是用去离子水、乙酸铵溶液和稀盐酸依次清洗样品,并用电感耦合等离子发射光谱仪(ICP-OES)检测溶剂中各元素的含量,可依次得到可溶于水的、可溶于乙酸铵的、可溶于酸的及不可溶的各无机元素及含量。
Jenkins 等[5]、Zevenhoven[6]和Werkelin 等[7]分 别利用CFA 的方法探究了生物质等燃料中灰的组成元素的赋存形式,他们的研究结果都发现,生物质中的钾大部分能够溶于水或者有机溶剂乙酸铵。虽然关于利用CFA 方法对燃料中无机元素的定性和定量测量并没有一个明确的准则,但基于化学知识,一般认为能够溶于有机溶剂的钾为存在于有机物中的钾,而生物质中存在的无机钾大多能够溶于水。通过离子色谱和美蓝吸附分析阴离子和阴离子基团可知,KCl、K2SO4、KH2PO4和K2HPO4是无机钾的主要形式,其中KCl为生物质中K存在的最主要形式。
1 检测方法
对碱金属的释放进行定量测量,能够为研究碱金属的释放规律提供重要的信息和素材。然而,释放的测量结果对实验手段具有较高的依赖性,实验手段的准确性对于研究碱金属的释放规律具有重要的意义。目前,在这一领域中已经发展了多种实验手段,有的取得了良好的应用效果。根据其测量过程是否具有即时性,将这些方法分为在线检测方法和非在线检测方法两大类[8],具体分类情况如图1(a)和(b)所示。表2中所列为一些典型的碱金属释放的定量测量方法、原理及主要特征[8-29]。
如图1(a)所示,在线检测方法根据原理的不同,主要可以分为光谱学方法、电离作用方法和质谱学方法三大类。根据是否需要取样,在线检测方法还可分为在线取样检测和在线原位检测,其原理分别如图2(a)和(b)所示。在线原位检测即在碱金属的释放位点进行直接测量,因而不需要取样。光谱学方法是基于吸收光谱或发射光谱的方法。对于原子吸收光谱和自发荧光光谱来说,元素需要被光或热激发(或原子化)才能够被检测到,其中光学激发通常采用普通光源或激光来提供能量,而热激发通常采用火焰或等离子体。光学激发方法不需要取样,是在线原位检测,而热激发方法需要进行气体取样,是在线取样检测。非自发荧光光谱只能通过激光诱导产生,包括激光感生原子荧光(LIAF)、激光感生分子荧光(LIF)和光碎片化荧光(PFF)等方法,不需要取样,是在线原位检测。此外,电离作用方法(SI)和质谱学方法(MBMS)也被广泛应用在燃料的碱金属检测当中,这两类方法都属于在线取样检测。

表1 几种生物质的灰分组成[2]

表2 几种典型的碱金属定量检测方法

图1 碱金属释放的在线检测方法与非在线检测方法

图2 碱金属的定量检测原理图
如图1(b)所示,非在线检测方法通常对飞灰(冷凝或吸收燃烧过程中产生的气体)和底灰进行取样,并通过原子吸收光谱(AAS)或电感耦合等离子发射光谱(ICP-OES)进行分析。非在线检测方法的原理如图2(c)所示。非在线检测方法最大的优势是节约设备成本。然而,它的不足也非常明显。底灰或飞灰需要被人工收集并通过其他设备分析,增大了实验的工作量和实验误差。另外,非在线检测方法需要长达几小时的取样过程,却只能提供取样时间范围内的平均数值,而不能提供及时的释放信息,为研究不同阶段的释放规律带来了困难。尽管有这些不足,但非在线检测方法仍然能够为碱金属的释放规律研究提供大量的数据信息,其结果比较可信。
2 生物质燃烧和热解中钾的释放机理
固体燃料的燃烧通常可以分为3 个阶段:干燥、挥发分挥发和燃尽[30]。干燥过程发生在当燃料温度达到100℃左右时,这一阶段几乎没有灰的成分释放[24];挥发分挥发过程中,燃料颗粒被加热到更高的温度,大部分可燃物在热解和有机官能团分解的作用下被释放,同时释放出部分灰的组成成分;在燃尽阶段,燃料颗粒的温度可以达到800~1000℃,灰的成分继续得到释放。在本章讨论生物质燃烧过程中钾的释放机理时,将分别在挥发分挥发阶段和燃尽阶段进行讨论。这两个阶段是通过温度范围进行区分的,认为700℃以下为挥发分挥发阶段,700℃以上为燃烧和燃尽阶段。生物质热解过程中钾的释放机理也在挥发分挥发阶段一并讨论。
生物质燃烧和热解中钾的释放规律与生物质的种类密切相关。比如,木材中钾的释放规律就与稻草中截然不同。这是因为不同生物质中钾的含量、赋存形式以及与其他元素的关联均有所不同。此外,实验过程的参数如反应器类型、升温速率、颗粒大小以及气体流量等均对钾的释放规律有影响。
图3所示为几种不同生物质在热解或燃烧过程中钾的释放规律[31-35]。实验中从固定床反应器的两侧先后通入氮气和空气作为一次风和二次风来分别实现挥发分挥发和燃尽的实验条件。当炉内温度升至预设温度后,将盛有样品的坩埚推入炉内进行加热,根据计算,升温速率约为50℃/min。通过检测底灰中钾的含量并利用反平衡法计算钾的释放量,钾的释放比例Φ钾=(燃料中钾的含量-底灰中钾的含量)/燃料中钾的含量×100%。

图4 甘蔗渣和松木屑在不同反应器中快速热解或慢速热解下钾的释放规律[36-37]
升温速率对于钾的释放具有重要的影响,图4所示为甘蔗渣和松木屑在不同反应器、不同热解速率下钾的释放规律[36-37],其中样品1 和样品2 分别为甘蔗渣在流化床反应器中快速热解(热解速率大于1000℃/min)和在固定床反应器中慢速热解(热解速率10℃/min)条件下钾的释放规律;样品3、样品4和样品5分别为松木屑在金属丝网反应器中快速热解(热解速率1000℃/min)、在金属丝网反应器中慢速热解(热解速率1℃/min)和在热重分析仪中慢速热解(热解速率1℃/min)条件下钾的释放规律。
钾在生物质中的赋存与Cl 和S 的赋存密切相关,其释放规律也受Cl和S释放的影响。因此将生物质燃烧过程中Cl和S的释放规律进行了总结,如图5所示[31-35]。
2.1 挥发分挥发阶段钾的迁移和释放
如图3 和图4 所示,生物质燃烧过程中钾的释放主要发生在燃尽阶段,即温度高于700℃的阶段。对于不同生物质来说,在低升温速率或中等升温速率以下,生物质在热解或挥发分挥发阶段(温度低于700℃)中所释放的钾含量比较接近,均低于燃料中钾含量的20%。而在甘蔗渣的快速热解中(升温速率大于1000℃/min),当温度为500℃和600℃时钾的释放量仍较低,当温度升至700~900℃范围时,钾的释放大幅提高,达到燃料中钾含量的50%~60%。
同时,Cl和S的释放与钾的释放并不同步,有较大的差异。如图5(a)所示,对于木材和燕麦等Cl含量较低的生物质,Cl 的释放规律相似,均在500℃时已经达到较高的释放比例(高于70%)。而Cl 含量较高的大麦中Cl 的释放规律有所不同。当温度低于700℃时,大麦中Cl的释放明显低于木材和燕麦(约35%),当温度达到800℃时,其释放才达到类似的比例。这说明Cl 在挥发分挥发阶段的释放是有限制的,而限制的因素有可能是某些有机官能团的含量。在图5(b)中,不同种类的生物质中S的释放规律有所不同,但其在挥发分挥发阶段的释放比例均高于钾的释放比例。总而言之,尽管生物质中钾的赋存与Cl和S密切相关,但在挥发分挥发阶段,钾的释放与Cl和S的释放并不同步。

图5 几种生物质在燃烧过程中Cl和S的释放规律[31-35]
尽管钾在挥发分挥发阶段的释放非常少(低升温速率或中升温速率),但这一阶段内钾的赋存形式并未保持不变。前面提过,生物质中的钾以有机物和无机物的形式并存,而无机钾的主要存在形式为KCl和少量的K2SO4等。如图5(a)所示,对于木材来说,Cl 的释放主要发生在挥发分挥发阶段,而这一阶段钾的释放非常低,说明KCl中的钾在挥发分挥发阶段发生了转化,转移到了其他物质中从而继续留在生物质中没有被释放。Zintl 等[38]研究了KCl和不同生物高分子聚合物在200~700℃范围内的热解反应。他们认为,低温下Cl的释放源自KCl与有机物中侧链上的羧基官能团反应,释放出HCl并生成羧酸钾,如反应式(1)所示。利用分子束质谱(MBMS)的方法同样在生物质燃烧中发现了低温下HCl的生成[24]。在反应(1)的基础上,还有其他的猜想认为KCl能够与有机物反应,释放HCl并将钾固定在有机物中。Bridgewater[39]研究了KCl 与不同模型化合物之间的化学反应,并发现除了羧酸之外,酯基、乙缩荃、半缩醛和羟甲基等官能团均能够与KCl 反应并生成HCl,但他们的反应活性有所不同。另外,在挥发分挥发过程中,生成的有机钾能够互相转化,使反应更加复杂。

除了HCl 之外,CH3Cl 同样被发现是KCl 与有机物在挥发分挥发阶段反应的一种含Cl 产物。Hamilton 等[40]率先在生物质燃烧过程中发现了大量CH3Cl的生成,他们将其归因于生物质中木质素和果胶成分对Cl-的甲基化作用。Saleh 等[41]在稻草的热解实验中发现,当温度在250~500℃范围内时,燃料中Cl 的主要释放形式是CH3Cl。当温度为250℃时,几乎全部的Cl 都以CH3Cl 的形式释放,随着温度的增加,其他含Cl 产物如HCl 逐渐产生。Sailaukhanuly 等[42]证实,生物质中的果胶成分对于KCl 具有甲基化作用,进而生成CH3Cl。Czégény等[43]在木质素和聚氯乙烯(PVC,能够产生HCl)的热解实验中观测到了CH3Cl的生成,证明了木质素同样具有对Cl-的甲基化作用。热解反应中含Cl气体产物的平衡(HCl、CH3Cl 气体或含Cl 气体产物)受到反应条件如温度、升温速率等的影响,而这些都有待进一步研究。
总而言之,在挥发分挥发阶段,无论Cl 以怎样的形式被释放,大部分钾从KCl中转移到有机物中,以有机钾的形式存在,而不是被释放。小部分被释放的钾可能来自于有机钾在低温下的分解[44]。
2.2 钾的一次释放和二次反应
当温度上升至500℃以上后,有机钾开始逐渐分解。Wigmans等[45]和Hashimoto等[46]提出如式(2)和式(3)的分解机理,并证实了有机钾的存在形式为K-O-Char。式(2)和式(3)说明,有机钾的分解能够生成原子态的钾,同时生成有机物或释放CO2、CO等气体。有机钾还能够在H自由基等自由基的存在下被催化分解[47-49],释放出钾,如式(4)中所示。未被分解的有机钾可能继续以有机钾的形式存在,也可能转化为在850℃以下都比较稳定的K2CO3,但这一猜想还未被实验证实。
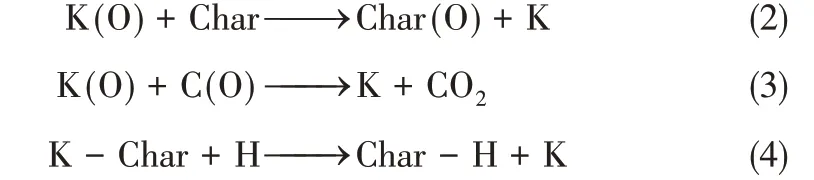
根据以上猜想,当温度达到500℃时,钾的释放量应该有明显的增加。然而,如图3所示,当温度在500~700℃时,所有生物质在中等升温速率下钾的释放量仍较低。这说明虽然有机钾在这一温度范围内发生了分解,但并未相应地伴随着钾的大量释放。Okuno 等[36]将此现象归因于一次释放的钾与燃料颗粒之间发生了二次反应,从而抑制了钾的释放。在他们的实验中,采用了能够利用He 气流来抑制二次反应的金属丝网反应器(WMR)来研究燃料颗粒热解过程中碱金属的一次释放。如图4所示,在样品4和样品5的对比中,同在1℃/min的低升温速率下热解,在热重分析仪中(TGA)热解的松木屑在900℃下释放的钾含量很低,而在WMR中热解的松木屑在温度达到600℃后钾的释放量显著增多,远高于同等条件下在TGA 中的释放量。这说明的确存在一次释放的钾与有机物间的二次反应,能够大幅度抑制钾的释放。比较图3中稻草在中等升温速率下的燃烧和热解,可以清晰地看到在500~700℃的范围内钾在燃烧和热解条件下的释放量相差无几,说明在此温度区间内,钾的释放主要来自于挥发分挥发(或热解)。Knudsen等[32-33]在固定床实验中也发现,不稳定的钾与燃料中的有机物发生了重复的吸附和脱附过程。
钾在燃料中的释放过程分为3个阶段:第一阶段,随着温度的升高,挥发分前体从颗粒中扩散而出,在此过程中部分挥发分前体与颗粒内的有机物发生反应从而转化为有机钾的形式;第二阶段,从颗粒中释放出的钾以挥发分的形式存在,并通过挥发继续释放;第三阶段,部分挥发分中的钾在挥发过程中与其他物质反应生成有机钾或矿物质钾。Saleh 等[41]认为,钾的整体释放速率由颗粒外的挥发而不是颗粒内的扩散控制,而挥发过程能够被自由基促进,如式(4)所示。
由以上分析可知,钾在500~700℃范围内的释放是挥发分挥发过程中的一部分。有机物分解释放出的原子态的钾(易与水蒸气反应生成KOH)可能是这一过程中钾的主要释放形式[45-49],然而一次释放的钾与生物质各种成分之间的二次反应抑制了钾的真正释放,并促使一次释放的钾转化为有机钾、矿物质钾等其他形式。因此,一次释放、二次反应和自由基的催化是影响钾释放过程的3个重要因素。挥发分挥发过程中一次释放的钾在二次反应中可能发生的反应路径有:①与HCl 反应生成KCl;②与含S物质反应生成K2SO4;③与Si、Al和Ti等无机元素反应生成矿物质,留在灰中;④通过嵌入反应或氧化反应生成K2CO3;⑤直接释放到空气中。
2.3 燃烧和燃尽阶段钾的释放
图3 和图4 说明,钾的释放主要发生在燃料的燃烧和燃尽阶段,其原因既可能是由于温度的升高(稻草在1100℃下热解释放的钾含量明显升高),也可能是由于氧气的参与(同等温度下燃烧比热解释放的钾多)。燃烧和燃尽阶段释放出的钾的含量和形式,很大程度上取决于钾在几种二次反应路径中的分布和二次反应路径之间的竞争。
(1)钾的释放量 如图3 所示,当温度高于700℃时,所有生物质中钾的释放均显著提高,尽管提高的程度有所不同[31-35]。燃料中Cl和Si的含量被认为对钾的释放具有重要的影响。对于两种木材山毛榉和云杉来说,二者的Cl 含量都很低,但在高温下山毛榉中钾的释放量明显高于云杉。这可能是因为云杉中Si 的含量较高,将部分钾固定在了灰中。Si对钾释放的抑制作用通过水稻和大麦燃烧中钾的释放也能得到佐证。水稻和大麦中Cl 的含量非常接近(水稻中为0.71%,大麦中为0.79%),但大麦中Si的含量(0.81%,质量分数,下同)不到水稻中Si 含量(1.7%)的一半,使得大麦在燃烧中释放了更多的钾。与Si 相反,Cl 被认为对钾的释放具有促进作用。大麦(0.81%) 和小麦(0.79%)中具有相近的Si 含量,而大麦中钾的释放明显高于小麦,因为大麦中的Cl 含量(0.79%)高于小麦中的Cl 含量(0.27%)。Si 对钾释放的抑制作用和Cl 对钾释放的促进作用在不同的温度范围内分别起主导作用,能够通过水稻和小麦中钾的释放反映出来。水稻中Si 和Cl 的含量分别约为小麦中的2 倍,其中Cl 对钾释放的促进作用在800℃以上开始起主导作用,当温度升至1200℃时,Si的抑制变成主导作用。因此,在水稻和小麦的燃烧中,当温度为800~1100℃时水稻中钾的释放高于小麦,当温度升至1200℃以上时水稻中钾的释放低于小麦。这样的结论是合理的,因为KCl 从800℃左右开始挥发,而硅酸盐在更高的温度才开始沉淀。Cl 对钾释放的促进作用和Si 对钾释放的抑制作用,分别证实了钾的二次反应中路径①和路径③的存在。
(2)钾的释放形式 当燃烧Cl 含量较高的生物质燃料时,Cl 在低温下不能全部释放,因而在700~800℃范围内钾的主要释放形式是KCl。Dayton等[21]利用分子束质谱(MBMS)研究了柳枝稷在固定床中燃烧时碱金属的释放规律,他们发现KCl是K的主要释放形式,且随着实验条件(温度、氧气和水蒸气浓度)的变化改变很小。Jensen 等[31]研究了稻草热解过程中K 和Cl 的转化及释放,同样发现在700~830℃范围内K 的主要释放形式是KCl。Johansen 等[50]在高Cl 生物质的燃烧和热解中发现,K 与Cl 的释放具有紧密的联系。在他们的研究中,高温下钾的释放量受到燃料中Cl 含量的限制。如前文所述,大部分Cl 已经在低温下被释放,所以高温下所释放出的KCl大部分来自于二次反应路径①中生成的KCl,以及少量燃料中在挥发分挥发过程中未完全挥发掉的KCl。
然而,KCl并不总是燃烧和燃尽阶段钾释放的最主要形式,尤其对于Cl含量较低的生物质来说。Knudsen 等[33]研究了一年生生物质在燃烧过程中钾的迁移和释放规律,且其实验设备与Jensen等[31]和Johansen等[50]的设备相同。他们发现,燃料内Cl的含量对钾的释放规律有重要的影响。在高Cl/K 比的燃料中,一大部分钾在700~800℃范围内以KCl的形式释放;而在低Cl/K比的燃料中,KCl的释放并不明显,一部分K被固定在更具热稳定性的含钾硅酸盐中。Olsson 等[51]发现,高Cl 含量在500℃以上能够对钾的释放起到促进作用,而在500℃下却影响很小。前面总结到,Cl 的释放主要发生在挥发分挥发阶段,温度往往低于500℃,因此,挥发分挥发阶段并未释放完的富余Cl 能够促进钾在燃烧和燃尽阶段以KCl的形式被释放。
对于Cl含量较低的生物质,如木材,KCl并不是500~800℃范围内钾的主要释放形式。Dayton和Milne[52]认为,对于某些木材等Cl和K含量较低而S含量较高的生物质,一部分钾主要以K2SO4的形式释放并沉积在灰分中,支持了二次反应中路径②的猜想。当燃料中S 的含量相对于K 的含量较低时,K2SO4的释放也可忽略,K2CO3成为了高温下(800~1100℃)钾的主要释放形式,即钾的二次反应中的路径④。根据热力学平衡计算可知,K2CO3在800℃以上开始分解。Misra等[53]在热重实验中发现,根据燃料的不同,K2CO3在700~900℃的范围内分解。根据二次反应的路径③,Si 能够抑制钾的释放。Van-Lith 等[34-35]发现,具有最低K/Si 比的生物质中钾的释放量最低,因为更多的钾被Si 固定在矿物质中。Al 和Ti 的作用与Si 相似,具有固定钾并抑制其释放的作用。Ca 含量对于钾的释放也有重要影响,因为Ca 能够与钾在生成硅酸盐的过程中发生竞争。然而,Si、Ca等元素在钾的释放或固存中起到的作用仍不明确,需要进一步的研究。除了以上提到的钾释放的各种形式,部分有机物分解产生的原子钾可能不发生其他反应而被直接释放到环境中,即为二次反应中的路径⑤。对于木材等Cl 含量较低的生物质,当温度在500℃以下时,释放出的少量钾即可能属于这一部分。另外,当水蒸气存在时,气态的原子钾易转化为气态的KOH。Dayton等[21]发现,增加燃烧环境中的水蒸气含量有助于将释放的KCl转化为KOH,体现了二次反应中路径①和路径⑤的竞争关系。
3 影响生物质中钾释放的因素
根据生物质中钾的释放机理可知,影响钾释放的几个关键过程是一次释放、二次反应和自由基的催化。因此,影响生物质中钾释放的因素包括:燃料成分和粒径、反应温度和升温速率、反应器类型等。
3.1 燃料成分和粒径
不同种类的燃料成分不同,其燃烧和热解过程中钾的释放规律也有所不同。如前文所述,燃料中其他成分如Cl、S、Si、Al 等物质的含量都对钾的释放规律有影响。Cl 能促进钾以KCl 的形式释放,S 能促进钾生成K2SO4,Si 和Al 能抑制钾的释放并将其固存在灰中。另外,不同生物质中钾的含量和赋存形式也不尽相同,同样能够影响其释放规律。燃料的粒径对钾的释放规律也有影响。Davidsson等[24]和Blasing等[22]观测到,增大燃料的粒径对木材中钾的释放具有抑制作用。这是因为燃料的粒径越大,挥发分前体在颗粒内部的停留时间越长,颗粒内部发生的二次反应越多,从而抑制了挥发分的一次释放。
3.2 反应温度和升温速率
反应温度和升温速率对钾的释放规律具有非常重要的影响。在中等升温速率以下,钾在700℃以下的释放量都很低;在快速升温中,钾在700℃下的释放量已经很高,如图4 所示;在700℃以上,钾的释放量通常较高。Keown等[37]利用流化床/固定床两用反应器研究了升温速率对钾释放规律的影响,当设备采用流化床模式时升温速率大于1000℃/min,当设备采用固定床模式时其升温速率约为10℃/min。图4中(样品1和样品2)的结果证明,提高升温速率能够有效地促进钾的释放。一种可能的原因是高升温速率能够促进挥发分与有机物之间的反应,生成更多的自由基(如[H]),而自由基的产生能够促进有机钾的分解,从而释放出更多的钾。另一种解释为高升温速率能够降低挥发分挥发过程的时间,从而抑制了挥发分与有机物之间发生的二次反应。Okuno 等[36]发现,在生物质的快速热解反应中,焦炭生成过程中与焦炭生成后钾的释放同样强烈;而在慢速热解中,钾的释放主要发生在焦炭生成之后。图4 中样品3 和样品4 的比较直接说明,慢速热解过程中一次释放的钾比快速热解中一次释放的钾含量高,因为在样品3和样品4的实验中利用金属丝网反应器避免了一次释放的钾发生二次反应。这一结论被图4 中样品2 和样品3 的对比间接证明。这可能是因为高升温速率降低了挥发分在颗粒内部的停留时间,因而产生了更少的挥发分,但这一理论尚未被研究证实。600℃下,松木屑在金属丝网反应器中慢速热解(样品4)所释放的钾要高于甘蔗渣在流化床中快速热解(样品1)所释放的钾,而在700℃以上二者非常接近,这说明高升温速率产生的自由基在700℃以上更为活跃。
3.3 反应器类型
反应器类型决定了反应的升温速率和气流量等因素,从而影响钾的释放规律。比如,流化床比固定床的升温速率更高,能够促进自由基的产生从而促进钾的释放;金属丝网反应器能够提供He 气流来抑制二次反应的发生,进而促进钾的释放。在图4中,松木屑在金属丝网反应器中慢速热解所释放的钾(样品4)高于甘蔗渣在固定床反应器中慢速热解所释放的钾(样品2),这是因为He 气流抑制了钾的二次反应。当升温速率升至1000℃/min以上时,同样两组实验得到了相反的结果,松木屑在金属丝网反应器中快速热解所释放的钾(样品3)低于甘蔗渣在流动床反应器中快速热解所释放的钾(样品1),证明高升温速率产生的自由基对钾释放的促进作用要比抑制二次反应对钾释放的促进作用更为显著。
4 钾的释放机理
图6总结了生物质燃烧和热解过程中钾的释放过程和路径,用来阐述其释放机理。生物质燃料中钾的赋存形式包括有机钾、无机钾和含钾矿物质等(图6方框中物质);有机钾分解所释放出的一次产物(图6 三角形中物质),最终会经过不同路径的二次反应以其他形式释放或留在灰中;钾的最终释放形式与释放过程中发生的二次反应密切相关,主要包括KCl、K2SO4、含钾矿物质以及部分KOH(图6椭圆中物质)。钾在挥发分挥发阶段(图6实线所表示的过程)释放量较少,主要进行有机钾与无机钾的相互转化、钾的一次释放和二次反应,而在燃烧和燃尽阶段(图6虚线所表示的过程)释放量较多。
5 结语与展望
生物质燃烧和热解过程中钾释放的研究已经取得了实质性的进展。尽管如此,仍然有一系列问题尚未解释清楚,为了更好地理解生物质中钾的释放规律,以下问题有待研究人员进一步深入研究。

图6 钾的释放机理
(1)生物质的主要成分,即几种模型化合物(纤维素、半纤维素、木质素)对挥发分挥发阶段钾迁移和释放的影响。
(2)钾的迁移和释放过程中伴随的含Cl 产物的释放规律,以及钾释放与氯释放规律之间的关系。
(3)有机钾的分解和钾的一次释放特性。
(4)影响钾二次反应的条件,二次反应各路径之间的竞争关系以及钾的最终释放特性。
——李红,安明哲,苟梓希.CN 114180719A

