胰腺腺鳞癌临床特征的病例对照研究
任瑾 郭肖凡 任贺 高春涛
近年来,中国胰腺癌的发病率逐年上升,且其发病率约等于死亡率,5年生存率约为9%[1],而胰腺腺鳞癌为其中一种罕见的外分泌型恶性肿瘤,约占胰腺恶性肿瘤的1%~4%[2]。既往报道显示,胰腺腺鳞癌恶性程度较胰腺导管腺癌高,预后更差,然而大多数的报道为小样本或个案报道。因此,本文回顾性分析胰腺腺鳞癌患者的临床病理特征及预后,并与胰腺导管腺癌行配对研究,对比分析两者的差异性,以进一步提高对胰腺腺鳞癌的诊治水平。
1 材料与方法
1.1 一般资料
回顾性分析2014年8月至2019年4月于天津医科大学肿瘤医院行根治性手术的26例胰腺腺鳞癌及26例胰腺导管腺癌的临床资料。纳入标准:1)术前ECOG评分0~1分;2)术前未发生远处转移且行根治性手术;3)术前未行放化疗;4)术后病理确诊为腺鳞癌及胰腺导管腺癌;5)术后给予辅助化疗。排除标准:1)术前发生远处转移行姑息性手术或保守治疗;2)术后未给予辅助化疗;3)术后因非肿瘤原因死亡;4)合并其他部位的恶性肿瘤;5)病理诊断为其他类型胰腺癌。
1.2 方法
两组患者术前2周内查血清CA19-9 及CEA值,并行上腹部强化CT,评估是否可行根治性手术;肿瘤位于胰头者行胰十二指肠切除术,肿瘤位于胰体尾者行脾胰体尾切除术,必要时行联合周围脏器切除术;最后,依据组织病理学特征得出最终诊断。肿瘤TNM分期根据第8版美国癌症联合委员会(AJCC)分期。通过电话及查阅病例进行随访,术后每3个月随访1次,最终随访日期为2019年11月5日。
1.3 统计学分析
采用GraphPad 8.0.2软件进行统计学分析。两组患者中计数资料的对比采用t检验,计量资料采用χ2检验。统计描述呈正态分布,计量资料用表示,计数资料采用个数和百分位数表示。采用Cox回归模型分析两组生存情况,采用Kaplan-Meier法进行生存分析。P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床特征
两组中均为术前ECOG 评分,0者24例,1者2例;女性7例,男性19例;中位年龄为60岁;肿瘤位于胰头者12例,胰体尾者14例;TNM 分期:Ⅰb 期13例,Ⅱa期6例,Ⅱb期6例,Ⅲ期1例。胰腺腺鳞癌组肿瘤大小范围为2.5~10.0 cm,平均值为4.4 cm;胰腺导管腺癌组肿瘤大小范围为2.5~7.0 cm,平均值为3.9 cm。取总体CA19-9 的中位数214 U/mL 和CEA的中位数4.8 μg/L 为截止值(表1)。胰腺腺鳞癌组临床表现有黄疸者10例,腹部不适者8例,腹痛者9例,食欲减退者15例,体重下降者15例,无明显症状者1例;胰腺导管腺癌组临床表现有黄疸者7例,腹部不适者10例,腹痛者13例,食欲减退者6例,体重下降者12例,无明显症状者3例。
2.2 影像及病理学特征
部分胰腺腺鳞癌的上腹部强化CT出现中心坏死及环形强化,实性成分呈不均匀强化;部分胰腺腺鳞癌表现为实性低密度强化影,边界不清;胰腺导管腺癌大部分表现为实性低密度强化影,少部分伴囊性变(图1)。在显微镜下,腺鳞癌病理组织切片可见腺癌、鳞癌混杂,比例不一。免疫组织化学法检测示CK7、CK19 阳性,提示胰管来源;CK8/18 阳性提示有腺癌成分;P40、P63阳性提示有鳞癌成分(图2)。
2.3 手术方式
胰腺腺鳞癌组肿瘤位于胰头者12例均行胰十二指肠切除术,位于胰体尾者行脾胰体尾联合周围脏器切除者7例,单纯行脾胰体尾切除者7例。胰腺导管腺癌组肿瘤位于胰头者12例均行胰十二指肠切除术,位于胰体尾者14例均行脾胰体尾切除术。
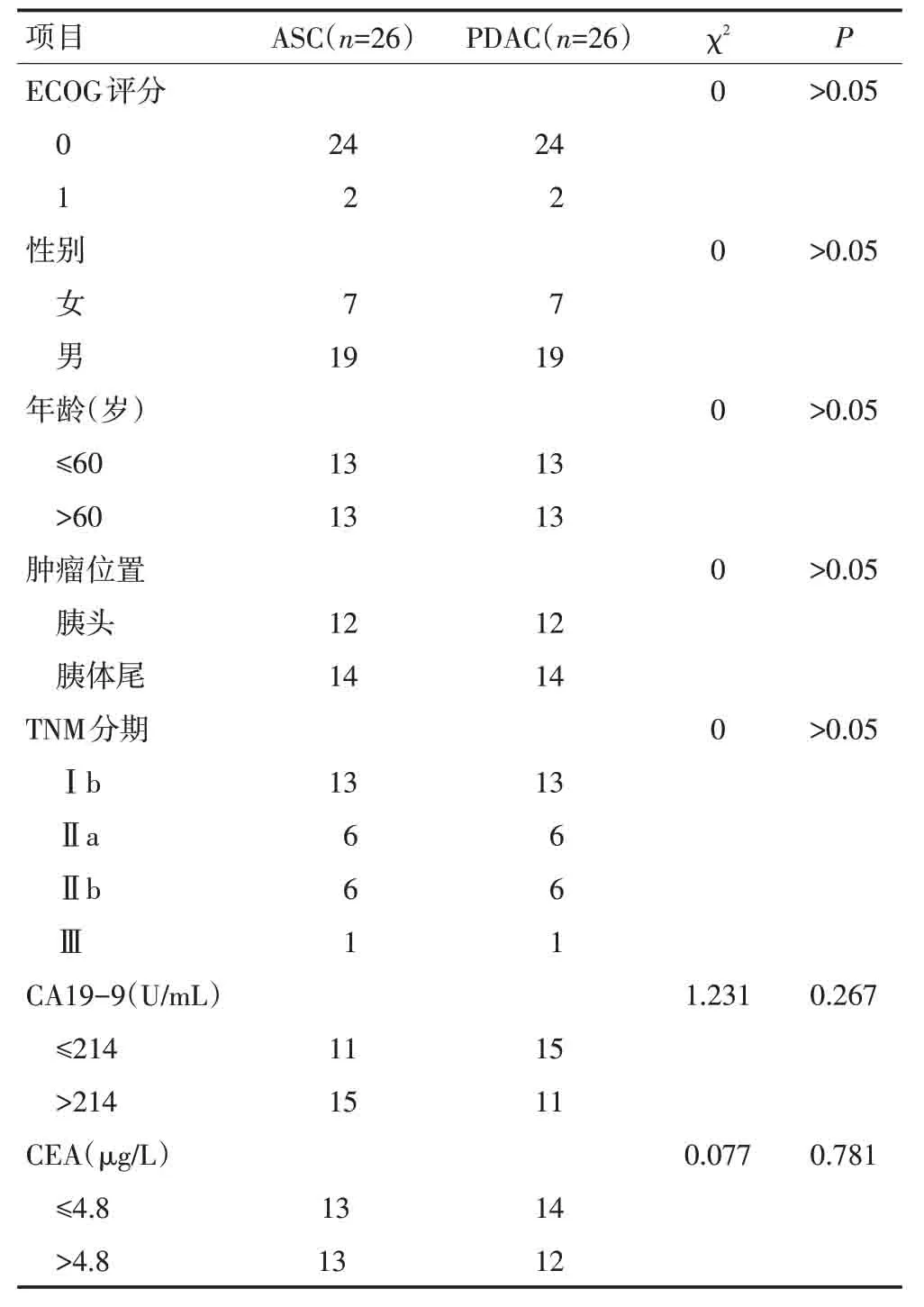
表1 两组患者一般资料比较

图1 胰腺腺鳞癌和胰腺导管腺癌CT表现
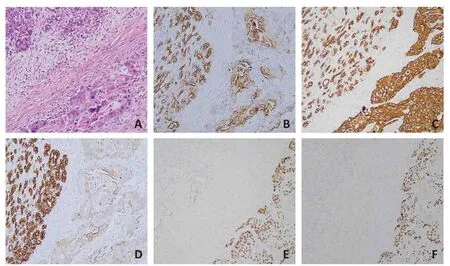
图2 胰腺腺鳞癌组织病理图
2.4 随访与预后
所有患者均得到有效随访。胰腺腺鳞癌患者中位生存期为8.5个月,胰腺导管腺癌中位生存期为19个月(HR:0.442,95%CI:0.224~0.872;P=0.019),差异具有统计学意义(图3)。

图3 两组患者的生存曲线
3 讨论
据报道,腺鳞癌可见于多个系统,例如肺癌、食管癌、结肠癌、胃癌、唾液腺和女性生殖系统。胰腺腺鳞癌是胰腺恶性肿瘤中的一种罕见类型,因其恶性程度较导管腺癌更高,近年来逐渐受到关注。有关于胰腺腺鳞癌的报道显示,男女发病比率约为1:1(男:女,63:57)[3],而在本研究中,胰腺腺鳞癌在男性中更常见(男:女=2.71:1)。目前关于胰腺腺鳞癌的发生机制有几种假设[4]:1)鳞状化生因慢性胰腺炎或腺瘤性肿瘤阻塞引起的导管炎症而发生,最终导致了恶变;2)碰撞理论:两种在组织学上不同的肿瘤在胰腺中同时出现,并结合在一起进而导致腺鳞癌发生;3)分化理论:原始的胰腺干细胞分化为鳞状或腺癌,或两者结合。但是,目前尚无研究阐明胰腺腺鳞癌的起源机制。
在血液学检查项目中,胰腺腺鳞癌没有特异性的肿瘤标志物。在部分研究中,胰腺腺鳞癌患者的CA19-9 和CEA 的水平均升高[5],但其他报道中CEA的水平正常[6]。本研究的胰腺腺鳞癌患者中,CA19-9升高者23例,正常者3例;CEA升高者13例,正常者13例。胰腺腺鳞癌与导管腺癌相比,未见特殊的临床表现。在本研究中,两组均有腹部不适、黄疸、腹痛、食欲减退等表现。
在影像学方面,胰腺腺鳞癌与导管腺癌无法明确区分。既往报道中,不论肿瘤大小,部分胰腺腺鳞癌肿瘤具有不同程度的中央坏死伴环形强化,部分肿瘤为实体成分[7-8]。而胰腺导管腺癌通常为实性,约有1%发生囊性变[9]。病理学方面:胰腺腺鳞癌同时含有腺癌和鳞癌两种成分,且两者比例不一。按目前指南的诊断要求,诊断胰腺腺鳞癌在胰腺肿瘤组织中至少需存在30%的鳞癌成分,但是这种分类系统仍存在争议。有人提出,胰腺癌中如果存在任何鳞状细胞癌成分,就应该将其归类为腺鳞癌[10]。
在治疗方面,完整的手术切除加上术后辅助化疗是可切除胰腺癌的标准治疗方式[11],且手术切除是胰腺腺鳞癌的最有效的治疗方法[12]。当肿瘤位于胰体尾部时,该区域相对于胰头周围的空间较大,肿瘤可变成巨大的浸润性病变,此时需行脾胰体尾联合周围脏器切除术。在本研究中,胰腺腺鳞癌组行脾胰体尾联合周围脏器切除者有7例,占脾胰体尾切除术的50%。有研究表明,术后辅助化疗可改善生存[13],但目前胰腺腺鳞癌尚无标准化疗方案。有报道称,胰腺腺鳞癌对免疫治疗有潜在敏感性[14]。
既往报道中,胰腺腺鳞癌的中位生存期为4~18个月,这主要与患者可采取的治疗方法有关。Smoot等[15]报道,胰腺腺鳞癌患者中接受R0切除者的中位生存期为14.4个月,而姑息治疗者的中位生存期为4.8个月。Boyd等[16]报道,胰腺腺鳞癌患者的1、2年生存率分别为50%和30%,而在胰腺导管腺癌患者为60%和36%。Hester等[17]报道,当队列中包括手术患者和非手术患者时,胰腺腺鳞癌和导管腺癌的总体生存率比较无显著差异,而当研究仅限于可根治性切除的患者时,胰腺腺鳞癌患者的预后较导管腺癌患者差。本研究主要分析根治性切除术后患者的预后,胰腺腺鳞癌中位生存期为8.5个月,而胰腺导管腺癌中位生存期为19个月,结果与既往报道类似,胰腺腺鳞癌的预后明显较差。
目前有关胰腺腺鳞癌的研究多为小样本单中心的研究,尚无法依据临床病理特征做出明确的结论。下一步需要进行更大样本量的多中心研究,这对阐明胰腺腺鳞癌恶性行为的机制以及制定特定的治疗策略至关重要。

