IL-1、IL-6在椎间盘源性腰痛患者椎间盘退变中的作用研究
杜志坡,张敬宾,李警,张朝,王建波
(河北省保定市第四中心医院,河北 唐县 072350)
椎间盘源性腰痛在发病过程中,由于纤维环破裂,髓核中的大量炎性介质暴露,能够刺激周围神经末梢,进而导致腰腿疼痛症状的发生[1-2]。有研究发现[3],在椎间盘退变的各个阶段中,均可检测到少量的IL-6、IL-1、IL-8、TNF-α、前列腺素E2等炎症因子,这些前炎症细胞因子,能够增强基质降解,加速椎间盘退变,还可引发局部炎症反应,刺激神经纤维末梢导致疼痛的发生。本研究通过分析IL-6、IL-1表达强度、椎间盘MRI信号值、患者临床症状三者之间的关系,探讨椎间盘源性腰痛发生的分子机制,旨在为临床诊治方面寻求新的思路和靶点。
1 资料与方法
1.1 一般资料
选择本院2016年3月-2017年12月收治的30例椎间盘源性腰腿痛患者为研究对象,其中男17例,女13例;年龄46-64岁,平均(51.5±5.6)岁;突出节段:L3-49例,L4-511例,L5-S1 10例;JOA评分为(12.4±1.1)分。入组患者均保守治疗无效,具有手术指征。本研究经医院伦理委员会批准进行,患者及家属书面签署知情同意书,明确本次研究方法及目的。
纳入标准:临床症状表现为反复腰痛及活动受限,时间≥1年;影响日常工作和生活;积极正规非手术治疗≥6个月无效或反复发作,经影像学检查结果,椎间盘造影阳性,诱发疼痛与平时疼痛类似,确定疼痛源为椎间盘退变节段。排除标准:症状轻微、功能良好、无手术意愿者;影像学检查未见明确的椎间盘退变,或同时存在并确定疼痛源为腰椎滑脱及椎管狭窄;合并严重内科疾病如糖尿病、高血压等,或存在免疫缺陷、急慢性感染者。
1.2 研究方法
1.2.1 MRI检查测定T2相对值(T2ratio)
术前行常规腰椎MRI检查,通过处理软件(IView BOLD)对椎间盘中矢状位髓核中央T2信号值(椎间盘T2值)进行测量,并测量背部皮下脂肪(同一水平面),得到背部脂肪平均T2值。每个样本的上述测量指标测量3次,取平均值,计算T2ratio。T2ratio=椎间盘T2值/背部脂肪平均T2值。
1.2.2 JOA评分测定
按照日本骨科协会腰痛JOA评分对患者的主观症状(腰痛、下肢痛及麻木、步行能力)、体征(直腿抬高试验、感觉障碍、运动障碍)、日常生活动作、膀胱功能进行评定。评分范围0-29分,分数越低表明功能障碍越明显。
1.2.3 椎间盘组织中IL-1、IL-6含量测定
对所有患者行椎间盘切除,必要时行腰椎融合术,术中留取部分切除的椎间盘2 mL标本,-70℃保存备用。采用马考斯亮蓝染色法测定椎间盘组织中IL-1、IL-6浓度。
1.2.4 观察指标
观察术前症状JOA评分,MRI图像处理软件收集T2ratio数据,马考斯亮蓝染色法测定IL-1、IL-6含量水平,分析临床症状JOA评分、T2ratio与IL-1、IL-6含量水平的相关性。
1.3 统计学分析
2 结果
所有患者的术前JOA评分为(12.4±1.1)分;经MRI检查,椎间盘T2值为52.3±4.6,背部脂肪T2值为79.4±8.5,T2ratio值为0.7±0.1;术后经检验,椎间盘组织中IL-1水平为(12.4±1.1)pg/mL,IL-6水平为(31.7±2.9)pg/mL。
经Pearson直线相关分析,IL-1、IL-6值均与T2ratio呈显著负相关(r=-0.781和-0.852,P=0.000),见图1-2;T2ratio与JOA评分呈显著正相关(r=0.764,P=0.000),见图3。
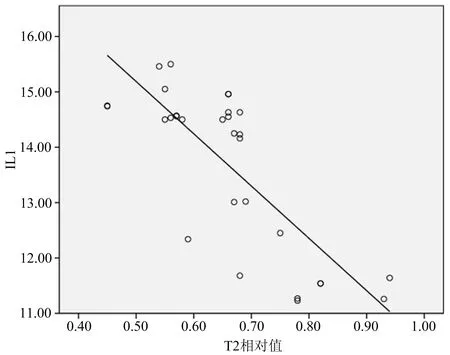
图1 IL-1值与T2ratio相关性分析
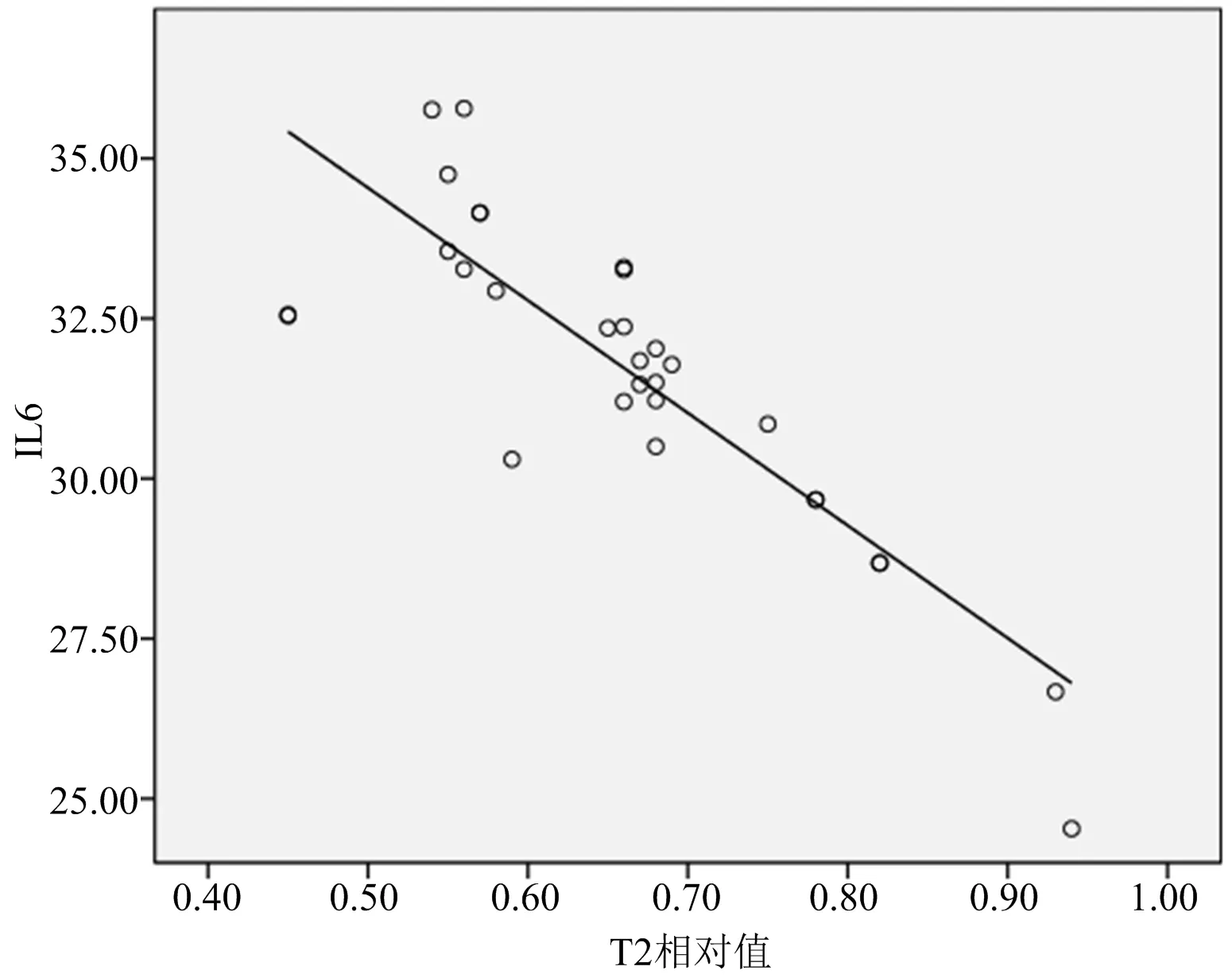
图2 IL-6值与T2ratio相关性分析
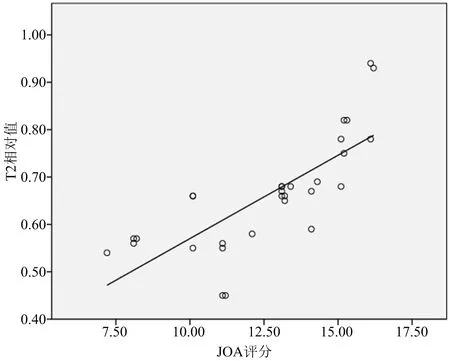
图3 T2ratio与JOA评分相关性分析
3 讨论
据美国国家卫生统计中心报告显示,在医院就诊的患者中,腰痛患者占总就诊人数的14%,慢性腰痛已经成为严峻的医疗及社会问题,也是目前临床研究的热点[4],但腰痛的确切发生机制尚未完全阐明。发生椎间盘源性腰痛时,椎间盘退变的主要病理表现为椎间盘代谢能力下降、含水量减少。随着退变的加速,纤维环发生破裂从而产生疼痛[5]。近年来,椎间盘源性腰痛的分子机制为学者们探索的热点,有研究显示,椎间盘内炎性介质(IL-1、IL-6)介导的自身免疫反应与椎间盘源性腰痛的发生发展密切相关[6]。其中,IL-1是机体内重要的炎症介质,可通过加速椎间盘内基质的降解速度加快椎间盘退变的进程[7]。体外实验显示,椎间盘细胞经过IL-1的处理后,基质的合成与分解平衡被打破,导致椎间盘退变向不可逆方向发展。Tonosu等[8]发现,在发生退变的椎间盘组织中,IL-1、神经生长因子的表达均明显升高,能够增强氧化应激反应,并随着炎症介质的释放产生炎性疼痛;IL-1还可以刺激靶细胞产生前列腺素E2,局部高浓度的前列腺素E2的代谢过程能够促使神经末梢感受器敏感性增强,痛觉敏感度增加[9]。有学者研究发现,IL-6能够激活和聚集炎性介质,加重退变椎间盘的炎症反应;还可以抑制纤维细胞对胶原的合成,导致髓核基质中的蛋白多糖丢失[10]。Levi等[11]通过检测退变的椎间盘髓核IL-6水平,发现其明显升高,提示IL-6与腰椎间盘退变的发生发展密切相关,其可能是导致椎间盘源性腰痛的关键因素之一。
MRI具有分辨率高、无创等优点,对椎间盘的形态及退变方面能够早期做出准确判断。椎间盘发生退变后,由于椎间盘内的自由水和结合水量均明显减少,能够引起MRI的T1驰豫时间延长,进而引起T2迟豫时间延长,因此T2WI对于椎间盘的信号改变最为敏感,能够早期、准确地评价椎间盘退行性变的程度。而在退变的椎间盘内,IL-1、IL-6均可影响到蛋白多糖的代谢,而蛋白多糖维持椎间盘含水量能力的减弱,在MRI表现为T2信号的减低。
本研究发现,IL-1、IL-6值均与T2ratio呈显著负相关(r=-0.781和-0.852,P=0.000);T2ratio与JOA评分呈显著正相关(r=0.764,P=0.000)。椎间盘源性腰痛患者,椎间盘MRI-T2信号值降低越明显,说明椎间盘内IL-1、IL-6含量水平就越高,其介导的自身免疫反应也越重,与临床症状呈明显相关性。此外,T2ratio与JOA评分呈显著正相关(r=0.764,P=0.000),表明椎间盘信号值降低,患者的功能障碍加重、生活质量降低。
综上所述,在椎间盘源性腰痛患者椎间盘退变的过程中,IL-1、IL-6发挥着重要作用,与疼痛症状的发生有相关性,对椎间盘内含水量的下降也有直接的促进作用。通过T2信号值与JOA评分可用来衡量椎间盘内IL-1、IL-6的含量,同时随着椎间盘T2信号的下降,患者的功能障碍也明显增加,说明IL-1和IL-6在椎间盘失水、椎间盘退变过程中发挥重要作用。因此,应寻求降低IL-1、IL-6表达水平,阻断介导的自身免疫反应,乃至寻求逆转椎间盘退变过程,从而为有效治疗椎间盘源性腰痛提供客观依据。

